青春期暴露氰戊菊酯对小鼠海马雄激素受体和雌激素受体的影响
2014-02-13赵莹莹徐德祥孟秀红
赵莹莹,代 波,王 华,张 程,徐德祥,孟秀红
◇预防医学研究◇
青春期暴露氰戊菊酯对小鼠海马雄激素受体和雌激素受体的影响
赵莹莹1,代 波1,王 华2,张 程2,徐德祥2,孟秀红1
目的探讨青春期小鼠暴露氰戊菊酯(Fen)对其大脑海马的雄激素受体(AR)和雌激素受体α(ERα)、雌激素受体β(ERβ)蛋白表达水平的影响。方法选取60只3周龄ICR小鼠,随机均分为空白组、溶剂对照组、Fen(0.02、0.2、2 mg/kg)处理组,每组雌雄各半,在出生后28~56 d里,Fen处理组给予相应量的Fen,溶剂对照组给予等容积的玉米油,空白组不予任何处理。灌胃4周后处死小鼠,取其大脑海马组织,采用Western blot法测定海马AR、ERα和ERβ的表达水平。结果①青春期暴露Fen引起雄鼠海马AR表达明显升高,雌鼠海马AR表达未发生显著性改变;②青春期暴露Fen雄鼠海马ERα和ERβ表达组间差异无统计学意义,雌鼠海马ERα和ERβ表达亦无显著变化。结论青春期暴露Fen干扰雄性小鼠海马AR的表达。
青春期;海马;雄激素受体;雌激素受体
氰戊菊酯(fenvalerate,Fen)属于Ⅱ型拟除虫菊酯类杀虫剂,近些年由于其高效、光谱、低残留等特点而广泛用于工农业生产中。有研究[1]证明,青春期暴露Fen可干扰小鼠大脑皮层睾酮(testosterone,T)和雌二醇(estradiol,E2)合成。大脑皮层和海马均可合成T和E2的各种关键酶,这些酶在维持大脑性分化和神经行为发育的过程中起重要的作用[2]。有研究[3]显示,成年期大鼠的循环雄激素和雌激素水平至少有一部分是通过雄激素受体(androgen receptor,AR)来调节。该研究通过检测青春期小鼠暴露Fen对海马AR、雌激素受体α(estrogen receptor α,ERα)和雌激素受体β(estrogen receptor β,ERβ)的影响,旨在阐明Fen对小鼠海马的内分泌干扰作用及其分子机制,为深入探讨其他环境内分泌干扰物的作用机制提供新思路。
1 材料与方法
1.1 实验动物60只3周龄SPF级ICR小鼠,雌雄各半,购于安徽省医学实验动物中心,适应性喂养1周。雌雄鼠分笼饲养,饲养环境为昼夜12h交替,室内温度维持在20~25℃,湿度控制在50%~60%。
1.2 主要试剂Fen、其他生化试剂均购自美国Sigma公司;AR、ERα和ERβ一抗抗体购自美国Santa Cruz或美国Upstate公司。
1.3 实验动物处理60只ICR小鼠随机均分为空白组、溶剂对照组、Fen(0.02、0.2、2 mg/kg)处理组,每组雌雄各半,在出生后28~56 d里,Fen(0.02、0.2、2 mg/kg)处理组按小鼠体重1%通过灌胃给予Fen,溶剂对照组给予等体积的玉米油,空白组不予处理。在56 d时处死小鼠,取其大脑海马组织置于-80℃。采用Western blot法测定海马中AR、ERα、ERβ蛋白表达水平。
1.4 Western blot法分析大脑海马用RIPA裂解液提取总蛋白,两次15 000 r/min离心15 min,Lowry法测总蛋白含量,对样本进行蛋白定量后用98℃10 min进行蛋白变性。以蛋白含量100 μg/孔的样品经过15%聚丙烯酰胺凝胶电泳3.5h后再以平行电泳方式转移到活化后的PVDF膜上。置于5%脱脂牛奶中4℃封闭过夜。次日用1∶1 000的小鼠抗兔的多克隆抗体AR、ERα、ERβ和兔抗小鼠的βactin室温孵育2~3h,用DPBST溶液洗涤4次,每次10 min,再用DPBS洗涤10 min。洗涤后的PVDF膜用辣根过氧化物酶标记的山羊抗兔IgG抗体(1∶40 000~80 000)孵育1~2h,再用DPBST洗膜。最后用增强化学发光ECL试剂盒进行检测,用X线片显影,以β-actin作为内参。
1.5 统计学处理采用SPSS 13.0统计软件分析,数据以±s表示,计量资料用方差分析。
2 结果
2.1 青春期小鼠体重小鼠生长发育状况良好,毛色正常,平均饮水量和饲料摄入量差异无统计学意义。青春期阶段均无疾病、感染和死亡现象,Fen(0.02、0.2、2 mg/kg)处理组小鼠体重与溶剂对照组体重相比差异无统计学意义,见表1。
表1 青春期Fen暴露对小鼠体重的影响(n=6,g,±s)
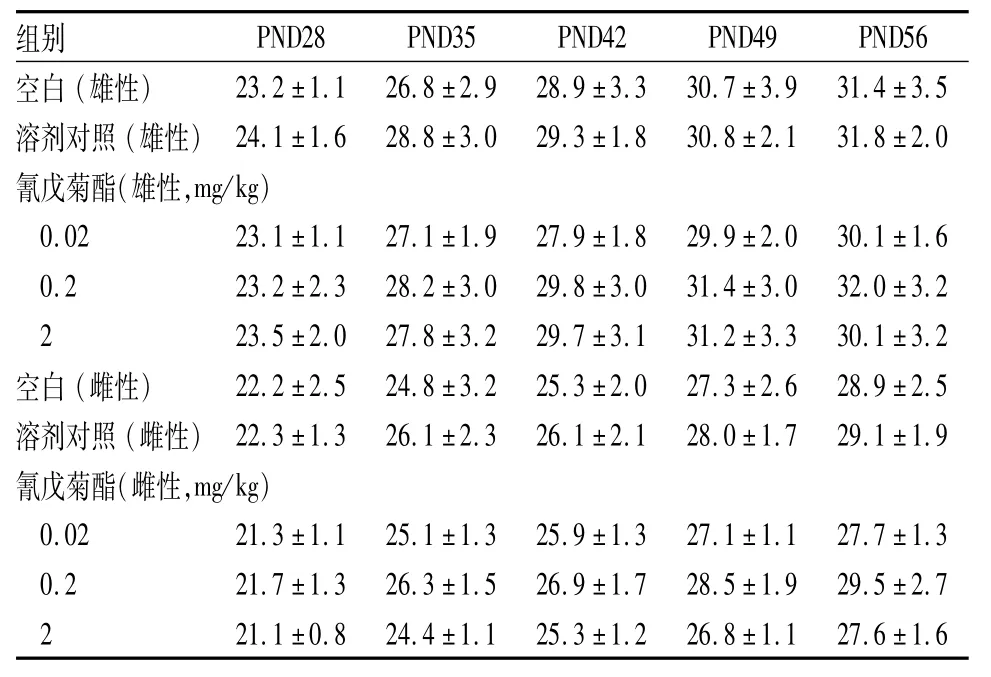
表1 青春期Fen暴露对小鼠体重的影响(n=6,g,±s)
注:PND为出生后天数
组别PND28PND35PND42PND49PND56空白(雄性)23.2±1.126.8±2.928.9±3.330.7±3.931.4±3.5溶剂对照(雄性)24.1±1.628.8±3.029.3±1.830.8±2.131.8±2.0氰戊菊酯(雄性,mg/kg)0.0223.1±1.127.1±1.927.9±1.829.9±2.030.1±1.6 0.223.2±2.328.2±3.029.8±3.031.4±3.032.0±3.2 2 23.5±2.027.8±3.229.7±3.131.2±3.330.1±3.2空白(雌性)22.2±2.524.8±3.225.3±2.027.3±2.628.9±2.5溶剂对照(雌性)22.3±1.326.1±2.326.1±2.128.0±1.729.1±1.9氰戊菊酯(雌性,mg/kg)0.0221.3±1.125.1±1.325.9±1.327.1±1.127.7±1.3 0.221.7±1.326.3±1.526.9±1.728.5±1.929.5±2.7 2 21.1±0.824.4±1.125.3±1.226.8±1.127.6±1.6
2.2 小鼠大脑海马AR蛋白表达青春期暴露Fen(0.02、0.2、2 mg/kg)4周,雄性Fen(0.2、2 mg/kg)处理组AR蛋白表达均出现明显上调,与溶剂对照组相比差异有统计学意义(P<0.01);而雌性Fen(0.02、0.2、2 mg/kg)处理组和雄性Fen(0.02 mg/kg)处理组与溶剂对照组比较,差异无统计学意义,见图1。
2.3 小鼠大脑海马ERα蛋白表达青春期暴露Fen(0.02、0.2、2 mg/kg)4周,雄性Fen(0.02、0.2、2 mg/kg)处理组和雌性Fen(0.02、0.2、2 mg/kg)处理组ERα蛋白表达与溶剂对照组比较,差异均无统计学意义,见图2。
2.4 小鼠大脑海马ERβ蛋白表达青春期暴露Fen(0.02、0.2、2 mg/kg)4周,青春期各处理组雄性小鼠和雌性小鼠ERβ蛋白表达与溶剂对照组比较,差异均无统计学意义,见图3。
3 讨论
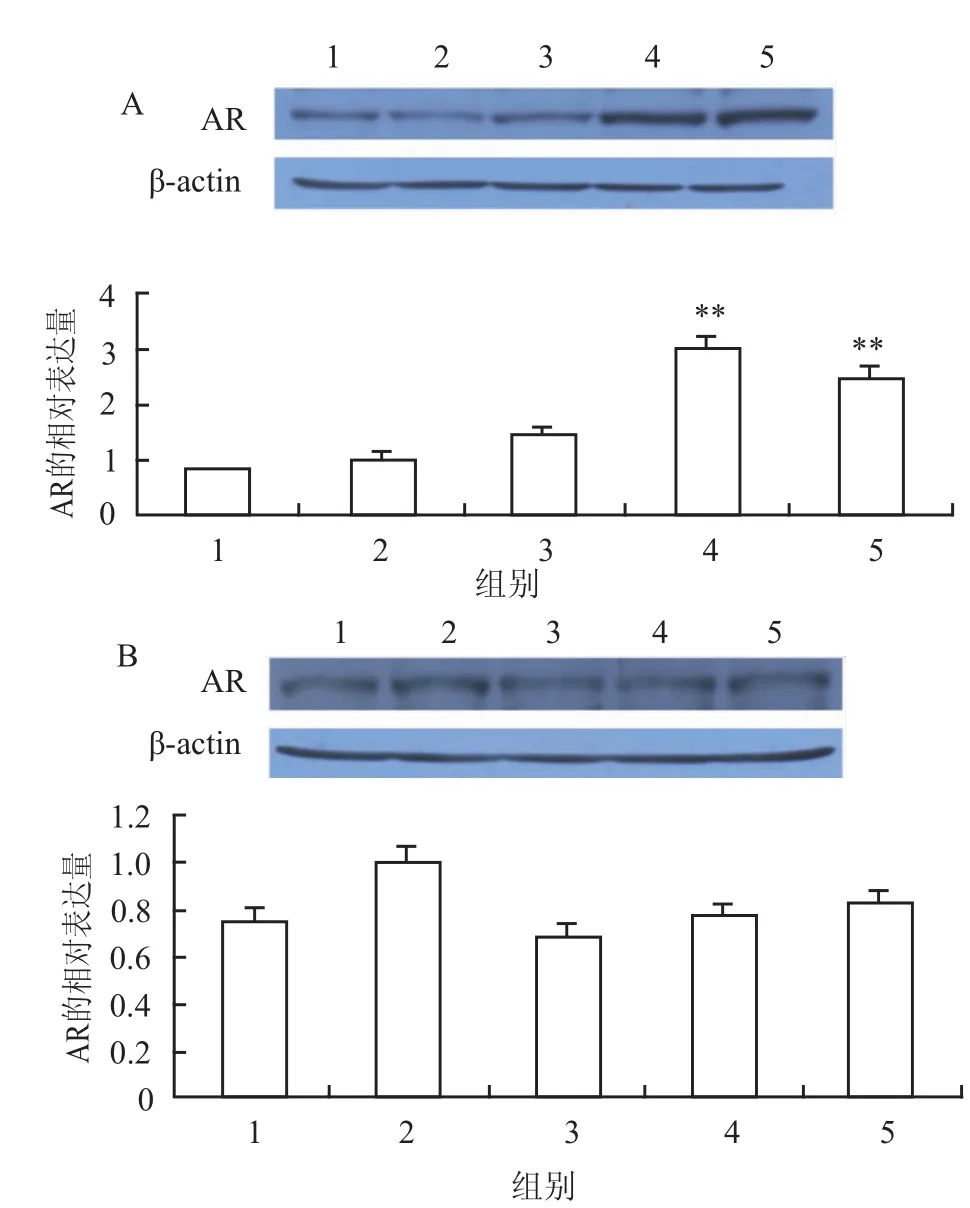
图1 青春期暴露Fen对小鼠大脑海马AR的影响
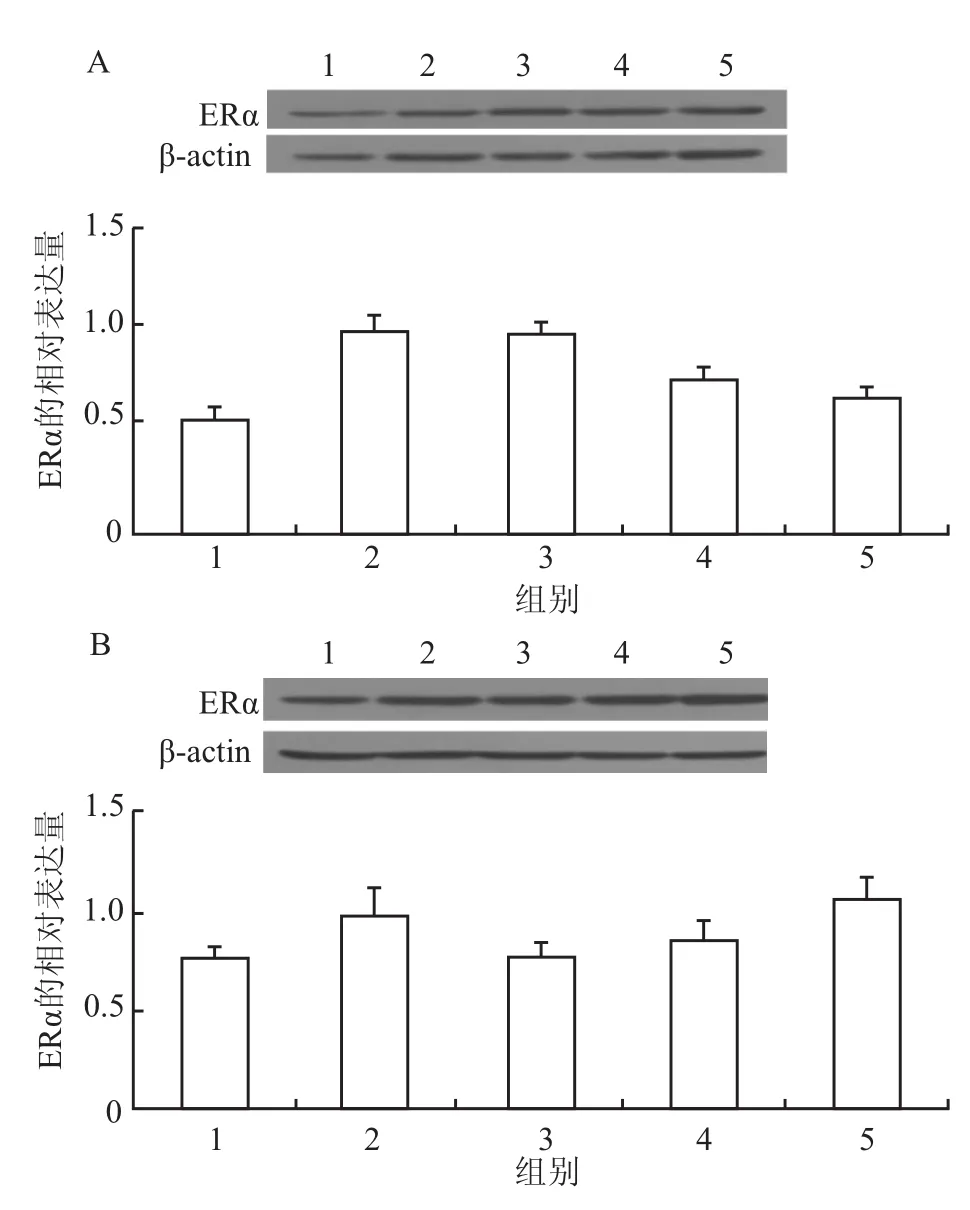
图2 青春期暴露Fen对小鼠大脑海马ERα的影响
Fen是一种潜在的环境内分泌干扰物。该研究探讨了青春期接触Fen对小鼠海马的内分泌干扰作用。体外实验[4]表明Fen具有微弱的拟雌激素活性。有研究[5]表明,孕期母鼠暴露于Fen,其子代雄性小鼠血清和睾丸中的T水平明显下降。另外有研究[6]显示,青春期及成年早期小鼠暴露Fen 60 mg/kg明显降低血清和睾丸中T含量。另有研究[7]表明,青春期暴露Fen影响小鼠大脑皮层T和E2水平,并上调大脑皮层AR的蛋白表达水平。Du et al[8]利用荧光素酶报告基因的方法得出Fen是AR的拮抗剂,能抑制AR和雄激素结合,并且可以通过AR、ER干扰内分泌系统。
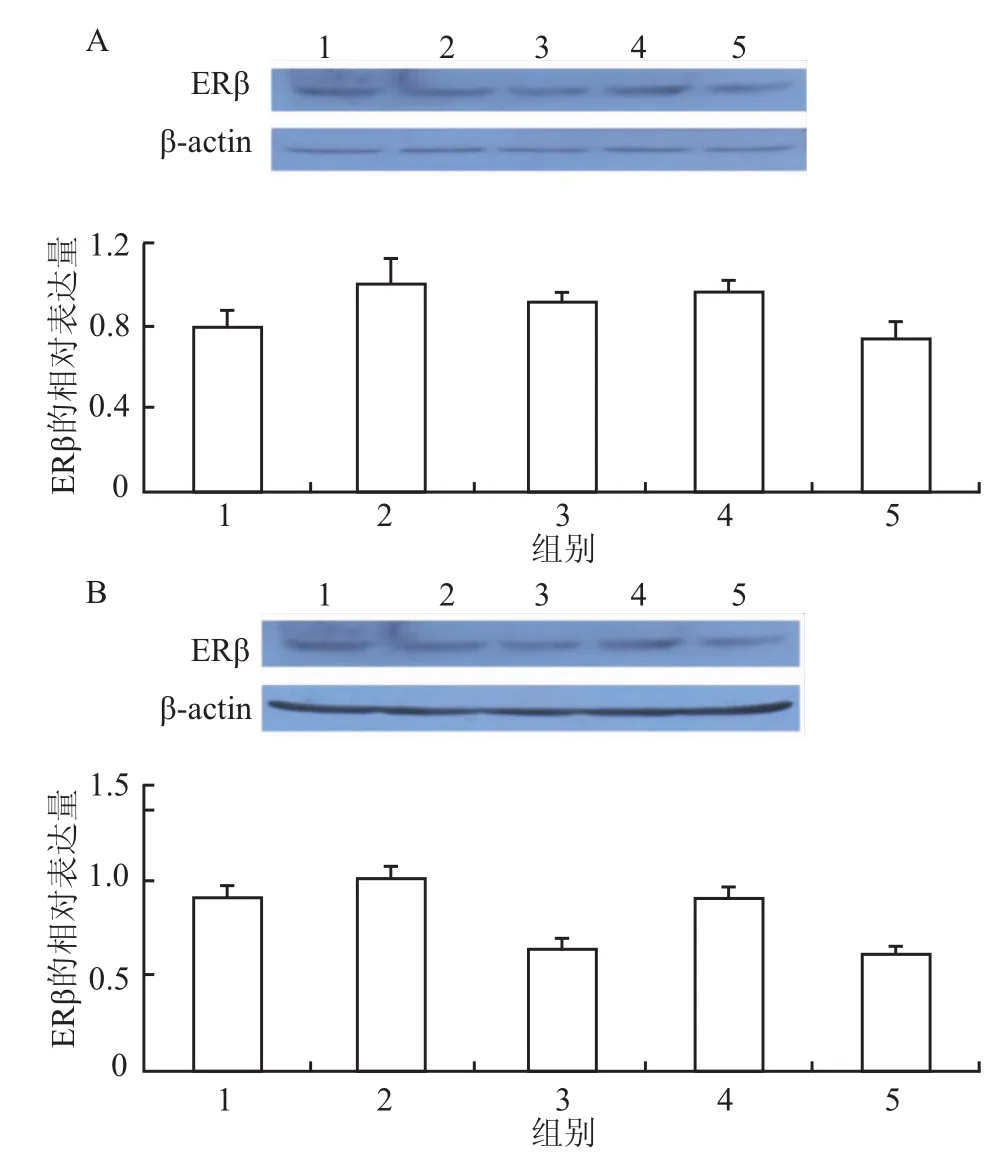
图3 青春期暴露Fen对小鼠大脑海马ERβ的影响
该研究探讨了青春期暴露Fen对小鼠海马AR、ERα和ERβ蛋白表达的影响。有研究[7]显示,青春期暴露高剂量Fen(7.5、30 mg/kg)2周和4周显示雌性小鼠大脑皮层AR蛋白表达均明显上调,而青春期暴露Fen 4周后,雄鼠大脑皮层AR(7.5、30 mg/kg)和ERβ 30 mg/kg蛋白表达明显上调。该实验青春期低剂量暴露Fen(0.2、2 mg/kg)4周上调雄性小鼠海马的AR蛋白表达水平,但雌性小鼠AR及雄鼠和雌鼠的ERα、ERβ蛋白表达水平变化差异无统计学意义。
有研究[9-10]显示,大脑皮层和海马合成的T通过神经元表达的AR和ERα、ERβ维持雄(男)性神经行为的正常发育,大脑皮层和海马神经元AR的选择性失活则损害雄性小鼠神经行为发育。另有研究[11]显示,大脑皮层和海马神经元CYP19和ERα选择性失活损害攻击性行为,提示雌激素和ERs在神经行为发育过程也起重要作用。其他的环境内分泌干扰物,比如双酚A(bisphenol A,BPA),在脑发育关键期接触低剂量BPA干扰大脑皮层和海马甾体激素合成,并导致探索和情绪行为发育障碍[12]。
[1] 刘 萍,孟秀红,王 华,等.青春期氰戊菊酯暴露对小鼠大脑皮层性激素的影响[J].安徽医科大学学报,2011,46(7):627-30.
[2] Paus T,Nawaz-Khan I,Leonard G,et al.Sexual dimorphism in the adolescent brain:Role of testosterone and androgen receptor in global and local volumes of grey and white matter[J].Horm Behav,2010,57:63-75.
[3] Sandstrom N J,Kim J H,Wasserman M A.Testosterone modulates performance on a spatial working memory task in male rats[J].Horm Behav,2006,50:18-26.
[4] Lemaire G,Mnif W,Mauvais P,et al.Activation of α-and β-estrogen receptors by persisten pesticides in reporter cell lines[J].Life Sciences,2006,79(12):1160-9.
[5] Zhang H,Wang H,Ji Y L,et al.Lactational fenvalerate exposure permanently impairs testicular development and spermatogenesis in mice[J].Toxicol Lett,2009,191:47-56.
[6] Zhang H,Wang H,Wang Q,et al.Pubertal and early adult exposure to fenvalerate disrupts steroidogenesis and spermatogenesis in mice at adulthood[J].J Appl Toxicol,2010,30(4):369-77.
[7] Liu P,Meng X H,Wang H,et al.Effects of pubertal fenvalerate exposure on testosterone and estradiol synthesis and the expression of androgen and estrogen receptors in the developing brain[J].Toxicol Lett,2011,201(2):181-9.
[8] Du G,Shen O,Sun H,et al.Assessinghormone receptor activities of pyrethroid insecticides and their metabolites in reporter gene assays[J].Toxicological Sciences,2010,116:58-66.
[9] Zuloaga D G,Morris J A,Jordan C L,et al.Mice with the testicular feminization mutation demonstrate a role for androgen receptors in the regulation of anxiety-related behaviors and thehypothalamicpituitary-adrenal axis[J].Horm Behav,2008,54(5):758-66.
[10]Lagunas N,Calmarza-Font I,Grassi D,et al.Estrogen receptor ligands counteract cognitive deficits caused by androgen deprivation in male rats[J].Horm Behav,2011,59(4):581-4.
[11]Bakker J,Honda S,Harada N,et al.Sexual partner preference requires a functional aromatase(cyp19)gene in male mice[J].Horm Behav,2002,42(2):158-71.
[12]Gioiosa L,Fissore E,Ghirardelli G,et al.Developmental exposure to low-dose estrogenic endocrine disruptors alters sex differences in exploration and emotional responses in mice[J].Horm Behav,2007,52(3):307-16.
Effects of pubertal fenvalerate exposure on androgen receptor and estrogen receptors inhippocampus of mice
Zhao Yingying1,Dai Bo1,Wang Hua2,et al
(1Dept of Maternal,Child&Adolescent Health,2Dept of Toxicology,Anhui Medical University,Hefei 230032)
ObjectiveTo investigate the effects of pubertal fenvalerate exposure on the expression of androgen receptor(AR)and estrogen receptors(ERs)inhippocampus.Methods60 male and female mice in postnatal day(PND)28 were randomly divided into five groups:the blank group,the control group and fenvalerate(0.02,0.2,2 mg/kg)group.Pubertal male and female mice in treatment groups were treated with fenvalerate(0.02,0.2,2 mg/kg)by gavage daily from PND28 to PND56,while the blank gave nothing and controls received corn oil.After four weeks,the mice were sacrificed,thenhippocampus was excised.Protein expression of AR,two estrogen receptors(ERα and ERβ)inhippocampus were analyzed by Western blot.ResultsIn males,the protein expression of AR inhippocampus was markedly upregulated in pubertal fenvalerate exposure.In females,the protein expression of AR inhippocampus was of no statistically significant differences between groups.There was no statistically significant difference of the ERα and ERβ protein expression among all the sexual groups.ConclusionPubertal fenvalerate exposure disrupts AR expression inhippocampus of mice.
puberty;hippocampus;androgen receptor;estrogen receptors
R 977.12;R 179;R 322.811
A
1000-1492(2014)04-0464-04
2013-10-10接收
安徽省自然科学基金(编号:11040606M185);国家自然科学基金(编号:81102155、81172711)
安徽医科大学公共卫生学院1儿少与妇幼保健学系、2毒理学系,合肥 230032
赵莹莹,女,硕士研究生;孟秀红,女,教授,硕士生导师,责任作者,E-mail:mengxiuhong@163.com
