Hippo 信号通路作用分子 TAZ 在人骨肉瘤及骨肉瘤干细胞中的表达
2014-02-13朱忠胜张春林汪泱
朱忠胜 张春林 汪泱
Hippo 信号通路作用分子 TAZ 在人骨肉瘤及骨肉瘤干细胞中的表达
朱忠胜 张春林 汪泱
目的检测在人骨肉瘤组织、骨肉瘤 MG63 细胞及其干细胞中 Hippo 信号分子 TAZ 的表达情况,比较骨肉瘤细胞和骨肉瘤干细胞中 TAZ 的表达差异,并探讨其可能的临床意义。方法2010 年 1 月至2012 年 1 月在我院治疗的骨肉瘤患者中,选取原发骨肉瘤组织标本 12 例,复发的骨肉瘤标本 6 例,另选 6 例骨纤维结构不良组织作阴性对照,并贴壁培养骨肉瘤 MG63 细胞,采用免疫组化方法检测骨肉瘤组织和骨肉瘤MG63 细胞中 TAZ 的表达情况;用无血清悬浮培养骨肉瘤 MG63 细胞,分离并收集骨肉瘤细胞球,通过定量反转录-聚合酶链反应 ( RT-PCR ) 法检测骨肉瘤 MG63 细胞及骨肉瘤细胞球中胚胎干细胞标志基因 ( Nanog,Oct4 ) 和 Hippo 信号分子 TAZ 的表达,Western 印记法检测 MG63 细胞和细胞球中 TAZ 蛋白的表达情况。结果在 12 例人骨肉瘤原发组织标本中,3 例骨肉瘤组织 TAZ 表达阳性,而 6 例骨肉瘤复发组织中 TAZ 表达全部阳性,在骨肉瘤细胞 MG63 中 TAZ 分子表达也呈阳性,而骨纤维结果不良中全部表达阴性。与骨肉瘤MG63 细胞相比,RT-PCR 显示培养的骨肉瘤细胞球中干细胞标志基因 Nanog,Oct4 和 Hippo 信号分子 TAZ 明显高表达。Western blot 提示细胞球中 TAZ 蛋白表达明显高于骨肉瘤 MG63 细胞。结论骨肉瘤组织中存在TAZ 分子的表达,在复发骨肉瘤组织中呈高表达;在骨肉瘤细胞株中也存在 TAZ 分子的表达,而在干细胞中TAZ 分子表达更高;提示其与骨肉瘤干细胞的特征具有一定的相关性。
骨肉瘤;肿瘤干细胞;Hippo 信号通路;TAT 分子
Hippo 信号通路是近年来在果蝇中研究发现的一个高度保守的生长控制信号通路,其对器官大小及细胞增殖和凋亡具有关键的调节作用。TAZ ( transcriptional coactivator with PDZ- binding motif,含有 PDZ结合模序的转录共激活物 ) 是 Hippo 信号通路中的一个重要的作用靶点,研究发现 TAZ 参与人多种肿瘤的发生发展,并在部分肿瘤中,TAZ 赋予肿瘤细胞干细胞相关特点[5-6]。在骨肉瘤组织,骨肉瘤细胞系及骨肉瘤干细胞领域中,目前尚未有关 TAZ 表达及其相关作用的报道,本实验采用免疫组织化学方法、细胞爬片及无血清培养法从人骨肉瘤细胞株中分离出培养肿瘤干细胞,来检测 TAZ 的表达情况。
材料与方法
一、材料和试剂
人骨肉瘤 MG63 细胞株 ( 中国科学院细胞库 ),DMEM 培养基 ( Gibco 公司 ),DMEM/F12 ( 1∶1 )培养基 ( Gibco 公司 ),胎牛血清 ( Biowest 公司 ),0.25% 胰蛋白酶 ( Gibco 公司 ),人表皮生长因子( EGF ) ( Protech 公司 ),B27 ( Gibco 公司 ),BSA ( 碧云天公司 ),兔抗人 TAZ 多克隆抗体 ( Cell signaling technology 公司 ),RNA 提取试剂 Trizol ( Takara 公司 ),逆转录试剂盒 ( Fermentas 公司 ),RT-PCR 试剂盒 ( TOYOBO 公司 ),PCR 引物 ( 上海捷瑞生物工程有限公司 ),青霉素、链霉素 ( Hyclone 公司 )。
二、实验方法
1. 骨肉瘤组织免疫组化试验:取普通型骨肉瘤原发标本 12 例,复发的骨肉瘤标本 6 例,骨纤维结构不良标本 6 例作阴性对照。采用免疫组化SP 法进行:( 1 ) 组织切片经二甲苯和梯度酒精脱蜡、水化;( 2 ) 80% 甲醇消除内源性酶;( 3 ) 加热0.01 M 枸橼酸钠缓冲溶液 ( pH6.0 ) 对组织进行抗原热修复;( 4 ) 血清封闭;( 5 ) 滴加 I 抗 ( 1∶50 稀释 ),滴加 II 抗,进行抗原抗体结合;( 6 ) DAB 显色;( 7 ) 苏木精复染;( 8 ) 脱水、封片、镜检。
2. 细胞爬片及细胞免疫组化:将事先已处理好的盖玻片置入 24 孔板中,取生长旺盛的骨肉瘤 MG63细胞经胰酶消化后,按 1×105/ ml 接种于 24 孔中,将传代后 2 天已贴壁的骨肉瘤 MG63 细胞按细胞免疫组化步骤进行染色,检测 TAZ 蛋白的表达,以磷酸盐缓冲液 ( PBS ) 代替一抗作为阴性对照。
3. 无血清培养骨肉瘤干细胞:取生长旺盛的骨肉瘤 MG63 细胞用 0.25% 胰蛋白酶消化 3~5 min,10% 血清终止消化,吹打成单细胞悬液,离心( 1000 r / min,离心半径 8 cm ) 5 min 弃上清液后,用无血清培养基 ( DMEM / F12 培养基,含 EGF 20 μg / L、B27 ( 50×)、BSA 4 g / L、胰岛素 5 mg / L、调 pH至 7.2~7.5 ) 重悬细胞,调整细胞浓度至 5×103/ ml终浓度,总体积 10 ml 接种于 T25 培养瓶中,竖立在 37℃、5% CO2浓度的培养箱中培养,每天摇动2 次。培养后 7 天,去除上层培养基 5 ml,加入新鲜无血清培养基 5 ml。10~14 天后,悬浮的肉瘤细胞球体积较大后,吸取培养基并离心 ( 1000 r / min,离心半径 8 cm ) 5 min,弃上清液,加 0.05% 胰酶消化,吹打成单细胞悬液,离心后 ( 1000 r / min,离心半径 8 cm ) 5 min 去胰酶加无血清培养基按 1∶2 或1∶3 比例传代。
江湖中,六扇门里,都知道扬州城曾出过一起惊世大案:盐铁转运使陆府几十口全部被杀,仅有十三岁的公子陆枫桥逃脱。
4. RT-PCR:检测 MG63 细胞及悬浮细胞球中Nanog、Oct4、TAZ mRNA 的表达。Nanog 引物序列上游为:5’-GA ACTCTCCAACATCCTGAACCT-3’,下游为:5’-TCTGCGTCACACCATTGCTAT-3’;Oct4引物序列上游为:5’-AGAAGGATGTGGTCCGAGTG-3’,下游为:5’-GAAGTGAGGGCTCCCATA-GC-3’;TAZ 引物序列上游为:5’-ACGTCCTTCCTAACAGTCC-3’,下游为:5’-TGCCTGAGTCTTCAGATGC-3’;内参 Gapdh 引物序列上游为:5’-GAAGGTGAAGGTCGGAGTC-3’,下游为:5’-GAAGATGGTGATGGGATTTC-3’。选取生长状态良好的贴壁细胞和骨肉瘤悬浮细胞球,按 Trizol 试剂盒说明提取细胞内 RNA,RNA 经 Fermentas 逆转录试剂盒反转录为 cDNA,反应条件为 42 ℃,60 min,70 ℃,5 min。按照 Takara SYBGreen 说明书配制 RT-PCR反应体系。反应条件为 95 ℃,1 min,( 95 ℃ 15 s,60 ℃ 15 s,72 ℃ 45 s )×40 cycle,并加做溶解曲线了解引物特异性。
5. Western blot:检测 MG63 细胞及细胞球中TAZ 蛋白表达。收集 1×106个骨肉瘤贴壁细胞及骨肉瘤细胞球,加入蛋白裂解液,4 ℃ 离心 ( 12 000 r / min,离心半径 5 cm ) 5 min,提取上清液。常规电泳、转膜,封闭,加入一抗 TAZ ( 1∶1000 ),杂交。以 β-actin 为内参。
三、统计学处理
应用 SAS9.13 统计学软件。计量资料组间比较采用独立 t 检验,计数资料组间比较用 Fisher 确切概率法检验,P<0.05 为差异有统计学意义。
结 果
一、TAZ 蛋白在人骨肉瘤组织中的表达
骨肉瘤原发标本 12 例中 3 例 TAZ 表达阳性( 25% ),6 例复发的骨肉瘤标本 TAZ 表达全部阳性( 100% ),6 例骨纤维结构不良标本 TAZ 表达全部阴性 (图1 ),TAZ 在骨肉瘤原发标本和复发标本中的表达差异有统计学意义 ( P=0.009 )。
二、TAZ 蛋白在人骨肉瘤 MG63 细胞中的表达
对已贴壁生长的骨肉瘤 MG63 细胞进行免疫组化染色,检测在骨肉瘤 MG63 细胞中有 TAZ 蛋白的表达,细胞形态良好,TAZ 蛋白分布在胞核和胞浆中 (图2 )。
三、骨肉瘤细胞球的形态观察及干细胞标志基因检测
骨肉瘤 MG63 细胞在无血清培养基中悬浮培养后,24 h 可见大部分细胞死亡、裂解,少数细胞存活,呈悬浮状态,另有极少数细胞贴壁、折光性差。培养后 5~7 天可见只有数个细胞的圆形细胞球,呈悬浮状态。10~14 天时悬浮细胞球体积逐渐增大,折光性好 (图3A )。显微镜下观察成球比约为 ( 1.29±0.29 ) ‰。将生长良好的细胞球离心,传代后 10~14 天仍可形成肿瘤细胞球,形态规则。
通过 RT-PCR 检测骨肉瘤干细胞标志基因Nanog、Oct4,显示 Nanog、Oct4 mRNA 在骨肉瘤 MG63 细胞中呈低表达,而在骨肉瘤细胞球中Nanog、Oct4 mRNA 高表达 (图3B ),两组 Nanog、Oct4 表达差异有统计学意义 ( P 值分别为 0.0029、0.0043 )。
四、骨肉瘤 MG63 细胞和细胞球中 TAZ mRNA和蛋白表达情况
RT-PCR 和 Western blot 结果显示在骨肉瘤 MG63 细胞和骨肉瘤 MG63 细胞球中都有 TAZ mRNA 和蛋白的表达,但 TAZ mRNA 和蛋白在骨肉瘤细胞球中的表达明显高于骨肉瘤细胞 (图4 ),两组间差异有统计学意义 ( P 值分别为 0.0099、0.0011 )。

图1 TAZ 的表达 ( 免疫组化,SP ×200 ) A:纤维结构不良中 TAZ 无表达;B:原发骨肉瘤中 TAZ 有表达;C:复发骨肉瘤中 TAZ 高表达Fig.1 The expressions of TAZ ( immunohistochemistry, SP ×200 ) A: The expressions of TAZ were not found in patients with fbrous dysplasia of bone; B: The expressions of TAZ were found in primary osteosarcomas; C: High expressions of TAZ were found in recurrent osteosarcomas
讨 论
一、骨肉瘤干细胞的分离方法及研究意义
目前对骨肉瘤干细胞的研究主要为鉴定其特异性生物学标志,目的在于应用特异性的生物标志有效筛选骨肉瘤干细胞,从而进一步研究其发病机制和生物靶向治疗。怎样去分离和鉴定肿瘤中小部分的肿瘤干细胞曾是困扰骨肉瘤干细胞研究的一个难题。自从骨肉瘤干细胞第一次在三维悬浮无血清条件下培养出细胞球而获得后、越来越多的方法被用于分离和纯化骨肉瘤干细胞。当前,分离骨肉瘤干细胞的方法主要有三种,包括:球细胞培养法、根据表面标志 ( CD133,STRO-1,CD117 等 ) 分选、侧群细胞分选。分离出的骨肉瘤干细胞,通过检测其自我更新能力、细胞克隆形成能力、细胞增殖分化能力,表达干细胞标志基因及细胞成瘤实验来鉴定其干细胞特性[7]。
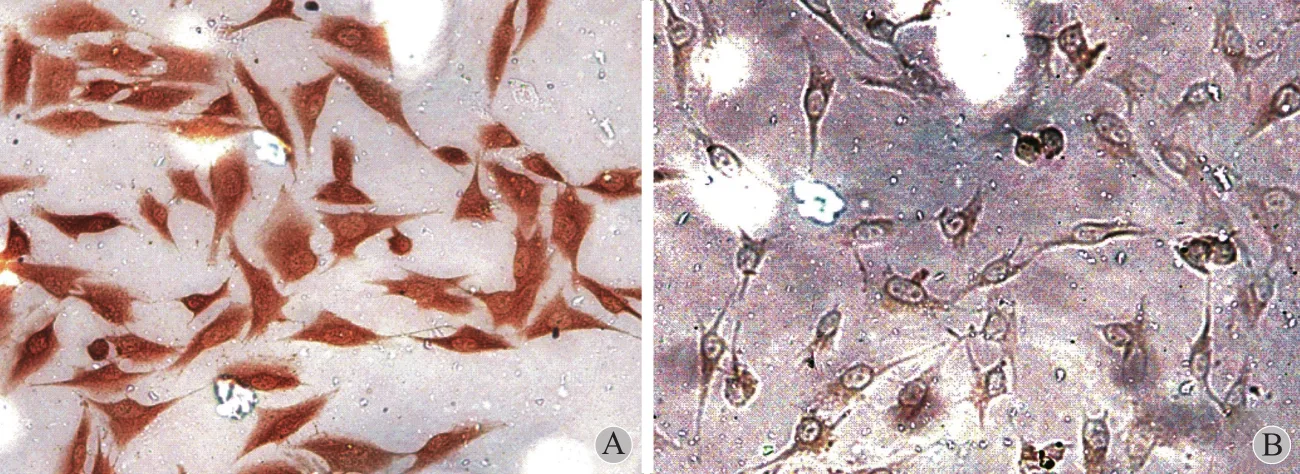
图2 A:TAZ 在骨肉瘤 MG63 细胞中的表达 ( 免疫组化,SP ×200 );B:阴性对照Fig.2 A: The expressions of TAZ in osteosarcoma MG63 cells ( immu-nohistochemistry, SP ×200 ); B: The negative control

图3 A:骨肉瘤 MG63 干细胞,MG63 细胞无血清悬浮培养后 10 天,单个细胞分裂生长呈球状;B:Nanog,Oct4 mRNA 在 MG63 细胞中低表达,在 MG63 干细胞中高表达Fig.3 A: Osteosarcoma MG63 stem cells and MG63 cells were cultured in suspension in serum-free medium for 10 days, and single cells were divided and grew into spherical cells; B: Low expressions of Nanog and Oct4 mRNA were found in MG63 cells, but high expressions in MG63 stem cells
Gibbs 等[4]应用无血清培养法分离培养出骨肉瘤细胞球,第一个证实骨肉瘤中存在干细胞样细胞,这种细胞具有很强的自我更新能力和增殖分化能力,并高表达胚胎干细胞标志物 Oct4、Nanog。后来逐渐发现该类细胞球具有高致瘤性和化疗耐药性[8]。这种用于骨肉瘤干细胞的培养技术借鉴着神经细胞球培养技术,曾用于分离扩增正常组织中干细胞。骨肉瘤干细胞同样具有在悬浮条件下形成细胞球的特征,给予无血清和悬浮条件能筛选原始未分化细胞,而分化的细胞不能够生存,从而分离得到干细胞。本组实验应用无血清培养基分离培养出骨肉瘤球细胞,具有干细胞相关特性,同样高表达干细胞标志基因 Oct4,Nanog,其成球比为 ( 1.29± 0.29 ) ‰,与国内外其它报道结果相似。
二、TAZ 分子在肿瘤中的作用
TAZ 分子也称为 WWTR1 ( WW domain contain transcription regulator 1,含 WW 结构域的转录调节子 1 )。TAZ 蛋白与 YAP 蛋白同源,两者之间有 46%的氨基酸序列相同。TAZ 和 YAP 与果蝇的 Yki 同源,为 Hippo 信号通路下游的一个调控靶点,并能够促进肿瘤形成[9]。Chan 等[5]在 40 种人肿瘤细胞系中筛选发现 TAZ 在侵袭性乳腺癌细胞系 Hs578t,BT549 和 MDA-MB-231 中高表达。通过基因过表达和沉默方法证实 TAZ 蛋白能够促进细胞迁移和侵袭,并能够促进乳腺癌细胞表型转化。TAZ 不仅能促进细胞增殖和上皮间质转化 ( EMT ),而且能够引起细胞恶性转变[10];研究发现在乳腺癌细胞中,TAZ 通过靶向基因 Cyr61 和 CTGF,对化疗药物紫杉醇耐药,沉默 Cyr61 和 CTGF 基因可以逆转 TAZ 诱导的紫杉醇耐药[11]。目前发现 TAZ 与乳腺癌干细胞相关特征相关,在乳腺癌干细胞和低分化乳腺癌标本中,TAZ 的表达水平明显增高,并且 TAZ 表达与乳腺癌转移和病理分级相关。在乳腺癌干细胞中,需要 TAZ 分子来保持细胞自我更新和肿瘤起始能力。TAZ 分子能赋予非肿瘤干细胞自我更新能力,而其分子机制可能是,TAZ 与细胞极性决定因子scribble 形成复合物,scribble 的丢失,或诱导 EMT及通过 Hippo 核心激酶达到 TAZ 抑制剂的解离[6]。除了乳腺癌,TAZ 在非小细胞肺癌和结直肠中也高表达,并作为一个判断预后的指标,在非小细胞肺癌细胞中沉默 TAZ 分子可抑制细胞增殖和致瘤性质[12-13];另外,TAZ 通过调节间质分化促进恶性神经胶质瘤发展,胶质母细胞瘤的基因组图谱显示带有间质基因表达的患者其整体生存率差,伴有治疗抵抗。显示 TAZ 同间质基因表达网络高度相关。在间质胶质瘤干细胞中沉默 TAZ 的表达可降低细胞间质标志的表达、侵袭力、自我更新和肿瘤形成能力。反过来,TAZ 的过表达可诱导间质标志表达和以 TEAD 依赖形式的异常成骨和成软骨分化。同TEAD 的相互作用显示非常重要,因此 TAZ 和 TEAD可能操纵这恶性神经胶质瘤的间质分化[14]。

图4 骨肉瘤 MG63 细胞和干细胞中 TAZ mRNA 和蛋白的表达及表达差异。RT-PCR 和 Western blot 显示在 MG63 干细胞中 TAZ mRNA 和蛋白的表达明显高于 MG63 细胞Fig.4 The expressions and expression differences of TAZ mRNA and proteins in osteosarcoma MG63 cells and stem cells. The RT-PCR and Western blot analysis results indicated that the expressions of TAZ mRNA and proteins were signifcantly higher in MG63 stem cells than that in MG63 cells
三、骨肉瘤组织和细胞中 TAZ 分子的表达及可能的意义
TAZ 作为 Hippo 信号通路下游一个调控靶点,已在多种肿瘤中发现并表达上调,并起着促进肿瘤生长、抑制凋亡、化疗抵抗、促进肿瘤转移等功能,而其分子机制与调控机制目前尚不完全清楚。但 TAZ 作为一个癌基因,在多种肿瘤中异常表达并发挥促进肿瘤发生发展的作用。在此,我们通过有限的实验方法揭示了 TAZ 分子在骨肉瘤组织和细胞中都存在表达,而且在复发的骨肉瘤标本与原发骨肉瘤标本中存在表达差异,提示其与肿瘤复发可能存在一定相关性,在一个侧面反映了 TAZ 分子可能与骨肉瘤干细胞存在联系。通过无血清培养法培养出骨肉瘤 MG63 细胞的干细胞,通过 PCR 和 western检测,发现 TAZ 分子在骨肉瘤细胞和干细胞中也存在表达差异,在干细胞中 TAZ 表达更高,在一定程度上进一步提示了 TAZ 可能参与了骨肉瘤干细胞的相关特性。为接下来的 TAZ 对细胞增殖、分化功能影响和参与干细胞调控作用的研究提供实验基础。今后将借助更多的实验方法,深入研究 TAZ 分子在骨肉瘤中的表达、功能及可能作用机制,以确定TAZ 是否是骨肉瘤中一个重要生物标志,为骨肉瘤的诊断、治疗提供新的靶点。
[1] Clarke MF, Dick JE, Dirks PB, et al. Cancer stem cells--perspectives on current status and future directions: AACR Workshop on cancer stem cells. Cancer Res, 2006, 66(19): 9339-9344.
[2] Ischenko I, Seeliger H, Schaffer M, et al. Cancer stem cells: how can we target them? Curr Med Chem, 2008, 15(30): 3171-3184.
[3] Koch U, Krause M, Baumann M. Cancer stem cells at the crossroads of current cancer therapy failures--radiation oncology perspective. Semin Cancer Biol, 2010, 20(2): 116-124.
[4] Gibbs CP, Kukekov VG, Reith JD, et al. Stem-like cells in bone sarcomas: implications for tumorigenesis. Neoplasia, 2005, 7(11):967-976.
[5] Chan SW, Lim CJ, Guo K, et al. A role for TAZ in migration, invasion, and tumorigenesis of breast cancer cells. Cancer Res, 2008, 68(8):2592-2598.
[6] Cordenonsi M, Zanconato F, Azzolin L, et al. The Hippo transducer TAZ confers cancer stem cell-related traits on breast cancer cells. Cell, 2011, 147(4):759-772.
[7] Liu B, Ma W, Jha RK, Gurung K. Cancer stem cells in osteosarcoma: Recent progress and perspective. Acta Oncol, 2011, 50(8):1142-1150.
[8] Fujii H, Honoki K, Tsujiuchi T, et al. Sphere-forming stem-like cell populations with drug resistance in human sarcoma cell lines. Int J Oncol, 2009, 34(5):1381-1386.
[9] Huang J, Wu S, Barrera J, et al. The Hippo signaling pathway coordinately regulates cell proliferation and apoptosis by inactivating Yorkie, the Drosophila Homolog of YAP. Cell, 2005, 122(3):421-434.
[10] Lei QY, Zhang H, Zhao B, et al. TAZ promotes cell proliferation and epithelial-mesenchymal transition and is inhibited by the hippo pathway. Mol Cell Biol, 2008, 28(7):2426-2436.
[11] Lai D, Ho KC, Hao Y, Yang X. Taxol resistance in breast cancer cells is mediated by the hippo pathway component TAZ and its downstream transcriptional targets Cyr61 and CTGF. Cancer Res, 2011, 71(7):2728-2738.
[12] Zhou Z, Hao Y, Liu N, et al. TAZ is a novel oncogene in nonsmall cell lung cancer. Oncogene, 2011, 30(18):2181-2186.
[13] Yuen HF, McCrudden CM, Huang YH, et al. TAZ Expression as a Prognostic Indicator in Colorectal Cancer. PLoS One, 2013, 8(1):e54211.
[14] Bhat KP, Salazar KL, Balasubramaniyan V, et al. The transcriptional coactivator TAZ regulates mesenchymal differentiation in malignant glioma. Genes Dev, 2011, 25(24):2594-2609.
( 本文编辑:王永刚 )
Expressions of effective molecules transcriptional coactivator with plasma dissociated zircon-binding motif of Hippo signaling pathway in human osteosarcomas and osteosarcoma stem cells
ZHU Zhong sheng, ZHANG Chun-lin, WANG Yang. Department of Orthopedics, the sixth People’s Hospital, Shanghai Jiaotong University, Shanghai, 200233, PRC
ObjectiveTo detect the expressions of transcriptional coactivator with plasma dissociated zircon ( PDZ )-binding motif ( TAZ ) molecules of Hippo signaling pathway in human osteosarcoma tissues, osteosarcoma MG63 cells and stem cells, to compare the expression differences of TAZ molecules in osteosarcoma cells and osteosarcoma stem cells, and to investigate possible clinical signifcance.Methods12 primary osteosarcoma tissue specimens and 6 recurrent osteosarcoma specimens were selected from the patients with osteosarcomas treated in our hospital from January 2010 to January 2012, with another 6 patients with fbrous dysplasia of bone as the negative control group. Osteosarcoma MG63 cells were cultured by adherent method. Immunohistochemical method was used to detect the expressions of TAZ molecules in osteosarcoma tissues and osteosarcoma MG63 cells. Osteosarcoma MG63 cells were cultured in suspension in serum-free medium to separate and collect osteosarcoma spheroids. The expressions of marker genes of embryonic stem cells ( Nanog and Oct4 ) and TAZ molecules of Hippo signaling pathway were detected in osteosarcoma MG63 cells and osteosarcoma spheroids by quantitative reverse transcriptionpolymerase chain reaction ( RT-PCR ). The expressions of TAZ proteins in MG63 cells and spheroids were detected by western blot.ResultsThe expressions of TAZ molecules were positive in 3 of 12 primary human osteosarcoma tissue specimens, which were also positive in all the recurrent osteosarcoma specimens. The expressions of TAZ molecules were positive in osteosarcoma MG63 cells, and negative expressions of TAZ molecules were found in the control group. Compared with osteosarcoma MG63 cells, RT-PCR analysis showed the expressions were signifcantly higher in marker genes of stem cells ( Nanog and Oct4 ) in cultured osteosarcoma spheroids and TAZ molecules of Hippo signaling pathway. Based on western blot results, the expressions of TAZ proteins in spheroids were significantlyhigher than that in osteosarcoma MG63 cells.ConclusionsThere are TAZ molecules expressed in osteosarcoma tissues, but they are highly expressed in recurrent osteosarcoma tissues. The expressions of TAZ molecules are also found in osteosarcoma cell lines, but they are higher in stem cells. Therefore, it is suggested that TAZ molecules of Hippo signaling pathway may have a certain correlation with the characteristics of osteosarcoma stem cells.
Osteosarcoma; Neoplastic stem cells; Hippo signaling pathway; TATmolecule
10.3969/j.issn.2095-252X.2014.02.012
R738, Q78
200233上海交通大学附属第六人民医院骨科
张春林,Email: shzhangchunlin@gmail.com.
2013-03-06 )
