马铃薯粉痂菌诱饵植物筛选及环境对病害发生的影响
2014-02-10刘霞胡先奇杨艳丽
刘霞,胡先奇,杨艳丽
(云南农业大学植物保护学院/云南省植物病理重点实验室,云南昆明650201)
病虫防治
马铃薯粉痂菌诱饵植物筛选及环境对病害发生的影响
刘霞,胡先奇,杨艳丽*
(云南农业大学植物保护学院/云南省植物病理重点实验室,云南昆明650201)
通过筛选获得土壤中马铃薯粉痂菌的诱饵植物,明确不同地区土样的含菌量以及马铃薯栽培品种对土壤含菌量的影响;同时,研究温度和土壤含水量对马铃薯粉痂病发病情况的影响。采用带菌土壤诱导和带菌薯块诱导两种活体诱导的方法进行马铃薯粉痂菌的诱导;在温室条件下设计不同的处理来研究温度和土壤含水量对马铃薯粉痂病发病的影响。筛选得到诱饵植物为番茄品种‘3-375’,不同地区和种植不同马铃薯品种的土壤中粉痂菌的含量存在差异。温度和土壤含水量对粉痂病发病情况有一定影响。土壤中存在马铃薯粉痂菌,该病原菌可以通过土壤和种薯传播;温度和土壤含水量等环境因素对该病害的发生有影响。
马铃薯粉痂菌;诱饵植物;温度;土壤含水量
马铃薯粉痂病是马铃薯粉痂菌(Spongospora subterranea f.sp.subterranea)引起的真菌性病害,主要危害马铃薯的块茎和根部,有时马铃薯茎也可染病。马铃薯感染粉痂菌后对马铃薯的产量和商品性造成直接影响,特别是对进入超市的鲜食型马铃薯的商品性影响更大[1]。目前,马铃薯粉痂菌不能进行离体培养,主要是进行活体培养和接种,现在主要采用诱饵植物来诱捕马铃薯粉痂菌,最常用的诱饵植物主要是番茄苗,还有报道使用马铃薯苗和藜科植物[2,3]。粉痂病的发生与马铃薯生长季节的温度关系密切,一般马铃薯生长季节持续保持低温的气候,马铃薯粉痂病发生就较为严重;相反,如果生长季节温度偏高,马铃薯粉痂病不发生或者发病很轻[4,5]。Kirkham[6]发现,种植较早并种植在气候相对寒冷的地块中的马铃薯比种植较晚的马铃薯更容易发生粉痂病。Ramsey[7]报道,当马铃薯种植在温度15~16℃的温室时,83%的薯块发生粉痂病,在温度21.1℃或26.7℃时很少或没有病害的发生。De Boer等[8]研究认为,低温对于促进病害的发展特别重要。土壤水分含量高是粉痂病发生严重的主要因素之一,有许多报道证实了这个观点。在薯块生长较快的生长季节的前一阶段,土壤中的水分含量对病害的发生具有相当大的影响,发病薯块的数量和严重度都与土壤水分的含量有必然的联系[9]。Hims[10]和Parker[11]认为,土壤中较高的水分含量促进了游动孢子对薯块的侵染。Wale[12]指出,土壤中水分的短期饱和状态对病原物的发展最有帮助,较高的土壤水分含量能够促进游动孢子的释放,从而促进病原对马铃薯的侵染。
本研究采用3个番茄品种对土壤中的粉痂菌进行诱导,从而确定不同地区土壤中粉痂菌含量的差异,并通过马铃薯试管苗进行诱导,对薯块的发病情况进行调查,由薯块发病的病级来确定土壤的含菌量。同时,在人工气候箱中控制温度和土壤水分,研究环境因素对马铃薯粉痂病发生情况的影响,为云南省开展粉痂病的深入研究和防治示范奠定基础,为通过农业栽培措施来减轻马铃薯粉痂病的发生提供可靠的理论依据,同时对提高云南省马铃薯种薯质量亦具有重要的意义。
1 材料与方法
1.1 试验材料
1.1.1 供试植物
茄科植物:番茄品种‘3-375’,‘L3708’,‘CLN2037E’。
马铃薯:‘滇薯6号(PB06)’试管苗,‘合作88’无菌种薯,2010年马铃薯收获期采自云南会泽不同品种的感病薯块。
1.1.2 供试土壤
灭菌土壤,供试带菌土样分别采自云南昭通、会泽、宣威、寻甸、香格里拉等马铃薯主产区种植不同马铃薯品种的地块,共25个样品(表1)。
1.2 试验方法
1.2.1 活体诱导法
本试验采用带菌土壤诱导和带菌薯块诱导两种诱导方式。
带菌土壤的诱导:根据诱饵植物筛选试验得到的感病诱导番茄品种‘3-375’,以及马铃薯品种‘PB06’,进行带菌土的诱导。采用漂浮培育3~4周的番茄苗和组织培养的马铃薯试管苗,移栽到装好盆的带菌土壤中,在18℃的温室中培养,大约2个月后检查诱导结果。
带菌薯块的诱导:将2010年采集的不同品种的发病薯块种植在灭菌土中进行诱导,收获后检查子代薯块的发病情况。
1.2.2 温度对病害发生情况的影响
4个处理,每个处理3次重复,人工接种后分别放入不同温度的人工气候箱中(人工接种:采集感病马铃薯块茎,用消毒刀削下发病严重薯块的表皮,室内自然条件下晾一夜,然后均匀接种在盆栽中)。处理1:温度控制在22~26℃;处理2:温度控制在15~20℃;处理3:温度控制在10~13℃;处理4:放在室温下(15~20℃)做对照。待自然成熟死亡后收集马铃薯进行比较。
1.2.3 土壤含水量对马铃薯粉痂病发病情况的影响
4个处理,每个处理3次重复,人工接种后放置在温室中,温度为22~26℃。处理1:每隔1 d浇1次水;处理2:每隔3 d浇1次水;处理3:每隔1周浇1次水;处理4:对照,根据天气情况,每隔2~4 d浇1次水。每次浇900 mL水,使土壤水分饱和。待植株自然成熟死亡后收集马铃薯进行比较分析。
1.2.4 病害调查的方法
粉痂病分级标准采用瑞士联邦理工学院(Swiss Federal Institute of Technology)植物科学学院Merz教授提供的在欧洲广泛采用的6级分级标准(图1)。
待马铃薯自然成熟死亡后,收获薯块,计算发病率、病情指数和严重度。
发病率(%)=(发病薯块数/调查总薯数)×100严重度=∑(各级病薯×各级代表值)/调查总薯数

表1 供试带菌土样Table 1Infected soil samples

图1 马铃薯粉痂菌侵染薯块的病级标准Figure 1Standard scoring for tuber infection by S.subterranea f.sp.subterranea
2 结果与分析
2.1 诱导植物的筛选
将番茄品种‘3-375’、‘L3708’、‘CLN2037E’分别种植在采自会泽县大海乡、会泽县金钟镇、寻甸县六哨乡、香格里拉哈木社、昭通市靖安乡的带菌土样中。检查诱导结果发现,在5个带菌土样当中,根部侵染最严重的均为‘3-375’,‘L3708’和‘CLN2037E’的根部侵染均不明显,由此筛选‘3-375’作为马铃薯粉痂菌的诱饵植物(图2)。

图2 诱饵植物筛选Figure 2Screening for bait-plant
2.2 不同地区带菌土样的菌量比较
将番茄品种‘3-375’、‘L3708’、‘CLN2037E’分别种植在采自会泽县火红乡、会泽县大海乡、宣威市东山镇、中甸吓那社、寻甸六哨以及昭通市太平乡的6个地点的土样中。结果表明:‘3-375’在采自6个地点的土样中根部侵染都是最严重的;而3个番茄品种均在采自中甸吓那社的土样中根部侵染严重,说明采自该地的土样中含菌量最高(图3)。

图3 不同地点土样的菌量差异Figure 3Difference in fungus quantity in different soil samples
2.3 不同寄主带菌土样的菌量差异
将诱饵植物‘3-375’分别种植在采自会泽县大海乡的6个土样(前作分别为马铃薯品种‘米拉’、‘会-2’、‘合作88’、‘PB06’、‘PB04’和‘赖皮洋芋’)、会泽金钟镇的3个土样(前作分别种植马铃薯品种‘会-2’、‘合作88’和‘PB04’)和寻甸的3个土样(前作分别种植马铃薯品种‘昆引13’、‘合作88’和‘PB04’)中,结果显示‘3-375’在种植‘合作88’和‘赖皮洋芋’的土样中侵染较重,说明采自会泽的种植‘合作88’和‘赖皮洋芋’的土样中含菌量较高,而种植其他马铃薯品种的含菌量相对较低。从‘3-375’根部的侵染来看,采自寻甸种植不同马铃薯品种的3个土样的菌量差别不明显(图4)。
2.4 不同越冬条件下菌量的比较
这个试验分为两组,一组是2010年8月份马铃薯收获季节从发病较重的地块采集的土壤,带回后直接移栽入番茄苗,越冬后,第二年重新栽入番茄,6~7周后检查根部的侵染情况;另一组是2011年3月份从相同地块采回的在自然条件下越冬的土壤,与第一组同时栽入番茄并检查结果。结果表明,2011年采集的自然越冬的土壤中的菌量偏高,但总体上差异并不显著(图5)。

图4 来自不同寄主土样菌量的差异Figure 4Difference in fungus quantity for different soils where host plants were grow

图5 不同越冬条件下菌量的比较Figure 5Comparison of fungus quantity in different hibernal conditions
2.5 健康根部与被侵染根部的比较
健康的植物根部表面光滑,色泽明亮,而被侵染的根部表皮已腐烂,颜色暗淡(图6)。
2.6 移栽试管苗粉痂病的诱导
将组织培养的马铃薯品种‘PB06’的苗移栽到温室的珍珠沙中,生长一段时间后,扦插,然后将扦插成活的马铃薯苗移栽入2010年采集的带菌土壤中,结薯后检查诱导结果,发现对马铃薯的植株生长影响不大,而薯块明显侵染,进一步证明了土壤中马铃薯粉痂菌的存在(图7)。
2.7 种薯传病和不同马铃薯品种带菌薯块感病情况
将2010年从会泽采集的不同品种的带菌薯块种植在温室中,收获后检查结果。结果表明,带菌种薯对下一代植株地上部的生长影响不明显(图8),但对子代薯块的发病情况进行统计后可以确定该病原菌是能够通过薯块带菌传播的(表2)。
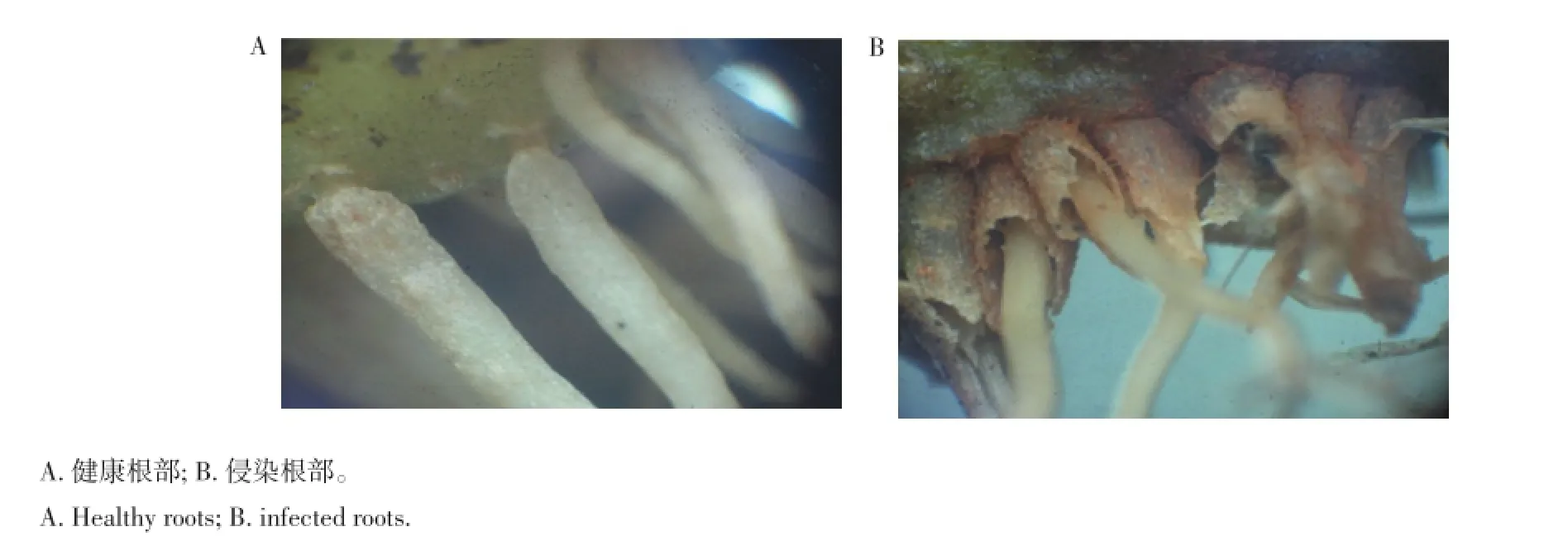
图6 健康与侵染根部的比较Figure 6Comparison between healthy and infected roots

图7 移栽试管苗诱导发生粉痂病Figure 7Occurrence of powdery scab of potato plants derived from plantlets in vitro transplanted in infected soil

图8 带菌种薯对下一代植株和块茎的侵染Figure 8Infection of diseased seed tuber on daughter plant and tuber
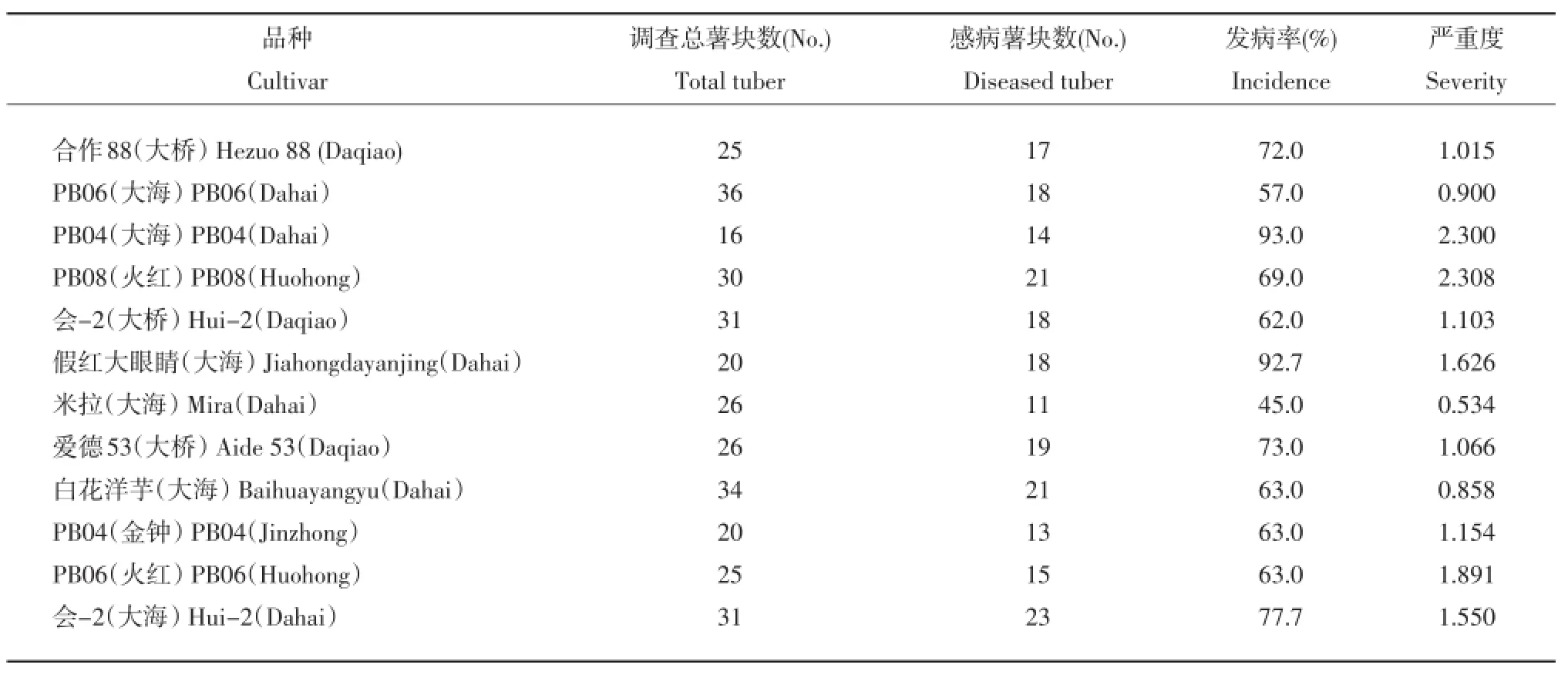
表2 不同品种带菌种薯对后代块茎的侵染Table 2Infection of diseased seed tuber on daughter tuber of different cultivars
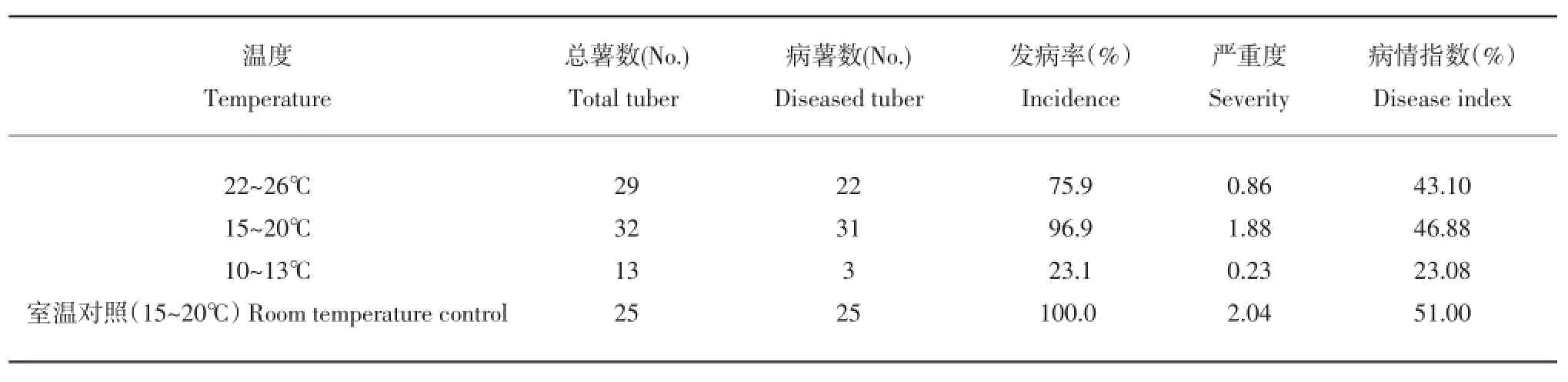
表3 不同温度对粉痂病发病情况的影响Table 3Severity of disease occurrence in different temperatures
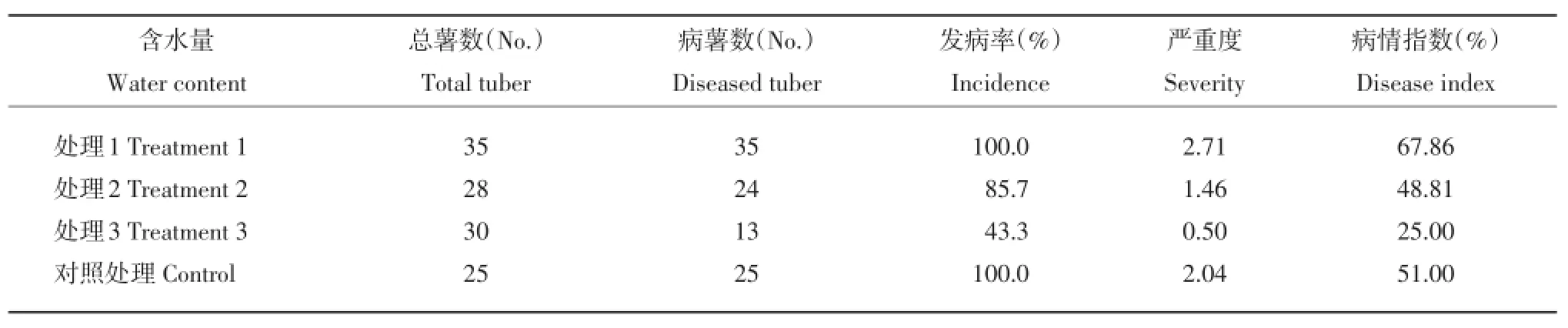
表4 土壤含水量对粉痂病发病情况的影响Table 4Severity of disease occurrence in different soil water contents
2.8 温度对粉痂病发病情况的影响
在其他条件相同的情况下,温度在15~20℃之间时,发病情况相比另外两个温度区的发病情况严重。其发病率为96.9%,严重度为1.88,病情指数为46.88%。发病最严重的室温对照,温度也在15~20℃范围。因此,在单独考虑温度因子对粉痂病的影响时,温度在15~20℃之间是粉痂病的最易发病温度(表3)。
2.9 土壤含水量对粉痂病的影响
在其他条件相同的情况下,粉痂病的发病率、严重度、病情指数都随着浇水频率的减少而逐渐降低。每隔1d浇水1次时,粉痂病的发病率为100%,严重度为2.71,病情指数为67.86%,而每周只浇水1次时,粉痂病的发病率、严重度和病情指数都有大幅下降,分别为43.3%、0.50和25%。所以,在不考虑其他影响因子情况下,土壤中的含水量越是丰富,粉痂病发病情况越严重(表4)。
3 讨论
通过实验筛选出诱饵植物‘3-375’,与国外采用番茄作为诱饵植物一致[13]。‘3-375’诱导土壤中病原菌的试验表明采自不同地点的土样中含菌量不同,种植不同马铃薯品种的土壤中含菌量也存在差异。可见马铃薯粉痂菌在土壤中的存活除受当地气候和环境因素的影响外,还受当地马铃薯栽培品种对粉痂菌抗性的影响。马铃薯试管苗诱导试验进一步证明粉痂菌能在土壤中存活,并通过土壤进行传播。
自然条件下越冬土样的含菌量高于温室中越冬的土样。在自然条件下,土壤周围其它微生物的存在,以及土壤的温湿度等条件更适合病原菌的生存;而温室条件下越冬的土样,不存在周围土壤的微生物,温湿度条件也不一定适合病原菌的生存,最重要的是在冬季栽培过一批诱导植物,可能使土壤中的病原菌发生变化。
本试验确定了种薯传病的可能性和不同品种带菌薯块发病情况的差异。在温室种植的9个带菌马铃薯品种,子代全部发病,证明马铃薯粉痂病可以通过种薯带菌进行传播,但种薯带菌与大田病害发生程度的相关性,还有待于进一步研究。
在单独考虑温度因子对粉痂病的影响时,温度在15~20℃之间时,发病情况相比另外两个温度区的发病情况严重,即说明温度15~20℃之间是粉痂病的最易发病温度。这与Kirkham[6]报道的结果相一致。在其他条件相同的情况下,粉痂病的发病率、严重度、病情指数都随着浇水频率的减少而逐渐降低,表明土壤中的含水量越是丰富,粉痂病发病情况越严重。
[1]Wallace A,Williams N A,Lowe R,et al.Detection of Spongospora subterranea using monoclonal antibodies in ELISA[J].Plant Pathology,1995,44(2):355-358.
[2]张中义,冷怀琼,张志铭,等.植物病原真菌学[M].成都:四川科学技术出版社,1988.
[3]Van de Graaf P,Lees A K,Cullen D W,et al.Detection and quantification of Spongospora subterranea in soil,water and plant tissue samples using real-time PCR[J].European Journal of Plant Pathology,2003,109:589-591.
[4]Claxton J R.Arnold D L,Blakesley D,et al.The effects of temperature on zoospores of the crook root fungus Spongospora subterranea f.sp.nasturtii[J].Plant Pathology,1995,44(5): 765-771.
[5]Christ B J.Effect of planting date and inoculum level on incidence and severity of powdery scab on potato[J].Potato Research,1989, 32:419-424.
[6]Kirkham R P.Screening for resistance to powdery scab disease of potatoes[J].Australian Journal of Experimental Agriculture,1986, 26:245-247.
[7]Ramsey G B.Influence of moisture and temperature upon infection by Spongospora subterranea[J].Phytopathology,1918,8:29-31.
[8]De Boer R F,Taylor P A,Flrtt S P,et al.Effects of soil temperature,moisture,and timing of irrigation on powdery scab of potatoes[C]//Parker C A,Rovira A D,Moore K J,et al. ProceedingsoftheFourthInternationalCongressofPlant Pathology.Melbourne,Australia:RowprintServices,1985: 197-198.
[9]Harrison J G,Searle R J,Williams N A.Powdery scab disease of potato—a review[J].Plant Pathology,1997,46:1-25.
[10]Hims M.The weather relationship of powdery scab disease of potatoes[J].Annals of Applied Biology,1976,84:274-275.
[11]Parker A.Cultural control of powdery scab of potatoes[C]// ProceedingsoftheCropProtectioninNorthernBritain Conference.Dundee UK:The Association for Crop Protection in Northern Britain,1984,132-137.
[12]Wale S J.Powdery scab-are there any easy solutions?[J].Potato World,1987,4(4):8-9.
[13]Merz U.Infectivity,inoculum density and germination of Spongospora subterranea resting spores:a solution-culture test system[J].Bulletin OEPP,1989,19:585-592.
Screening for Bait-plant of Spongospora subterranea and Impact of
Environments on Potato Powdery Scab Disease Occurrence
LIU Xia,HU Xianqi,YANG Yanli*
(College of Plant Protection,Yunnan Agricultural University/Key Laboratory of Plant Pathology
of Yunnan,Kunming,Yunnan 650201,China)
The aim was to screen bait-plants of Spongospora subterranea in soil,understand the pathogen content in different areas and the effect of potato cultivars on soil pathogen content.At the same time,the influence of temperature and soil water content was studied on the occurrence of powdery scab.Two methods,contaminated soil and infected tuber,were used for screening bait-plant of Spongospora subterranean.Different treatments under greenhouse were designed to study the impact of temperature and soil water content on the incidence of powdery scab.Tomato variety'3-375'was identified as bait-plant,and the content of pathogen was found to be different in different regions and cultivars.Temperature and soil water contenthadacertaininfluenceontheincidenceofpowderyscab.Spongosporasubterraneawasfoundinsoil,whichcanspread throughthesoilanddiseasedseedtuber.Temperatureandsoilwatercontentcanaffecttheoccurrenceofthedisease.
Spongospora subterranea;bait-plant;temperature;soil water content
S532
A
1672-3635(2014)01-0035-08
2013-12-06
云南省自然科学基金(2004C0036M),云南省现代农业马铃薯产业技术体系[2009(53)],国家自然科学基金青年基金项目(31201255)。
刘霞(1980-),女,讲师,博士,从事马铃薯病害研究。
杨艳丽,教授,从事马铃薯病害及抗病品种选育研究,E-mail:zqccn@aliyun.com。
