畜禽养殖排放的雌激素对周边水体环境的影响
2014-02-08陈蕾王郑曹世玮
陈蕾,王郑,曹世玮
畜禽养殖排放的雌激素对周边水体环境的影响
陈蕾,王郑,曹世玮
南京林业大学土木工程学院, 江苏 南京 210037
环境雌激素是一大类化学物质,它们能够干扰生物体内激素的合成、分泌、转运、活性等,或与生物体内激素结构相似而发挥激素作用,对生物体的生长、繁殖及行为产生不利影响。环境雌激素包括天然雌激素及人工合成类雌激素。随着国内畜禽养殖的规模与数量的不断扩大,养殖场成为了一个很大的环境雌激素的产生源,其环境风险应得到相应的重视。目前对畜禽养殖过程中环境雌激素的产生量以及雌激素进入环境后的迁移转化行为已有很多的研究,包括野外的调查与实验室内机理研究。畜禽养殖过程产生的大量雌激素进入环境后能够被土壤吸附及微生物降解。室内的静态平衡吸附实验、土柱迁移试验及降解研究均表明雌激素进入环境后绝大部分迅速被吸附到土壤颗粒或悬浮胶体、沉积物颗粒上,同时发生转化与生物降解,由此推断其对周边环境中的雌激素贡献很小。然而,野外调查结果却表明实际情况下雌激素的迁移性高于理论期望值。因此,畜禽养殖对周边环境中雌激素的贡献量的大小尚未明确。本论文综述了畜禽养殖过程中环境雌激素的排放情况,结合国内外的调查研究,阐述了畜禽养殖产生的环境雌激素在土壤及水体中的迁移与降解行为,探讨了影响准确评估畜禽养殖排泄物对周边水体中雌激素贡献大小的因子,并提出了今后应开展原位吸附与迁移的实验,重点考虑天然有机质及抗生素等共存物质对雌激素环境行为的影响,建立综合模型来估算不同时期养殖场对周围水环境雌激素的贡献量的建议。
雌激素;畜禽排泄物;吸附;迁移;生物降解
近年来不断有调查发现大量的水生生物出现性别畸化,如雌性贝类长出了雄性器官,雄性红鳟鱼体内有雌鱼才具有的卵黄蛋白,全世界已有多个地区发现“双性鱼”,即雄性鱼产卵等。目前研究者公认这种内分泌紊乱的现象是由环境中的雌激素引起的。环境雌激素是一类化学物质,能够干扰生物体内激素的合成、分泌、转运、活性等,或与生物体内激素结构相似而发挥激素作用,对生物体的生长、繁殖及行为产生不利影响(Kavlock等,1996;王宏伟等,2013)。毒理学试验已证实这些化学物质即使在浓度很低的情况下,如10~100 ng·L-1,亦能导致各种生物体的性激素分泌量下降、活性减弱、精子数量减少、生殖器官异常、癌症等发病率增加, 并影响到各种生物体的性行为、生殖功能、免疫系统和神经系统等(Vajda等,2008;孙小红等,2013)。环境雌激素可能会使生物雌雄比例失调,最终导致该物种的消失。因此,环境雌激素的来源、在环境中的迁移与转化过程及对生态系统的影响是当前的研究热点之一。
雌激素包括天然雌激素及人工合成类雌激素。常见的天然雌激素有雌酮(E1)、17β-雌二醇(E2,通常也称雌二醇)、17α-雌二醇(17α)、雌三醇(E3),人工合成的雌激素如乙炔基雌二醇(EE2)、己烯雌酚(DES)、玉米赤霉烯醇(ZEA)等,人工合成的雌激素多用于口服避孕药主成分或促进家畜生长繁殖的同化激素。天然雌激素对生物内分泌系统干扰效应强于人工合成雌激素,而人类与动物的排泄物中含有大量的天然雌激素。由于天然雌激素在环境中的检出几率较高(Huang等,2009),而且生物活性远远高于人工合成雌激素,尤其是雌二醇,当水中浓度大于1 ng·L-1时便会引起雄性鲑鱼体内产生卵黄蛋白(Hansen等,1998)。因此,雌二醇等天然雌激素的环境行为与生态毒性已备受关注。
城市污水处理厂出水及污泥的排放一度被认为是环境中雌激素的主要来源。英格兰的Jobling等(Jobling等,1998)最早发现城市污水处理厂出水及污泥中含有很高浓度的天然雌激素,同时观测到出水口附近蟑螂的性别畸化率明显较高,之后污水处理厂的雌激素排放成为关注焦点(张海珍和陆光华,2013)。目前针对污水处理厂各流程中雌激素的存在状态及处理工艺对雌激素的去除等方面已有很多的研究(Sim等,2011;Tang等,2013;聂亚峰等,2011;王昌稳等,2013)。然而研究者发现,尽管英格兰与威尔士环保局对部分污水处理厂出水中雌激素含量进行了严格控制,其周边水体中的鱼受内分泌干扰物的影响并没有因此减弱故猜测附近养殖场排泄物的排放可能是环境中的雌激素的另一重要来源(Gross-Sorokin等,2004)。目前针对畜禽养殖过程中雌激素的产生量及其在土壤环境中的迁移转化过程已有大量的研究(李艳霞等,2010),然而这些研究结论存在许多分歧,养殖场排泄物对周边水体雌激素的贡献究竟如何依然存在着较大的争议。
本文将综述国内外相关研究结果,从养殖场雌激素的产生及雌激素的环境迁移与降解的角度,探讨养殖场排泄物来源的雌激素对周边水体环境的影响。
1 畜禽排泄物中天然雌激素的种类与数量
畜禽养殖场所有的养殖动物不论性别或生长阶段都会排放一定量的雌激素,排泄物中雌激素的种类和浓度分布与所养殖动物的种类、生长阶段密切相关。例如牛的排泄物中主要是17α-雌二醇,17β-雌二醇和雌酮;而猪与禽类的排泄物中主要是17β-雌二醇,雌酮和雌三醇,17α-雌二醇则很少(Bevacqua等,2011;Salierno等,2012)。
目前很多研究者对养殖场畜禽排泄物中的雌激素的种类和浓度分布进行了调查,综合众多的调查结果,列出母牛、猪及禽类排泄物中雌激素的含量(表1),从表中可以看出畜禽在生长过程中产生大量的雌激素,且在孕期阶段产生的雌激素量大于其他的生长阶段。
由此可见养殖场排放雌激素的量是较大的,甚至有研究者提出畜禽养殖排放的雌激素达到了环境中总雌激素的90%(Maier等,2000)。但是目前的研究并没有充分的证据说明养殖场的排泄物与周围水环境中水生生物的内分泌干扰效应存在直接的联系,而对雌激素进入环境后的迁移、转化和归宿等环境行为的正确认识则是阐明养殖场对周围水环境中雌激素的贡献量的前提。
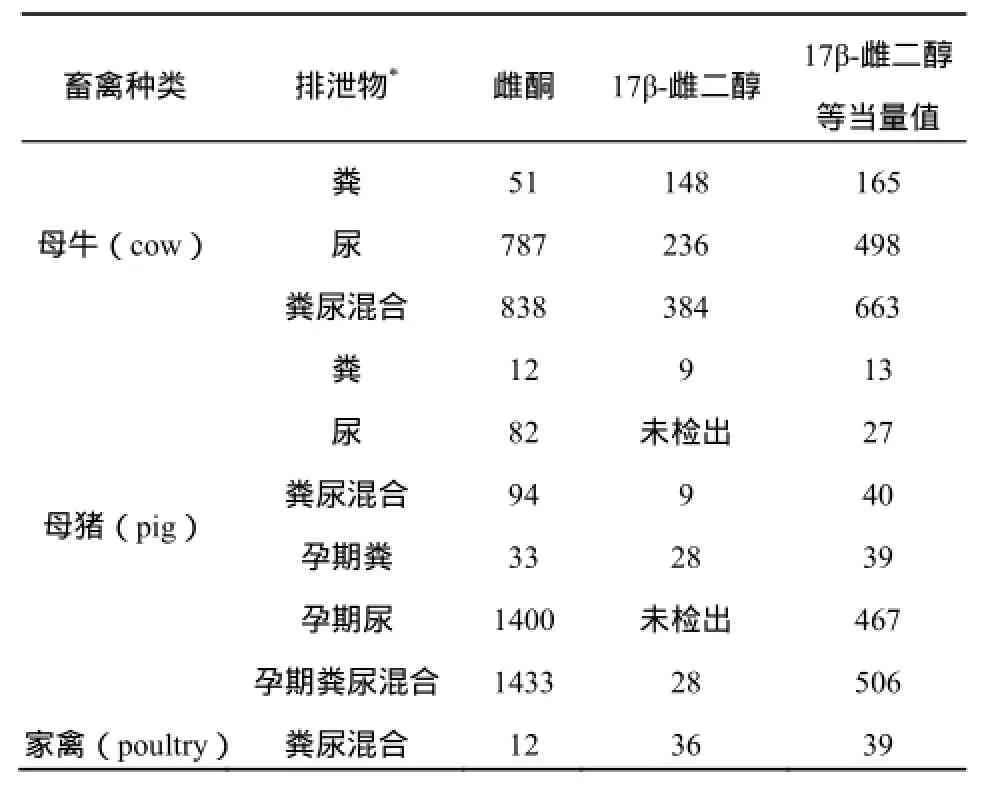
表1 畜禽养殖排泄物中雌激素含量Table 1 Quantity of Estrogen Excreted by Various Livestock and Poultry μg·d-1
2 天然雌激素的迁移性与在土壤中的降解
2.1 天然雌激素的分子结构与理化性质
常见的天然雌激素均为四环分子结构,并且以芳香环为其明显特征。表2给出了天然雌激素与常见的几种有机污染物的理化性质。与多氯联苯、多环芳烃等有机污染物相比,可以认为雌激素的水溶性相对较高(Sw= 0.8~0.13 mg·L-1),疏水性一般(logKOW=2.6~4.0),挥发性较低(Vap= 9×10-13~3×10-8Pa),因而其在沉积相、溶解相及土壤颗粒上的吸附作用与降解将是其环境行为的重要表现,决定了雌激素在环境中的迁移性与持久性。
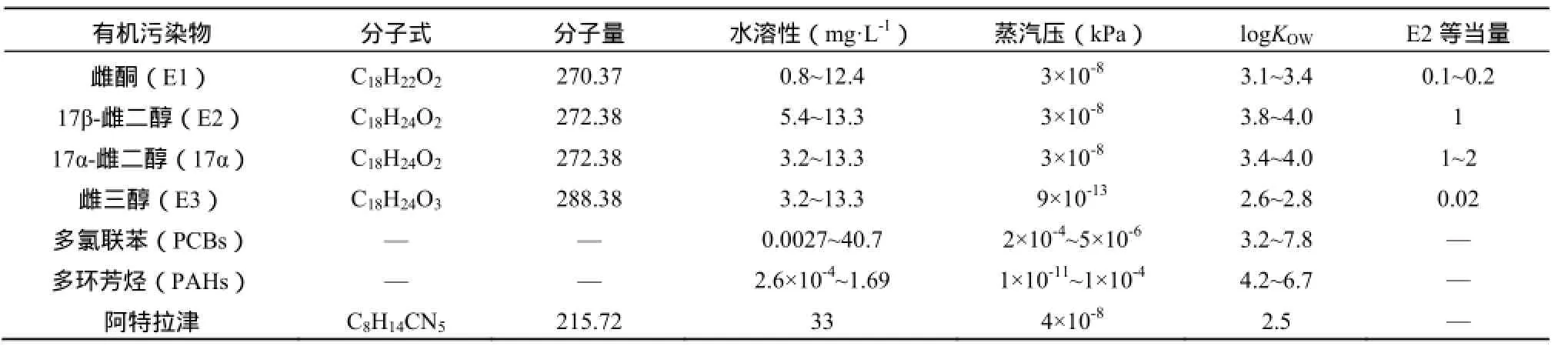
表2 天然雌激素与常见有机污染物的理化性质Table 2 Physicochemical Properties of Natural Estrogens and Some Typical Organic Pollutants
2.2 天然雌激素在土壤及沉积物中的迁移性
天然雌激素不易挥发,疏水性一般,水溶性较弱,因而极易被沉积物、悬浮物及土壤颗粒吸附。大量的实验室内静态平衡吸附试验与土柱迁移试验结果表明,天然雌激素进入环境后能快速吸附在土壤颗粒上,不易被淋溶,迁移性很弱。然而,野外的相关调查研究结果却表明天然雌激素在土壤及沉积物中存在显著的迁移性。
2.2.1 土壤及沉积物对雌激素的吸附
与其他有机化合物相似,雌激素也能被土壤颗粒吸附(杨明等,2012)。Casey等(Casey等,2003)通过静态吸附实验研究了不同土壤颗粒对雌二醇的吸附行为,并采用Freundlich吸附等温方程模拟吸附过程,发现土壤颗粒对14C标记的雌二醇的吸附系数普遍较高,为 86~6670 L·kg-1,且吸附系数与土壤有机质含量、颗粒比表面积、粘土矿物含量均呈显著正相关。这意味着雌二醇与土壤的吸附过程可能同时存在着非极性物质与土壤颗粒、离子或极性物质与土壤颗粒的吸附机制。研究者对不同土壤模拟出的Freundlich方程指数n均大于1,说明在研究的浓度范围内(≤0.1 mg·L-1),土壤颗粒对雌二醇的吸附尚未达到饱和,这也说明在此吸附过程中不存在雌激素对交换位点的竞争吸附(Casey等,2003)。对α-雌二醇与β-雌二醇在土壤中的吸附动力学的研究表明,β-雌二醇的吸附系数显著高于α-雌二醇(Mashtare等,2011)。Lee等(Lee等,2003)的研究也指出土壤颗粒对雌激素有着很强的吸附作用,其中土壤有机质是影响雌激素在土壤颗粒上吸附的主要因素。
河流沉积物对雌激素也存在较强的吸附作用。雌二醇在河流沉积物中的吸附系数为4~74 L·kg-1,在河水中悬浮物颗粒上的吸附系数为21~122 L·kg-1(Holthaus等,2002),且沉积物中有机碳的含量对雌激素的吸附有着重要的影响(Lai等,2000)。Bowman等(Bowman等,2002)则深入研究了河流沉积物对雌酮和雌二醇的吸附过程,发现与土壤颗粒吸附相比,沉积物对雌酮和雌二醇的吸附较慢,达到吸附平衡所需的时间分别为70 h和170 h。河水的盐度对雌激素在沉积物中的吸附产生一定的影响,如Bowman等(Bowman等,2002)的研究发现盐度对雌二醇的吸附没有显著影响,却能显著促进雌酮的吸附。其中对于极性较弱的雌酮,可以用非极性有机物的“盐析”效应来解释盐度对其吸附的促进作用。而Noppe等(Noppe等,2007)通过两年的野外调查发现河水的盐度越高,雌激素越容易吸附于沉积物中,原因是河水盐度的增加会降低雌激素在水中的溶解度。沉积物颗粒粒径也是影响雌激素吸附过程的因素之一,如雌酮和雌二醇都更倾向于吸附在较大颗粒(0.15~1 mm)上,这与一般有机物吸附系数与比表面积呈正相关的规律不符,说明比表面积在沉积物对这两种雌激素的吸附过程中并不是主导因素(Bowman等,2002)。另外增加沉积物的量反而会降低雌激素的分配系数,原因可能是随着沉积物量的增加,溶解相中的胶体的含量也随之增加,而可溶性胶体对雌激素的分配系数比沉积物大两个数量级,因此沉积物中的可溶性胶体能很大程度地增加雌激素在溶解相中的浓度(Bowman等,2002)。Casey等(Casey等,2003)在土壤吸附雌激素的研究中也发现了可溶性胶体对吸附的影响,吸附平衡后通过离心发现溶解相中雌激素的含量降低了20%,疑是可溶性胶体的缘故。此外,土壤中的阴离子表面活性剂也能促进雌激素的脱附(王联芝等,2008)。因此第三相——可溶性胶体相对雌激素存在形态、迁移性以及生态毒性的影响不可忽视。
沉积物作为多种污染物的库,背景污染物浓度往往较高,特别是农药、多环芳烃等。环境背景浓度较高的萘和菲将显著减弱雌激素在沉积物上的吸附能力,而且与沉积物“软碳”(即松散的土壤有机质)和“硬碳”(即致密的土壤有机质)的含量有关,但是竞争吸附的机制仍有待进一步研究(Yu和Huang,2005)。由于雌激素与多环芳烃化合物有共同的菲环,结构越相似的有机污染物竞争吸附现象就越明显。因此,研究雌激素在沉积物上的吸附和建立相关模型时,不能忽视共存有机污染物的竞争吸附带来的影响。
2.2.2 雌激素的迁移
畜禽养殖产生的雌激素进入土壤环境后,一方面极易吸附在土壤颗粒中,另一方面也会随着农田的灌溉、地表径流和下渗等进行迁移,进入地表或地下水体,对水生态造成危害。
研究者采用14C标记的雌二醇进行了土柱迁移试验,绘制了穿透曲线,测定了柱内残留雌二醇及其代谢产物随深度的分布情况,并将静态平衡吸附实验模拟出的参数运用于HYDRUS-1D迁移模型,得到了良好的模拟效果(Casey等,2004;Mashtare等,2011)。通过脉冲进样进行土柱迁移试验并建立模型可以更好地模拟环境真实情况(Das等,2004)。目前已有的雌激素土柱迁移研究并不多,其机理尚需深入研究;但是已有的研究都表明,雌激素在土壤中极不易淋溶迁移,绝大部分被截留于表层土壤中。然而,在后续的土柱迁移试验中,研究者发现溶解性胶体等因素能够促进雌激素的迁移(Casey等,2007;Laegdsmand等,2009)。
通过调查养殖场周围水环境中雌激素的污染情况,可以阐明水体中所检测出的雌激素与养殖场的联系。如有研究发现农场附近的主、支河流流域以及地下蓄水层中均出现了较高浓度的雌激素的污染(Arnon等,2008;Chen等,2010;Dutta等,2012)。这些雌激素可能是通过渗滤作用或地表径流进行迁移。Arnon等(Arnon等,2008)在某奶牛场氧化塘地下32 m处检测出了雌激素的存在,说明雌激素能够从底泥表层向深层迁移。也有研究发现禽类养殖场附近的地表径流中含有高浓度的天然雌激素,其含量与径流中的溶解性有机碳含量密切相关(Dutta等,2012a,2012b)。此外,家禽排泄物中的有机碳可加速其中含有的雌激素的迁移(Bera等,2011),如尿液的存在也会加速土壤中雌激素的迁移,因为尿液中存在一定的可溶性有机质(Sophie和David,2009)。由此可见,养殖场排放出的雌激素存在一定的迁移性和持久性,并威胁着周围水体的生态安全。
2.3 雌激素在土壤中的降解
雌激素含有酚羟基,因此可能会像酚类物质一样进行非生物转化(Hanselman等,2003)。研究发现雌二醇在灭过菌的土壤中也能转化成雌酮(Colucci等,2001),说明在土壤氧化物(如二氧化锰)的存在下能发生无机的氧化。但是,雌酮没有进一步矿化,说明化学反应不能将雌激素进行矿化;而微生物在雌激素的环境矿化过程中起着重要作用(Hakk和Sikora,2011;张方方等,2012)。
目前推测微生物存在下雌二醇先被氧化为雌酮,然后开环形成羧酸化合物,进入三羧酸循环而最终得以矿化(Khanal等,2006;何芳等,2008)。雌二醇在土壤中可以迅速转化为雌酮,60 h后土壤中检测不到雌二醇,然而雌酮在三个月后仍能被检测到(Colucci等,2001)。温度和湿度的增加都能有效促进矿化过程,而土壤的pH、有机质含量等对其影响并不大。当土壤温度从4 ℃上升到37 ℃时,雌二醇61 d后的矿化度从4%提高到15%。土壤湿度从干土增加到15%时,73 d后的矿化度从小于1%提高到20%;然而当湿度继续增加到土壤实际湿度(24%)时,矿化度反而下降至8%(Colucci等,2001)。土壤施加粪肥可以提高雌激素的降解率,如E1与17β-E2在农田土壤中的半衰期为5~25 d,而在牛粪改良土壤与羊粪改良土壤中的半衰期则为1~9 d,其主要归功于粪肥中大量的微生物(Hanselman等,2003)。将牛粪施予农田,发现其中的雌二醇能迅速吸附在土壤颗粒上,90 d后达到最大程度的矿化(Caron等,2012)。此外,腐殖质的存在也会促进雌激素的生物降解,可能是腐殖质对雌激素的富集作用提高了生物的有效性(Lee等,2011)。Fan等(Fan等,2007)研究了有氧与无氧条件下雌二醇的降解情况,发现有氧和无氧条件下雌二醇的矿化率分别为6%和0.9%。由此可以推测,土壤深层及沉积物中的雌激素很难降解,并有累积的趋势,但是目前尚没有对土壤不同深度雌激素降解情况的研究。尽管雌二醇在土壤中能很快地转变为雌酮,但并不意味着生态风险的降低,因为雌酮仍具有雌二醇三分之一的生物活性,且具有生物累积性。
抗生素的存在则会显著降低雌激素的生物降解效率,可能因为是抗生素削弱了微生物的活力,也可能是抗生素竞争碳源所导致(Khanal等,2006;Chun等,2005)。而目前各类抗生素广泛运用于畜禽养殖,因而大量抗生素的存在对畜禽排泄物中雌激素降解会产生一定的削弱作用。
3 畜禽养殖对水体雌激素贡献量的研究展望
随着国内畜禽养殖的规模与数量的不断扩大,养殖场逐渐成为一个大型的雌激素产生源,其存在的可能环境风险应得到相应的重视。畜禽养殖过程产生的大量雌激素,一方面进入环境后能够被土壤吸附及微生物降解,另一方面在土壤中也存在一定的迁移性。由于室内的静态平衡吸附实验、土柱迁移试验及降解研究均表明雌激素进入环境后绝大部分迅速被吸附到土壤颗粒或悬浮胶体、沉积物颗粒上,同时发生转化与生物降解。因此,研究者推断其对周边环境中的雌激素贡献很小。然而,野外调查结果却表明实际情况下雌激素的迁移性高于理论期望值。综上,畜禽养殖对周边环境中雌激素的贡献量的大小一直存在争议。
尽管目前实验室的研究结果还不足以解释养殖场周围水环境中持续检测到雌激素这种现象,但养殖场带来的影响是不容忽视的,寻找养殖场排出的雌激素进入水体的真实途径是非常必要的。从实验室理想状态的研究得出的结论未考虑到实际中的诸多因素,如灌溉、地表径流、可溶性胶体的存在、抗生素的抑制降解作用、解吸动力学及老化现象等,对迁移过程产生的影响。因此,结合野外调查进行原位吸附与迁移的实验,全面分析影响雌激素环境行为的因素,并根据养殖动物不同阶段排放雌激素的规律,建立综合模型估算养殖场对周围水环境雌激素的贡献量,将是今后研究的重要方向之一。
由于目前人工合成雌激素被广泛用于养殖促长剂,人工合成雌激素如己烯雌酚具有天然雌激素的活性,而且亲脂性强,在环境中有一定的持久性,不易降解。因此,这些人工合成的雌激素的环境行为及生态风险也应受到关注。
综上所述,随着国内养殖业的快速发展,尤其是南方河网密集的地区,养殖场排泄物对周围水环境带来的不利影响不容忽视,其中养殖场排放的雌激素的环境行为及其对周边水环境的影响是目前亟需阐明的问题。
ARNON S, DAHAN O, ELHANANY S, et al. 2008. Transport of Testosterone and Estrogen from Dairy-Farm Waste Lagoons to Groundwater [J]. Environmental Science and Technology, 42 (15): 5521-5526.
BERA M, RADCLIFFE D E, CABRERA M L, et al. 2011. 17 Beta-Estradiol and Testosterone Sorption in Soil with and without Poultry Litter [J]. Journal of Environmental Quality, 40: 1983-1990.
BEVACQUA C, RICE C P, TORRENTS A, et al. 2011. Steroid Hormones in Biosolids and Poultry Litter: A Comparison of Potential Environmental Inputs [J]. Science of the Total Environment, 409: 2120-2126.
BOWMAN J C, ZHOU J L, READMAN J W. 2002. Sediment–Water Interactions of Natural Oestrogens under Estuarine Conditions [J]. Marine Chemistry, 77: 263-276.
BRAGA O, SMYTHE G A, SCHAFERAI, et al. 2005. Steroid Estrogens in Ocean Sediments [J]. Chemosphere, 61: 827-833.
CARON E, FARENHORST A, HAO, X Y, et al. 2012. Solid Beef Cattle Manure Application Impacts on Soil Properties and 17β-Estradiol Fate in a Clay Loam Soil [J]. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes, 47: 495-504.
CASEY F X M, HAKK H, SIMUNEK J, et al. 2004. Fate and Transport of Testosterone in Agricultural Soils [J]. Environmental Science and Technology, 38: 790-798.
CASEY F X M, LARSEN G L, HAKK H, et al. 2003. Fate and Transport of 17β-Estradiol in Soil-Water Systems [J]. Environmental Science and Technology, 37: 2400-2409.
CASEY F X M, OCLUOR P G, HAKK H, et al. 2008. Transport of 17beta-Estradiol and Testosterone in A Field Lysimeter [J]. Soil Science, 173: 456-467.
CHEN T, CHEN T, YEH K C, et al. 2010. High Estrogen Concentrations in Receiving River Discharge from A Concentrated Livestock Feedlot [J]. Science of the Total Environment, 408: 3223-3230.
CHUN S, LEE J, GEYER R, et al. 2005. Effect of Agricultural Antibiotics on the Persistence and Transformation of 17 beta-Estradiol in a Sequatchie Loam [J]. Journal of Environmental Science and Health Part B, 40: 741-751.
COLUCCI M S, BORK H, TOPP E. 2001. Persistence of Estrogenic Hormones in Agricultural Soils: I 17beta-Estradiol and Estrone [J]. Journal of Environmental Quality, 30: 2070-2076.
DAS B S, LEE L S, RAO P S C, et al. 2004. Sorption and Degradation of Steroid Hormones in Soils During Transport: Column Studies and Model Evaluation [J]. Environmental Science and Technology, 38: 1460-1470.
DUTTA S, INAMDAR S, TSO J, et al. 2012a. Dissolved Organic Carbon and Estrogen Transport in Surface Runoff From Agricultural Land Receiving Poultry Litter [J]. Journal of the American Water Resources Association, 48: 558-569.
DUTTA S, INAMDAR S, TSO J, et al. 2012b. Concentrations of Free and Conjugated Estrogens at Different Landscape Positions in an Agricultural Watershed Receiving Poultry Litter [J]. Water Air and Soil Pollution, 223: 2821-2836.
FAN Z S, CASEY F X M, HAKK H, et al. 2007. Persistence and Fate of 17beta-Estradiol and Testosterone in Agricultural Soils [J]. Chemosphere, 67: 886-895.
GROSS-SOROKIN M Y, ROAST S D, BRIGHTY G C. 2004. Causes and Consequences of Feminisation of Male Fish in English Rivers [M]. Bristol: Environment Agency of England and Wales: 41-50.
HAKK H, SIKORA L. 2011. Dissipation of 17 Beta-Estradiol in Composted Poultry Litter [J]. Journal of Environmental Quality, 40: 1560-1566.
HANSELMAN T A, GRAETZ D A, WILKIE A C. 2003. Manure Borne Estrogens as Potential Environmental Contaminants: a Review [J]. Environmental Science and Technology, 37: 5471-5478.
HANSEN P, DIZER H, HOCK B, et al. 1998. Vitellogenin-a Biomarker for Endocrine Disruptors [J]. Trends in Analytical Chemistry, 17: 448-451.
HOLBROOK R D, LOVE N G, NOVAK J T. 2004. Sorption of 17β-Estradiol and17α-Ethinylestradiol by Colloidal Organic Carbon Derived from Biological Wastewater Treatment Systems [J]. Environmental Science and Technology, 12(38): 3322-3329.
HOLTHAUS K I E, JOHNSON A C, JURGENS M D, et al. 2002. The Potential for Estradiol and Ethinyl-Estradiol to Sorb to Suspended and Bed Sediments in Some Englishrivers [J]. Environmental Toxicology and Chemistry, 21: 2526-2535.
HUANG Y, NIYOGI D, NAM P, et al. 2009. Livestock Hormones in Aquatic Ecosystems [J]. Veterinary Pharmaceuticals in the Environment, 1018: 135-152.
JOBLING S, NOLAN M, TYLER C R, et al. 1998. Widespread Sexual Disruption in Wild Fish [J]. Environmental Science and Technology, 32: 2498-2506.
JOHNSON A C, WILLIAMS R J, MATTHIESSEN P. 2006. The Potential Steroid Hormone Contribution of Farm Animals to Freshwaters, the United Kingdom as a Case Study [J]. Science of the Total Environment, 362: 166-178.
KAVLOCK R J , DASTON G P , DEROSA C , et al. 1996. Research Needs for Risk Assessment of Health and Environmental Effects of Endocrine Disrupters: a Report of the U. S. Epa - Sponsored Workshop [J]. Environmental Health Perspectives, 104: 715-740.
KHANAL S K, XIE B, THOMPSON M L, et al. 2006. Fate, Transport, and Biodegradation of Natural Estrogens in the Environment and Engineered Systems [J]. Environmental Science and Technology, 21 (40): 6537-6546.
LAEGDSMAND M, ANDERSEN H, JACOBSEN O H T, et al. 2009. Transport and Fate of Estrogenic Hormones in Slurry-treated Soil Monoliths [J]. Journal of Environmental Quality, 38: 955-964.
LAI K M, JOHNSON K L, SCRIMSHAW M D, et al. 2000. Binding of Waterborne Steroid Estrogens to Solid Phases in River and Estuarine Systems [J]. Environmental Science and Technology, 34: 3890-3894.
LEE J H, ZHOU J L, KIM S D. 2011. Efects of biodegradation and sorption by humic acid on the estrogenicity of 17β-estradiol [J]. Chemosphere, 85(8): 1383-1389.
LEE L S, STROCK T J, SARMAH A K, et al. 2003. Sorption and Dissipation of Testosterone, and Estrogens, and Their Primar Transformation Products in Soils and Sediments [J]. Environmental Science and Technology, 37: 4098-4105.
MAIER R M, PEPPER I L, GERBA C P. 2000. Terrestrial Environment in Environmental Microbiology [M]. New York: Academic Press: 61-80.
MASHTARE M L, KHAN B, LEE L S. 2011. Evaluating stereoselective sorption by soils of 17 α-estradiol and 17 β-estradiol [J]. Chemosphere, 82: 847-852.
NOPPE H, VERSLYCKE T, WULF E D, et al. 2007. Occurrence of Estrogens in the Scheldt Estuary: A 2-year Survey [J]. Ecotoxicology and Environmental Safety, 66: 1-8.
SALIERNO J D, POLLACK S J, VAN VELD P A, et al. 2012. Steroid Hormones and Anthropogenic Contaminants in Poultry Litter Leachate [J]. Water Air and Soil Pollution, 223: 2181-2187.
SIM W, LEE J, SHIN S, et al. 2011. Assessment of Fates of Estrogens in Wastewater and Sludge From Various Types of Wastewater Treatment Plants [J]. Chemosphere, 82: 1448-1453.
SOPHIE D L, DAVID L J. 2009. Urine enhances the leaching and persistence of estrogens in soils [J]. Soil Biology and Biochemistry, 41: 236-242.
TANG X, NAVEED U, HASHMI M Z, et al. 2013. A Preliminary Study on the Occurrence and Dissipation of Estrogen in Livestock Wastewater [J]. Bulletin of Environmental Contamination and Toxicology, 90: 391-396.
VAJDA A M, BARBER L B, GRAY J L, et al. 2008. Reproductive Disruption in Fish Downstream from an Estrogenic Wastewater Effluent [J]. Environmental Science and Technology, 42 (9): 3407-3414.
YU Z Q, HUANG W L. 2005. Competitive Sorption between EE2 and Naphthalene/Phenanthrene by Sediments [J]. Environmental Science and Technology, 39: 4878-4885.
何芳, 李富生, Akira Yuasa. 2008. 湖波底泥中17β-雌二醇的生物代谢机制研究[J]. 环境科学, 29(7): 1961-1966.
金相灿. 1990. 有机化合物污染化学——有毒有机物污染化学[M]. 北京:清华出版社: 36-40.
李艳霞, 韩伟, 林春野, 等. 2010. 畜禽养殖过程中雌激素的排放及其环境行为[J]. 生态学报, 30(4): 1058-1065.
聂亚峰, 强志民, 张鹤清, 等. 2011. 内分泌干扰物在城市污水处理厂中的行为和归趋:综述[J]. 环境科学学报, 31(7): 1352-1362.
孙小红, 李婕, 葛安靖. 2013. 环境雌激素的生殖和发育毒性研究进展[J]. 中国优生与遗传杂志, 4: 1-2.
王昌稳, 李军, 赵白航, 等. 2013. A2O工艺中雌激素的行为变化和去除机理[J].环境工程学报, 7(9): 3351-3356.
王宏伟, 赖照, 张洁, 等. 2013. 水体沉积物中环境雌激素对底栖动物的影响[J]. 河北大学学报: 自然科学版, 33(4): 443-448.
王联芝, 章飞芳, 薛兴亚, 等. 2008. 土壤中阴离子表面活性剂对17β-雌二醇吸附脱附的影响[J]. 精细化工, 25(7): 691-695.
杨明, 李艳霞, 冯成洪, 等. 2012. 类固醇激素的环境行为及其影响因素[J]. 农业环境科学学报, 31(5): 849-856.
张方方, 秦丹, 高良敏, 等. 2012. 环境中雌激素的微生物降解[J]. 微生物学通报, 39(5): 711-721.
张海珍, 陆光华. 2009. 污水处理厂排水中的环境雌激素对鱼影响的生物标志物研究[J]. 毒理学杂志, 23(1): 78-81.
《生态环境学报》被评为2013年中国国际影响力优秀学术期刊
接中国学术期刊(光盘版)电子杂志社、清华大学图书馆、中国学术文献国际评价研究中心通知,《生态环境学报》被评为2013年中国国际影响力优秀学术期刊。
《生态环境学报》的各项学术质量指标都较高
据中国科学技术信息研究所2013年9月发布的《2013版中国期刊引证报告(核心版)》,《生态环境学报》2012年的核心影响因子为1.105(即在1994种中国科技核心期刊中统计的数据)、核心总被引频次为4025次,核心他引率0.93,基金论文比0.90(即90%)。影响因子、被引频次在生态学类(2013年新分出的一类)7种核心期刊中分别列第3和第4位,在全国1994种核心期刊中分别列第101和70位。
另据中国知网中国科学文献计量评价研究中心2013年11月发布的《中国学术期刊影响因子年报(自然科学与工程技术•2013版)》,《生态环境学报》2012年的影响因子为1.969,总被引频次为9832,影响因子在环境科学类66种期刊中的排序为第4位,在农业基础科学类20种期刊中的排序为第3位。5年影响因子为2.401。2012年Web全篇下载量为19.50万次。
《生态环境学报》荣获中国精品科技期刊称号
接中国科学技术信息研究所通知,经中国精品科技期刊遴选指标体系综合评价,《生态环境学报》2011年被评选为中国精品科技期刊。这一届中国精品科技期刊评选300种。
《生态环境》(现《生态环境学报》)继续被评为中文核心期刊
《生态环境》(现《生态环境学报》)继续被评为中文核心期刊。接《中文核心期刊要目总览》2011年版编委会通知:“依据文献计量学的原理和方法,经研究人员对相关文献的检索、统计和分析,以及学科专家评审,贵刊《生态环境》(改名为:《生态环境学报》)入编《中文核心期刊要目总览》2011年版(即第六版)之环境科学、安全科学类的核心期刊。该书由北京大学出版社出版。”
这次对核心期刊的评价仍采用定量评价和定性评审相结合的方法。定量评价指标体系采用了9个评价指标,选作评价指标统计源的数据库及文摘刊物达到60余种,统计到的文献数量共计221177余万篇次,涉及期刊14400余种。参加核心期刊评审的学科专家达8200多位。经过定量筛选和专家定性评审,从我国正在出版的中文期刊中评选出1982种核心期刊。
Effects of estrogens on water environment by livestock excretion
CHEN Lei, WANG Zheng, CAO Shiwei
School of Civil Engineering, Nanjing Forestry University, Nanjing 210037,. China
Environmental estrogens are a class of hormones which can interfere with the biological synthesis, secretion, transport, activity, or play the role of hormones because of the similar structure with biological hormone. These chemical substances may adversely affect the growth, reproduction and behavior of the organisms. The contamination of estrogens will disrupt the endocrine systems and induce sexual abnormalities in wildlife, and may lead to the disappearance of the species. They can be divided into natural estrogens and synthesized estrogens. Farm livestock excreta may be a major source of estrogen and its risk should be concerned. Many studies have been carried out on their environmental behaviors, including experiments in the lab and the field investigations. The large amount of estrogens generated from livestock could be absorbed to the soil particles, suspended colloids or sediment particles rapidly and then degraded by biotic pathways when they are released into the environment, which has been proved by the static equilibrium adsorption experiments, soil column experiments and biodegradation experiments. Thus it has been suggested that the contribution of livestock farming to the estrogens in the surrounding environment is very small. However, the field investigation results show that the migration of estrogen was higher than the theoretical expectations. So a link between the estrogens from farms excrement with the endocrine disruption in surrounding water environment is still not clear. Research progresses on mobility and degradation of estrogens and results of field studies, as well as the amount of estrogens produced by livestock, are introduced in detail in this paper. Subsequently contribution of estrogens by livestock to water environment is discussed. Estimation of the impact of livestock farming on the surrounding water environment in different periods by establishing a comprehensive model after in situ experiments and study on the influence of coexisting substances such as natural organic matter and antibiotics is proposed.
estrogens; livestock excretion; sorption; transport; degradation
X713
A
1674-5906(2014)02-0359-06
陈蕾,王郑,曹世玮. 畜禽养殖排放的雌激素对周边水体环境的影响[J]. 生态环境学报, 2014, 23(2): 359-364.
CHEN Lei, WANG Zheng, CAO Shiwei. Effects of estrogens on water environment by livestock excretion [J]. Ecology and Environmental Sciences, 2014, 23(2): 359-364.
国家自然科学基金项目(41301545);江苏省自然科学基金项目(BK20130961);江苏省高校自然科学研究面上项目(13KJB610007);南京林业大学高学历人才基金项目(GXL201319)
陈蕾(1985年生),女,讲师,博士,从事有机污染物的环境行为与生态风险的研究。E-mail: clymcl@163.com
2013-11-11
