CuO/ZnO/CeO2/ZrO2催化剂上甲醇水蒸气重整制氢反应机理研究
2014-02-08潘立卫倪长军彭家喜赵生生王树东胡永康王安杰
张 磊, 潘立卫, 倪长军, 彭家喜, 赵生生, 王树东, 胡永康, 王安杰
(1.辽宁石油化工大学化学化工与环境学部,辽宁抚顺 113001;2.中国科学院大连化学物理研究所,辽宁大连 116023;3.大连理工大学精细化工国家重点实验室,辽宁大连 116024)
0 引 言
氢能与燃料电池是一个庞大而复杂的能源系统,降低成本、延长使用寿命和提高运行可靠性是其面临的主要问题.目前各国在相继进行氢能及燃料电池示范的同时将重点转向基础研究,希望通过研究氢能与燃料电池技术中的基础性问题,寻求实现氢能与燃料电池产业化的办法.液体燃料甲醇因具有制氢条件相对温和、制氢过程相对容易实现等特点而成为富氢燃料中的首选.甲醇重整制氢主要包括甲醇水蒸气重整制氢[1-2]、甲醇部分氧化重整制氢[3-4]和甲醇自热重整制氢[5-6],其中甲醇水蒸气重整制氢反应条件温和,重整尾气中H2含量高,CO含量低,有利于实现系统的集成.
虽然甲醇水蒸气重整制氢反应机理已被广泛讨论[7-12],但到目前为止,仍存在一些分歧.根据各种分歧,大致可把其反应机理分为两类.
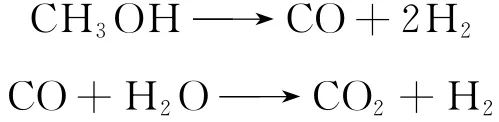
Pour等[7]在Cu/Zn O/Cr2O3/Al2O3催化剂上研究甲醇水蒸气重整制氢反应时,发现产物中总是有CO的存在,由此推测其可能经历甲醇分解(MD)和水气变换(WGS)两个反应过程,提出一种假设的反应机理:
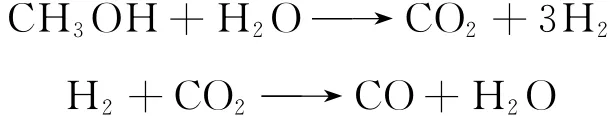
Jiang等[8]和Peppley等[9-10]提出了另一种假设,即甲醇和水蒸气先发生重整反应(MSR),再经逆水气变换反应(RWGS)产生CO,反应机理如下:
目前,Jiang等[8]和Peppley等[9-10]提出的反应机理普遍被接受,但对于该反应过程的中间过渡产物仍存在一定分歧.Jiang等[8]认为甲醇水蒸气重整制氢反应的中间过渡产物为甲酸甲酯和甲酸.但Breen等[11]的研究认为甲醇水蒸气重整制氢反应的中间过渡产物为甲醛和甲酸,Shishido等[12]通过程序升温脱附实验证明了中间过渡产物甲醛的存在.
本文利用原位傅里叶变换红外光谱(in situ FT-IR)技术,对甲醇水蒸气重整制氢反应机理进行系统研究,以期得到合理的反应机理.
1 热力学计算
铜基催化剂上的甲醇水蒸气重整制氢反应过程可以有效避免甲烷等副产物的产生,体系中主要存在甲醇(CH3OH)、水(H2O)、一氧化碳(CO)、二氧化碳(CO2)和氢气(H2)5种组分,含碳(C)、氢(H)、氧(O)3种元素,因此该体系有两个独立反应,选择MSR-RWGS反应机理进行计算分析.
热力学计算中所用到的方程如下:
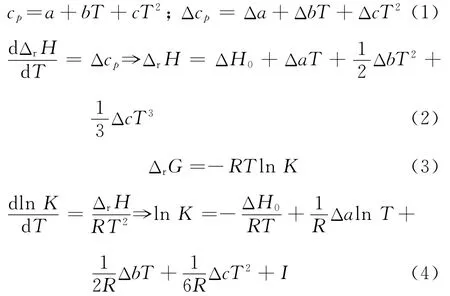
2 实验部分
2.1 催化剂的制备
按Cu O、Zn O、CeO2、Zr O2的质量比为45∶20∶20∶15配制0.1 mol/L含Cu、Zn、Ce和Zr的硝酸盐水溶液,以及1.2倍物质的量的0.5 mol/L的碳酸钠(Na2CO3)水溶液,在60℃强烈搅拌下,将碳酸钠(Na2CO3)溶液滴入硝酸盐混合溶液中,直至p H达到8.于沉淀温度下继续搅拌2 h,再在室温下静置12 h后抽滤,用去离子水洗涤,在110℃下干燥12 h,400℃下焙烧2 h,研磨至120目,压片成型,粉碎成40~60目催化剂.
2.2 原位红外实验
在Thermo公司Nicolet 6700傅里叶变换红外光谱仪上进行原位红外测试,分辨率为6 cm-1,扫描次数为32次.红外池为不锈钢材质,采用ZnSe材质窗口.催化剂20 mg压成的自支撑片放置于池体中间,通入氩气(Ar)吹扫并在280℃下处理30 min后冷却至室温,记录谱图A.吸附混合气的原位红外测试实验是在室温下引入混合气,并在所需的温度下记录谱图B,谱图B与A的差谱即为催化剂吸附混合气后的红外谱图.重整反应的原位红外测试实验是在所需的反应条件下引入反应气,记录反应温度下的谱图C,谱图C与A的差谱即为催化剂上甲醇水蒸气重整制氢反应的红外谱图.
2.3 催化剂的评价
催化剂的评价在自制的石英管反应器中进行,催化剂用量2 m L,将反应器以2℃/min的升温速率升至280℃,用5%H2-N2混合气还原催化剂2 h后,切换成N2并降至反应温度,再切换成甲醇和水的混合物进行反应.重整尾气经冷凝、干燥后进入Ailent-7890D气相色谱在线分析.待反应稳定后采样分析.
3 结果与讨论
3.1 催化剂性能
CuO/ZnO/CeO2/Zr O2催化剂上甲醇水蒸气重整制氢反应性能及热力学平衡曲线如图1所示.由图1可以看出,重整尾气中实际CO含量远低于平衡浓度,如果按照甲醇分解-水气变换反应机理,重整尾气中CO含量应该高于平衡浓度,因此可以推断CO是由重整反应产生的CO2和H2经逆水气变换反应而生成的,此结论与Santacesaria等[13]和韩峭峰等[14]的研究结果一致.
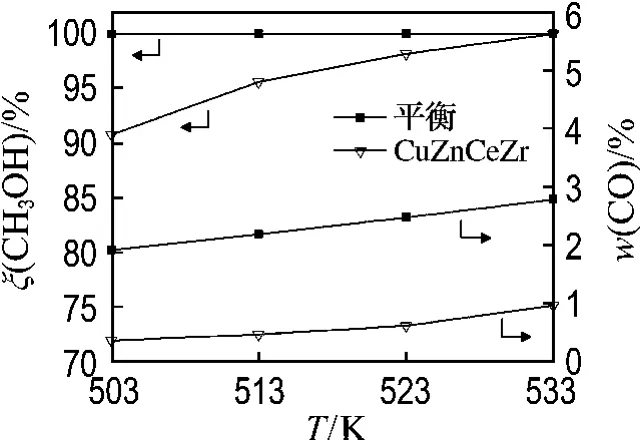
图1 甲醇转化率和重整气中CO含量Fig.1 The methanol conversion and CO concentration in the reforming gas
3.2 甲醇水蒸气重整在预还原处理后的催化剂上的原位红外研究
图2为跟踪研究不同反应温度下甲醇水蒸气重整制氢反应过程的红外谱图.首先对红外光谱中的特征吸收峰进行归属.波数在2 800~3 100 cm-1的多个吸收峰为甲醇CH3OH和甲氧基CH3O的特征吸收峰.2 359和2 320 cm-1两处的特征吸收峰为气相二氧化碳(CO2)的伸缩振动峰.2 183 cm-1可以归属于酮羰基化合物的特征吸收峰.1 765、1 740和1 345 cm-1处的吸收峰可以归属于甲酸甲酯的特征吸收峰,其中1 765和1 740 cm-1处的吸收峰可以归属于甲酸甲酯的OCO不对称伸缩振动峰,1 345 cm-1可以归属于甲酸甲酯的OCO对称伸缩振动峰.1 600 cm-1可以归属于甲酸的伸缩振动峰,1 454 cm-1可以归属于碳酸盐的吸收峰.在低波数范围内出现的1 062、1 032和1 004 cm-13个吸收峰,可以归属于甲氧基的甲基(CH3)的面内摇摆振动和C—O伸缩振动峰.
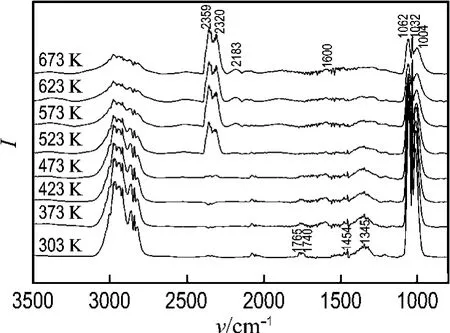
图2 预还原处理后催化剂上甲醇水蒸气重整红外谱图Fig.2 IR spectra of methanol steam reforming on the pre-reduced catalyst
从图2中可以看出,在303 K时,出现了甲氧基(CH3O)和甲酸甲酯的红外特征吸收峰,说明常温下甲醇可在Cu O/Zn O/CeO2/Zr O2催化剂上脱氢解离,生成甲氧基,甲氧基进一步转化为甲酸甲酯.随反应温度的升高,2 800~3 100 cm-1和1 000~1 200 cm-1处的甲醇和甲氧基的特征吸收峰减弱,说明随反应温度的升高,甲醇和甲氧基的转化速度加快.当温度达到473 K时,出现了气相CO2的伸缩振动峰(图中2 359和2 320 cm-1),说明该温度下,部分甲酸甲酯与表面氧(CeO2/Zr O2载体提供)或水反应生成甲酸,甲酸分解生成CO2和H2.甲酸的红外特征吸收峰有两个谱带,分别在靠近1 600和1 400 cm-1处[15],由于反应体系中水在该范围内会出现锯齿峰[16],在原位红外谱图中,甲酸的红外特征吸收峰辨别较难.但从谱图中1 600 cm-1处出现的一个微弱的特征吸收峰,可以说明有甲酸物种的存在.Peppley等[9-10]和Breen等[11]在研究铜基催化剂上甲醇水蒸气重整制氢反应机理的过程中同样发现了微弱的甲酸的特征吸收峰,因此推测出,反应历程要经过水解后产生甲酸,甲酸分解为CO2和H2.
另外,值得一提的是,473 K时谱图中并未发现酮羰基化合物的红外特征吸收峰,说明此时没有CO物种的生成.在CuO/ZnO/CeO2/Zr O2催化剂上,甲醇水蒸气反应体系先生成的是CO2,因此CO2并非由水气变换反应而生成.因此可以进一步验证,甲醇水蒸气重整制氢反应体系是由甲醇和水蒸气的重整反应和逆水气变换反应组成的.当反应温度升高到523 K时,谱图中出现了微弱的酮羰基化合物的伸缩振动吸收峰(2 183 cm-1),说明有CO物种的生成,且随反应温度的升高,CO特征吸收峰逐渐增强.
从甲醇水蒸气重整制氢反应的原位红外谱图可以得到,在Cu O/Zn O/CeO2/Zr O2催化剂上甲醇水蒸气重整制氢反应过程是由甲醇水蒸气先重整,再经逆水气变换反应的机理进行的.另外,从谱图中明显出现的甲酸甲酯和甲酸的红外特征吸收峰说明该反应历程主要经历3个步骤,即甲醇脱氢解离形成甲氧基,甲氧基转化为中间过渡产物甲酸甲酯;甲酸甲酯转化为甲酸,再分解生成CO2和H2;经逆水气变换反应生成副产物CO.
3.3 甲醇在预还原处理后催化剂上的吸附-分解行为研究
为了进一步深入研究甲醇水蒸气重整制氢反应机理,本文还对甲醇在预还原处理后的Cu O/ZnO/CeO2/Zr O2催化剂上的吸附-分解行为进行了研究,结果如图3所示.
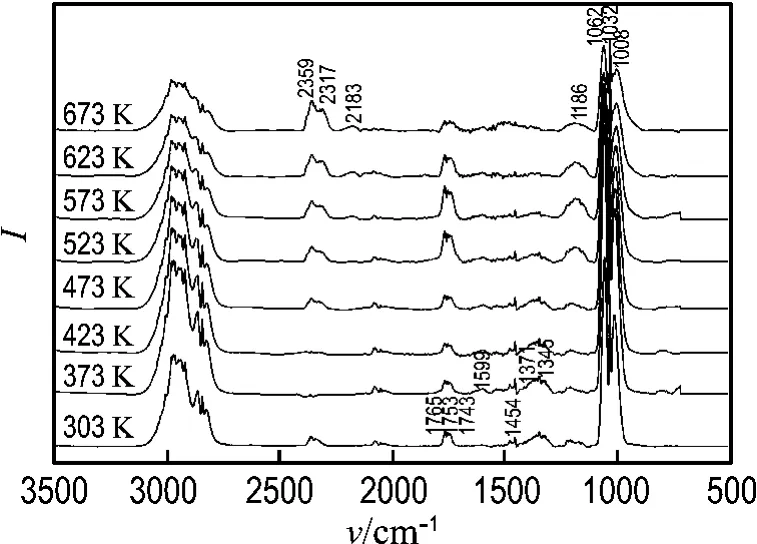
图3 甲醇在预还原处理后催化剂上吸附的红外谱图Fig.3 IR spectra of methanol adsorption on the pre-reduced catalyst
图3的各个吸收峰的归属与图2的归属相同.除此之外,相比图2,图3在1 371 cm-1处多出了一个相对较弱的特征吸收峰,可以归属于甲酸的变形振动峰,由于甲醇水蒸气重整反应中有水的作用,此处的特征峰在图2中无法分辨.在303 K时,图2和3的红外特征峰基本相同,说明甲醇水蒸气重整反应和甲醇分解反应都首先经历甲醇的脱氢解离生成甲氧基和甲氧基进一步转化为甲酸甲酯的过程.另外,从图3中可以看出,当吸附温度升高到473 K时,也首先出现了CO2红外吸收特征峰,但并未出现CO,这主要是由于CeO2/Zr O2载体有较好的储放氧功能[17-18],能够提供表面氧物种,因此甲酸甲酯先与载体的表面氧结合生成甲酸,甲酸分解生成了CO2和H2.Larrubia Vargas等[19]的研究表明,甲醇在未还原的CuO/ZnO/Al2O3催化剂上分解同样先生成CO2,之后才出现CO,这主要是因为未还原的催化剂有表面氧物种的存在,致使甲醇脱氢解离后的甲氧基和甲酸甲酯先与表面氧结合生成甲酸,甲酸分解生成CO2和H2.反应温度继续升高,才会有部分甲酸甲酯分解生成CO和H2,这与本实验结果基本一致.当吸附温度达到573 K时,在2 183 cm-1处才出现了一个较小的酮羰基化合物的伸缩振动吸收峰.
3.4 甲酸甲酯在预还原处理后催化剂上的吸附行为研究
在甲醇分解和甲醇水蒸气重整原位实验中,均出现了甲酸甲酯的红外特征吸收峰,因此为了进一步研究这两个反应在Cu O/ZnO/CeO2/Zr O2催化剂上的机理,本文还对甲酸甲酯在280℃预还原处理后的Cu O/Zn O/CeO2/Zr O2催化剂上的吸附行为进行了研究(图4).
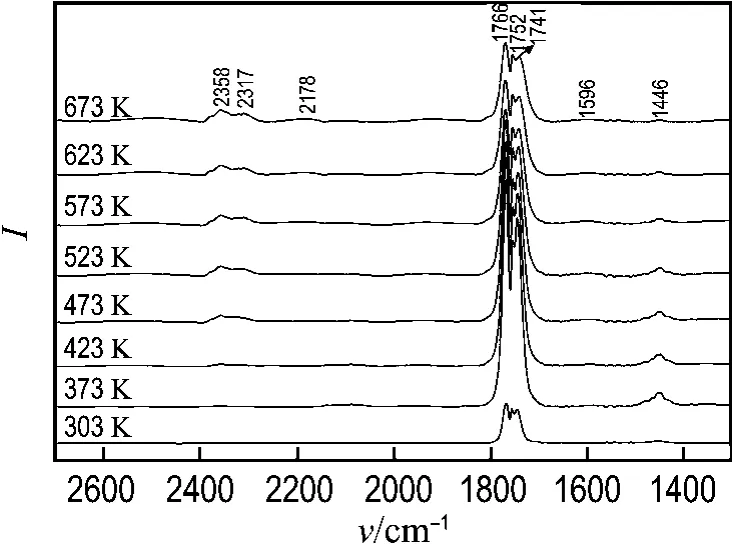
图4 甲酸甲酯在预还原处理后催化剂上吸附的红外谱图Fig.4 IR spectra of methyl formate adsorption on the pre-reduced catalyst
在室温下,甲酸甲酯的吸附与甲醇的吸附谱图类似,在1 750 cm-1附近都出现了较强的甲酸甲酯特征吸收峰,说明甲酸甲酯在室温下可以解离吸附在催化剂表面,进而证明了之前提出的甲醇在常温下可以转化为甲酸甲酯的形式吸附在催化剂上.另外,从图2、3和4可以看到,CO2的出现温度都在473 K,说明甲酸甲酯在CuO/ZnO/CeO2/Zr O2催化剂上都首先转化为CO2,而并非CO,这主要是由于CeO2/Zr O2载体有较好的储放氧功能[18],能够为催化反应提供氧物种.另外,当吸附温度升高到573 K时,出现了酮羰基化合物的红外特征吸收峰,这也与甲醇分解产生CO的温度一致.从图3和4可以看出,甲醇分解的情况与甲酸甲酯的分解情况基本保持一致,可以说明甲醇分解经历了甲酸甲酯分解的过程.进一步对比图2、3和4可以得出,无论是甲醇分解反应还是甲醇水蒸气重整反应,中间过渡产物都为甲酸甲酯.
3.5 甲醇分解反应和甲醇水蒸气重整反应的机理讨论
3.5.1 CuO/ZnO/CeO2/Zr O2催化剂上甲醇分解反应机理 根据以上分析得出,甲醇在CuO/ZnO/CeO2/Zr O2催化剂上的分解反应首先生成CO2和H2,这主要是因为本实验所用的CeO2/ Zr O2载体以固溶体形式存在[18],有良好的储放氧功能,晶格氧具有较高的活性,容易向表面迁移,能使甲酸甲酯先与表面氧结合转化为甲酸,再分解为CO2和H2.
综上所述,甲醇在Cu O/Zn O/CeO2/Zr O2催化剂上的分解反应主要经历了两个过程:(1)常温下的甲醇脱氢解离生成甲氧基,甲氧基进一步转化为甲酸甲酯.(2)吸附温度达到473 K时,甲酸甲酯与载体提供的表面氧结合,产生甲酸,甲酸再分解为CO2和H2.吸附温度达到573 K时,部分甲酸甲酯分解为CO和H2.此机理如图5所示.
3.5.2 Cu O/Zn O/CeO2/Zr O2催化剂上甲醇水蒸气重整反应机理 通过对甲醇水蒸气重整反应的原位红外研究可以得出,甲醇水蒸气重整反应主要经历了甲醇的脱氢解离、甲酸甲酯转化为甲酸以及甲酸分解为CO2和H2的反应过程.Larrubia Vargas等[19]认为,水实际上是一种氧化剂,为甲醇水蒸气重整反应过程提供充足的氧物种(反应如式(5)),使得甲醇转化为CO2和H2.但由于逆水气变换反应的存在而产生了副产物CO.因此,当反应温度低于573 K时,CO主要是由逆水气变换反应而产生的.当反应温度高于573 K时,CO可能是由逆水气变换反应和甲醇分解反应共同作用而产生的.
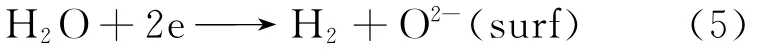
在Cu O/Zn O/CeO2/Zr O2催化剂上,甲醇在Cu表面上不断解离吸附的同时,解离出的氢在Zn表面上活化且通过界面向CeO2/Zr O2载体溢流,因此促进了甲酸甲酯转化和甲酸物种的分解.在此过程中,活性组分和载体对甲醇水蒸气重整制氢反应过程表现出了一种协同效应.因此,Cu O/Zn O/CeO2/Zr O2催化剂对甲醇水蒸气重整制氢反应具有良好的活性.
综上,甲醇水蒸气重整制氢反应主要经历3个过程:(1)甲醇脱氢解离生成甲氧基和甲氧基转化为甲酸甲酯;(2)甲酸甲酯转化为甲酸后分解为CO2和H2;(3)经逆水气变换反应生成副产物CO.此机理如图6所示.
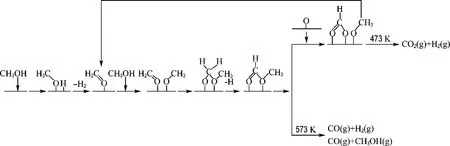
图5 Cu O/Zn O/CeO2/Zr O2催化剂上甲醇分解反应机理图Fig.5 The schematic of methanol decomposition over CuO/ZnO/CeO2/ZrO2 catalyst
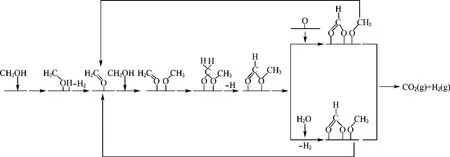
图6 Cu O/Zn O/CeO2/Zr O2催化剂上甲醇水蒸气重整反应机理图Fig.6 The schematic of methanol steam reforming over CuO/Zn O/CeO2/Zr O2 catalyst
4 结 语
本文利用原位傅里叶变换红外光谱对在Cu O/Zn O/CeO2/Zr O2催化剂上的甲醇分解反应和甲醇水蒸气重整制氢反应机理进行了研究,结果发现,甲醇分解反应主要经历了甲醇脱氢解离及甲酸甲酯转化和分解两个过程.而甲醇水蒸气重整制氢反应主要经历了3个过程,即甲醇脱氢解离、甲酸甲酯转化和逆水气变换反应.甲醇分解和甲醇水蒸气重整制氢反应的中间过渡产物都为甲酸甲酯和甲酸.
[1]Fukunaga T,Ryumon N,Ichikuni N,etal.Characterization of Cu Mn-spinel catalyst for methanol steam reforming[J].Catalysis Communications,2009,10(14):1800-1803.
[2]Huang Gang,Liaw Biing-jye,Jhang Cheng-jyun,etal.Steam reforming of methanol over CuO/ZnO/CeO2/ZrO2/Al2O3catalysts[J].Applied Catalysis A:General,2009,358(1):7-12.
[3] 潘相敏,宋小瑜,余 瀛,等.湿混法制备甲醇氧化重整制氢CuZn AlZr催化剂[J].燃料化学学报,2005,33(3):339-343.(in Chinese)
PAN Xiang-min,SONG Xiao-yu,YU Ying,etal.Wet-mixed CuZn AlZr catalysts for oxidative steam reforming of methanol[J].Journal of Fuel Chemistry and Technology,2005,33(3):339-343.(in Chinese)
[4]Agrell J,Germani G,Jaras S G,etal.Production of hydrogen by partial oxidation of methanol over ZnO-supported palladium catalysts prepared by microemulsion technique[J].Applied Catalysis A:General,2003,242(2):233-245.
[5]MU Xin,PAN Li-wei,LIU Na,etal.Autothermal reforming of methanol in a mini-reactor for a miniature fuel cell[J].International Journal of Hydrogen Energy,2007,32(15):3327-3334.
[6]LIU Na,YUAN Zhong-shan,WANG Shu-dong,etal.Characterization and performance of a ZnO-ZnCr2O4/CeO2-Zr O2monolithic catalyst for methanol auto-thermal reforming process[J].International Journal of Hydrogen Energy,2008,33(6):1643-1651.
[7]Pour V,BartoňJ,Benda A.Kinetics of catalyzed reaction of methanol with water vapour[J].Collection of Czechoslovak Chemical Communications,1975,40(10):2923-2934.
[8]Jiang C J,Trimm D L,Wainwright M S.Kinetic study of steam reforming of methanol over copperbased catalysts[J].Applied Catalysis A:General,1993,93(2):245-255.
[9]Peppley B A,Amphlett J C,Kearns L M,etal.Methanol-steam reforming on Cu/ZnO/Al2O3.Part 1:The reaction network[J].Applied Catalysis A:General,1999,179(1-2):21-29.
[10]Peppley B A,Amphlett J C,Kearns L M,etal.Methanol-steam reforming on Cu/ZnO/Al2O3catalysts.Part 2.A comprehensive kinetic model[J].Applied Catalysis A:General,1999,179(1-2):31-49.
[11]Breen J P,Ross J R H.Methanol reforming for fuel-cell applications:development of zirconiacontaining Cu-Zn-Al catalysts[J].Catalysis Today,1999,51(3-4):521-533.
[12]Shishido T,Yamamoto Y,Morioka H,etal.Production of hydrogen from methanol over Cu/ZnO and Cu/ZnO/Al2O3catalysts prepared by homogeneous precipitation:Steam reforming and oxidative steam reforming[J].Journal of Molecular Catalysis A:Chemical,2007,268(1):185-194.
[13]Santacesaria E,CarráS.Kinetics of catalytic steam reforming of methanol in a CSTR reactor[J].Applied Catalysis,1983,5(3):345-358.
[14]韩峭峰,李永峰,董新法,等.甲醇水蒸汽重整制氢反应的热力学分析[J].工业催化,2007,15(1):43-46.
HAN Qiao-feng,LI Yong-feng,DONG Xin-fa,etal.Thermodynamics for methanol steam reforming reaction[J].Industrial Catalysis,2007,15(1):43-46.(in Chinese)
[15]Silverstein R M,Webster F X,Kiemle D J.有机化合物的波谱解析[M].药明康德新药开发有限公司分析部,译.上海:华东理工大学出版社,2007.
Silverstein R M,Webster F X,Kiemle D J.Spectrometric Identification of Organic Compounds[M].Department of Analysis,Wuxi PharmaTech Co.Ltd.,tran.Shanghai:East China University of Science and Technology Press,2007.(in Chinese)
[16]李言浩,马沛生,苏 旭,等.铜系催化剂上甲醇蒸汽转化制氢过程的原位红外研究[J].催化学报,2003,24(2):93-96.
LI Yan-hao,MA Pei-sheng,SU Xu,etal.Study on process of methanol steam-reforming to hydrogen over CuO/ZnO/Al2O3catalyst by in situ infrared spectroscopy[J].Chinese Journal of Catalysis,2003,24(2):93-96.(in Chinese)
[17]CAO Lei,NI Chang-jun,YUAN Zhong-shan,etal.Correlation between catalytic selectivity and oxygen storage capacity in autothermal reforming of methane over Rh/Ce0.45Zr0.45RE0.1catalysts(RE=La,Pr,Nd,Sm,Eu,Gd,Tb)[J].Catalysis Communications,2009,10(8):1192-1195.
[18]ZHANG Lei,PAN Li-wei,NI Chang-jun,etal.CeO2-Zr O2-promoted CuO/ZnO catalyst for methanol steam reforming[J].International Journal of Hydrogen Energy,2013,38(11):4397-4406.
[19]Larrubia Vargas M A,Busca G,Costantino U,etal.An IR study of methanol steam reforming over ex-hydrotalcite Cu-Zn-Al catalysts[J].Journal of Molecular Catalysis A:Chemical,2007,266(1-2):188-197.
