间质比例与结直肠癌临床病理特征及患者预后的关系研究
2014-02-08杜波,但杰
杜 波,但 杰
随着研究进展,肿瘤的发生发展不再仅仅被看作上皮细胞基因突变和失控生长的结果。肿瘤微环境由肿瘤细胞周围细胞外基质(extracellular matrix,ECM)及炎症细胞、成纤维细胞、内皮细胞等多种细胞成分组成,在肿瘤发生发展中发挥重要作用[1]。ECM在肿瘤进程中发生持续的动态变化,在病理切片上多表现为结缔组织生成/纤维粘连,广泛影响肿瘤的发生、生长、侵袭、转移等生物学行为[2-3]。肿瘤间质的多少在一定程度上体现了肿瘤相关ECM的特点,本研究探讨间质比例(stroma percentage,SP)与结直肠癌临床病理特征及患者预后的关联。
1 资料与方法
1.1 一般资料 选取我院病理科2009—2012年存档的石蜡包埋结直肠癌标本121例,所有患者均在我院行根治性切除手术,临床病理特征见表1。患者年龄为36~82岁,平均为(61.7±10.9)岁;男80例(66.1%),女41例(33.9%)。
表1 121例结直肠癌患者肿瘤临床病理特征(%)
Table1 Clinicopathologic characteristics of tumors in 121 colorectal cancer patients

例数构成比(%)部位 结肠46380 直肠75620组织学分级 高分化41339 中分化67554 低分化13107浸润深度 pT1(黏膜下层)12 99 pT2(固有肌层)61504 pT3(浆膜下层)35289 pT4(穿透腹膜脏层)13108pN分级 0(阴性)37306 1(1~3枚阳性)56463 2(≥4枚阳性)28231TNM分期 Ⅰ23190 Ⅱ14116 Ⅲ84694复发/转移 有37306 无84694
注:pN=淋巴结分级标准
1.2 方法
1.2.1 肿瘤SP测定 参照文献[4],选取肿瘤浸润部分组织切片,常规HE染色,低倍镜下观察,随机选取五个视野摄像。用Image J图像编辑软件选取肿瘤实质区域(见图1),每张切片由两名病理医师共同判定实质与间质分布情况,测量其面积,计算间质面积百分比,综合五个视野所得平均值为该肿瘤SP。将SP≥50%定为间质高比例(见图1A),<50%定为间质低比例(见图1B)。
1.2.2 随访方法及预后判断标准 从患者完成必要的放化疗后开始规律门诊随访。并于2013年3—4月进行集中信访、电话回访,随访截至2013-04-15。事件包括局部复发、远处转移、结直肠癌相关死亡。无进展生存期(progression free survival,PFS)为确诊至发现复发、转移时间段,总生存期(overall survival,OS)为确诊至死亡、失访及最后随访时间段。
1.3 统计学方法 采用SPSS 17.0统计软件分析系统进行频数分布分析、χ2检验(分类变量)及t检验(连续变量)分析SP与肿瘤临床病理特征之间的关联。用Kaplan-Meier生存分析SP与患者预后之间的关系。以P<0.05为差异有统计学意义。
2 结果
2.1 结直肠癌组织中SP分布特点 在121例结直肠癌组织中,SP从14.2%到88.3%不等,平均为(45.8±17.3)%。SP符合正态分布(见图2)。

注:A:间质高比例肿瘤;B:间质低比例肿瘤;图中选中区域为癌实质部分,放大倍数为100倍;SP=间质比例
图1 结直肠癌HE染色切片测定SP典型图像
Figure1 Represented image samples of selected tumor area on HE stained sections of colorectal carcinomas
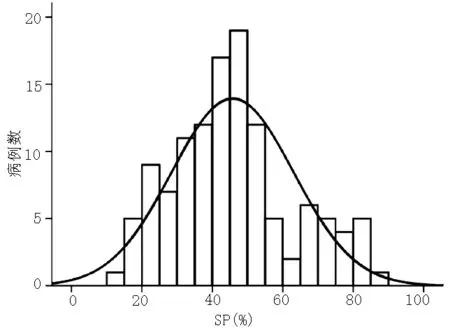
图2 结直肠癌组织中SP频数分布
2.2 SP与肿瘤临床病理特征的关系 高SP与低SP肿瘤在浸润深度、复发/转移上差异有统计学意义(P<0.05),而在年龄、性别、部位、组织学分级、淋巴结转移及TNM分期上差异无统计学意义(P>0.05,见表2)。

表2 高SP与低SP肿瘤临床病理特征比较
注:*为t值,余检验统计量值为χ2值
2.3 SP与患者预后的关系 截至2013-04-15,对121例结直肠癌患者的随访时间为4.5~40.3个月,中位随访时间为29.9个月。全组复发21例,远处转移16例(分别为肝转移11例、肺转移3例、腹膜转移2例),死亡15例。生存分析显示间质高比例与低比例肿瘤患者无进展生存时间间差异有统计学意义(中位生存时间29.2个月比34.3个月;P=0.045);而总生存时间间差异无统计学意义(中位生存时间33.5个月比36.8个月;P=0.078,见图3)。

图3 高SP及低SP结直肠癌患者生存曲线
Figure3 Kaplan-Meier curves of colorectal cancer patients with high SP and low SP
3 讨论
ECM是肿瘤微环境的重要组成部分,其成分、结构及紧密程度在肿瘤演进中处于持续的动态变化,广泛影响肿瘤生成、生长、侵袭和转移等生物学行为[2-3]。肿瘤间质的多少在一定程度上反映肿瘤微环境中ECM的特征,本研究显示肿瘤间质高比例与肿瘤浸润范围及患者无进展生存显著相关,提示SP与肿瘤进展及患者预后有关,可能是独立的预后因子。
肿瘤是由肿瘤细胞、ECM、肿瘤间质细胞组成的复合体。ECM在正常组织中为上皮提供组织支持,在正常组织形态的维持中起重要作用。在肿瘤发生发展中,ECM的组成、结构及密度均发生明显改变。Mesker等[4-5]的研究发现结直肠癌组织切片中细胞成分少、间质成分多与患者预后(无进展生存及总生存)不良显著相关。在乳腺癌及食管癌中的研究也有类似结果[6-7]。本研究显示结直肠癌切片中肿瘤间质高比例与肿瘤浸润范围广及患者无进展生存不良密切相关,与上述结果一致,共同提示肿瘤间质的多少与肿瘤进展及患者预后密切相关,或可作为独立的预后因子。本研究结果显示间质高比例患者总生存亦更差,但差异无统计学意义,可能与样本量及随访时间不足有关。值得一提的是,Sis等[8]、Caporale等[9]的研究则显示结直肠癌组织中结缔组织增生在结直肠癌患者中则可能是保护性因子。目前SP与患者预后的关联研究较少,因此其确切意义尚需大样本及长期随访进一步证实。
ECM在组织结构的维持中扮演重要角色,ECM及间质细胞形成的梯度压力是结直肠隐窝保持极性的要素之一。肿瘤相关成纤维细胞是肿瘤基质成分最主要的来源之一,研究显示结直肠癌肿瘤相关成纤维细胞产生胶原酶等基质成分的能力明显增加[10]。有学者认为肿瘤相关成纤维细胞产生大量ECM后可在肿瘤细胞周围形成致密的屏障,抑制肿瘤侵袭转移[10]。最新理论则认为肿瘤间质细胞及ECM在肿瘤组织中可产生机械性压力,因而在肿瘤侵袭和转移中扮演重要角色。与肿瘤细胞相比,活化的肿瘤相关成纤维细胞具有更强的运动能力,且其细胞间连接紧密,因而能成群地主动进入肿瘤细胞成分,进而产生胶原酶等ECM,这些细胞和基质成分可以对肿瘤细胞产生不均衡压力,并促进肿瘤细胞侵袭[11]。本研究显示肿瘤组织中间质高比例者浸润范围更广,复发转移更多,患者预后更差,符合上述理论。提示抑制肿瘤相关ECM产生可能对结直肠癌产生治疗作用。基于目前研究,靶向肿瘤微环境及肿瘤相关ECM是各种肿瘤治疗中颇有前景的研究方向[12],但它们对结直肠癌的影响仍不完全清楚,上述理论亦需更多试验提供证据。
综上,肿瘤组织中间质成分的多少可能是结直肠癌独立的预后预测因子。评估组织切片中间质成分的多少有多种方法,最初采用半定量分析[4-5,7],后有研究结合图像分析软件及自动识别等手段进行定量分析[6,9]。本研究采用图像结合软件结合镜下判断手工分析肿瘤SP,方法及结果与前期研究一致。值得一提的是,本研
究及其他研究均在HE染色切片中进行分析,提示HE染色切片除了提供常规病理信息外还可能提供患者预后信息,但目前尚没有统一的分析方法及有用的临界值可用于评估肿瘤SP及其预后意义。因此,将肿瘤SP应用于病理诊断及预后判断尚需更多研究进一步验证。
1 Marx J.Cancer biology.All in the stroma:Cancer′s Cosa Nostra[J].Science,2008,320(5872):38-41.
2 Lu P,Weaver VM,Werb Z.The extracellular matrix:A dynamic niche in cancer progression[J].J Cell Biol,2012,196(4):395-406.
3 Ozbek S,Balasubramanian PG,Chiquet-Ehrismann R,et al.The evolution of extracellular matrix[J].Mol Biol Cell,2010,21(24):4300-4305.
4 Mesker WE,Liefers GJ,Junggeburt JM,et al.Presence of a high amount of stroma and downregulation of SMAD4 predict for worse survival for stage I-II colon cancer patients[J].Cell Oncol,2009,31(3):169-178.
5 Mesker WE,Junggeburt JM,Szuhai K,et al.The carcinoma-stromal ratio of colon carcinoma is an independent factor for survival compared to lymph node status and tumor stage[J].Cell Oncol,2007,29(5):387-398.
6 Courrech Staal EF,Wouters MW,van Sandick JW,et al.The stromal part of adenocarcinomas of the oesophagus:Does it conceal targets for therapy?[J].Eur J Cancer,2010,46(4):720-728.
7 de Kruijf EM,van Nes JG,van de Velde CJ,et al.Tumor-stroma ratio in the primary tumor is a prognostic factor in early breast cancer patients,especially in triple-negative carcinoma patients[J].Breast Cancer Res Treat,2011,125(3):687-696.
8 Sis B,Sarioglu S,Sokmen S,et al.Desmoplasia measured by computer assisted image analysis:An independent prognostic marker in colorectal carcinoma[J].J Clin Pathol,2005,58(1):32-38.
9 Caporale A,Amore Bonapasta S,Scarpini M,et al.Quantitative investigation of desmoplasia as a prognostic indicator in colorectal cancer[J].J Invest Surg,2010,23(2):105-109.
10 Coulson-Thomas VJ,Coulson-Thomas YM,Gesteira TF,et al.Colorectal cancer desmoplastic reaction up-regulates collagen synthesis and restricts cancer cell invasion[J].Cell Tissue Res,2011,346(2):223-236.
11 Karagiannis GS,Poutahidis T,Erdman SE,et al.Cancer-associated fibroblasts drive the progression of metastasis through both paracrine and mechanical pressure on cancer tissue[J].Mol Cancer Res,2012,10(11):1403-1418.
12 Zhang J,Liu J.Tumor stroma as targets for cancer therapy[J].Pharmacol Ther,2013,137(2):200-215.
