替格瑞洛在治疗氯吡格雷抵抗患者时血小板聚集率分析
2014-02-08刘文娴赵一楠任燕龙
李 江,刘文娴,赵一楠,任燕龙
氯吡格雷是血小板二磷酸腺苷(ADP)受体拮抗剂,其联合阿司匹林的双联抗血小板治疗已成为急性冠脉综合征(ACS)及经皮冠状动脉介入治疗(PCI)术后的指南性治疗。但不同的患者对于氯吡格雷的反应存在差异,部分患者在应用氯吡格雷过程中并未减少缺血性心、脑血管事件的发生,也被称为氯吡格雷抵抗(CR)[1]。替格瑞洛是新型抗血小板药物,通过选择性抑制P2Y12受体,从而抑制血栓形成,已有资料显示,替格瑞洛较氯吡格雷具有更强的血小板抑制率[2]。对于PCI术后的氯吡格雷抵抗患者,替格瑞洛的疗效如何?本研究首先筛选出对氯吡格雷抵抗的患者,然后通过检测血小板聚集率来观察替格瑞洛在氯吡格雷抵抗患者中的治疗效果。
1 对象与方法
1.1 研究对象 连续入选2013年5月—2013年9月我院门诊就诊的PCI术后患者,纳入标准为:(1)18周岁以上男性或非妊娠妇女;(2)服用氯吡格雷75 mg/d,≥7 d;(3)PCI术后1年内的冠心病患者。排除标准:(1)血小板计数>450×109/L或<100×109/L;(2)同时应用华法令、潘生丁、西洛他唑药物者;(3)肝肾功能不全者;(4)既往有脑出血患者;(5)既往应用阿司匹林联合氯吡格雷治疗时曾出现以下主要出血的患者〔根据PLATO主要出血定义[2]:主要出血包括致死性出血、颅内出血、伴有心包填塞的心包内出血、出血导致的低血容量性休克或严重低血压并需用升压药或手术治疗、血红蛋白水平下降≥5.0 g/dl或至少需要输注4个单位红细胞;导致有临床意义的残疾的出血(例如眼内出血伴永久性失明),或伴有血红蛋白至少下降3.0 g/dl但<5.0 g/dl的出血,或者需要输注2~3个单位红细胞的出血。次要出血包括:任何需要医学干预但不符合主要出血标准的出血〕。所入选患者均知情同意并签署知情同意书。
1.2 研究方法
1.2.1 筛选氯吡格雷抵抗患者 2013年5—9月我院门诊就诊的PCI术后患者512例,采用比浊法测定血小板聚集率,根据血小板聚集率筛选出氯吡格雷抵抗患者88例(5 μmol/L ADP诱导的血小板聚集率>50%[3])。
1.2.2 分组方法 采用随机数字表法将88例氯吡格雷抵抗患者按1∶1原则随机分为氯吡格雷组43例、替格瑞洛组45例。氯吡格雷组继续使用氯吡格雷75 mg/d;替格瑞洛组将氯吡格雷更换为替格瑞洛(90 mg,2次/d),余治疗不变,观察7 d。
1.2.3 观察项目 (1)治疗7 d前、后血小板聚集率的变化,包括值的变化及达标率(血小板聚集率达标的定义:5 μmol/L ADP诱导的血小板聚集率<50%)。(2)治疗7 d内出血性事件(依据PLATO出血分级[2])。
1.3 仪器、试剂及药物
1.3.1 仪器 普利生(PRECIL)LBY-NJ四通道血小板聚集仪。
1.3.2 试剂 血小板聚集诱导剂二磷酸腺苷(ADP)由北京鼎国生物技术有限责任公司生产,终浓度为5 μmol/L。
1.3.3 血小板聚集率检测 患者空腹抽取肘静脉血2.7 ml为检测血样,留置在抗凝真空管中(质量分数为3.18%的枸橼酸钠按1∶9比例配比),2 h内用比浊法测定ADP诱导的血小板聚集率。
1.3.4 药品 氯吡格雷(波立维,法国赛诺菲公司,75 mg/片);替格瑞洛(倍林达,英国阿斯利康公司,90 mg/片)。
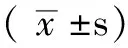
2 结果
2.1 氯吡格雷抵抗患者筛选情况 512例PCI术后患者中男318例,女194例。通过检测血小板聚集率,筛选出氯吡格雷抵抗患者88例,占17.2%。
2.2 两组患者基线资料 88例氯吡格雷抵抗患者分为氯吡格雷组与替格瑞洛组,两组患者临床特征差异均无统计学意义(P>0.05,见表1)。
2.3 调整药物前后两组患者血小板聚集率比较 治疗后替格瑞洛组血小板聚集率低于氯吡格雷组,差异有统计学意义(P<0.01)。替格瑞洛组血小板聚集率下降幅度较氯吡格雷组高,差异有统计学意义(P<0.05)。治疗7 d后替格瑞洛组血小板聚集率达标率高于氯吡格雷组,差异有统计学意义(P<0.05,见表2)。
2.4 出血性事件 替格瑞洛组及氯吡格雷组在试验过程中均无主要出血。次要出血两组各有1例,且均为皮肤黏膜出血,程度较轻,不影响药物应用。

表1 两组患者临床特征比较
注:LDL-C=低密度脂蛋白胆固醇;▲为t值,☆为χ2值

表2 两组患者血小板聚集率比较
注:▲为t值,☆为χ2值
3 讨论
血小板ADP受体拮抗剂氯吡格雷是临床常用的抗血小板药物,对于PCI术后患者,阿司匹林联合氯吡格雷已成为经典的抗血小板治疗。但由于个体的差异,不同患者对氯吡格雷的反应不同,部分患者出现氯吡格雷抵抗现象。导致氯吡格雷抵抗的原因尚不明确,个体差异及基因多态性可能是原因之一[4]。氯吡格雷作为无活性的前体药物,需在肝脏内转化成活性代谢产物后才能发挥抗血小板作用,而肝脏细胞色素同工酶则是这一过程中的关键物质。研究显示,细胞色素同工酶CYP2C19功能异常的基因多态性是导致氯吡格雷抵抗的重要原因,虽然在CYP2C19异常的杂合子患者中,增加氯吡格雷剂量能进一步增强血小板抑制,但在CYP2C19异常的纯合子患者中增加氯吡格雷剂量仍不能增加血小板抑制率[5],2009年美国食品药品监督管理局也曾建议对氯吡格雷代谢率低的患者可增加氯吡格雷的剂量或换用其他抗血小板药物[6],故本研究旨在探讨替格瑞洛是否能克服PCI术后患者的氯吡格雷抵抗问题。
氯吡格雷抵抗的临床事件与实验室检查反映的血小板低抑制率是否相关?虽然两者间的相关性还有争议,但目前确实已有一些实验手段能反映血小板的聚集功能,包括血小板聚集实验、血小板黏附实验等,在一定程度上可能提示氯吡格雷抵抗,且研究发现实验室所表现出的血小板低抑制率与临床事件(包括支架内血栓、再发心肌梗死等)相关[7-8]。以ADP诱导的血小板聚集率实验是检测血小板聚集功能的方法之一,虽然较简单,但其操作简便、费用低廉,在质控严格的前提下,临床上可快速检测出对ADP受体拮抗剂反应不佳的患者[9],故本研究采用以ADP诱导的血小板聚集率来反映ADP受体拮抗剂的疗效。本研究通过测定血小板聚集率的方法,从512例PCI术后患者中筛选出氯吡格雷抵抗患者88例,且入选患者均规律应用氯吡格雷75 mg/d,故血小板低抑制情况确实存在,发生率与报道相似[10]。
对于氯吡格雷抵抗患者的抗血小板治疗,目前还在探索中。替格瑞洛是一种新型药物,是环戊基三唑嘧啶类抗血小板药物,通过选择性抑制P2Y12受体(ADP受体亚型)而减少血栓的形成。ONSET/OFFSET、PLATO等研究显示,替格瑞洛具有强效的抗血小板作用,且起效快、个体差异小[2,11],在实验室检测及缺血性事件等方面较氯吡格雷均具有一定的优势;RESPOND研究显示,对于氯吡格雷低反应的患者,接受替格瑞洛治疗后血小板抑制率较氯吡格雷治疗后明显提高[12]。本研究显示,对于氯吡格雷抵抗的患者,应用替格瑞洛治疗后,不仅血小板聚集率数值较氯吡格雷组下降明显,且治疗达标率也明显提升。故从实验室角度来看,替格瑞洛较氯吡格雷有更强的抗血小板作用,在一定程度上克服了氯吡格雷抵抗患者的血小板低抑制率。
出血是抗血小板治疗时的主要并发症之一,替格瑞洛具有更强的抗血小板作用,是否会导致出血增加呢?PLATO研究显示,对于主要出血(包括致死性出血及危及生命的出血等),替格瑞洛较氯吡格雷无明显增加,仅在非冠状动脉旁路移植术(CABG)相关出血方面有所增加[2]。本研究显示,替格瑞洛组与氯吡格雷组出血并发症均较低(无主要出血,次要出血也无明显差异),具有相似的安全性。本研究出血发生率较低的原因可能与样本量较小、观察时间较短等有关,也可能与入选患者出血风险相对较低有关(既往曾有脑出血的患者、既往应用阿司匹林联合氯吡格雷时曾发生过主要出血的患者未入选本研究)。
综上所述,在本研究中,对于PCI术后的氯吡格雷抵抗患者,将氯吡格雷更换为替格瑞洛后,能进一步降低血小板聚集率、增强血小板抑制率,而出血并发症无明显增加,故替格瑞洛是克服氯吡格雷抵抗的选择之一。但样本量较小,跟踪随访时间较短,且未观察缺血性临床事件等硬终点,是本研究的局限。
1 Chen ZM,Jiang LX,Chen YP,et al.Addition of clopidogrel to aspirin in 45852 patients with acute myocardial infarction:Randomised placebo-controlled trial[J].Lancet,2005,366(9497):1607-1621.
2 Wallentin L,Becker RC,Budaj A,et al.Ticagrelor versus clopidogrel in patients with acute coronary syndromes[J].N Engl J Med,2009,361(11):1045-57.
3 Barragan P,Bouvier JL,Roquebert PO,et al.Resistance to thienopyridines clinical detection of coronary stent thrombosis bymonitoring of vasodilator-stimulated phosphoprotein phosphorylation[J].Catheter Cardiovasc Interv,2003,59(3):295-302.
4 Nguyen TA,Diodati JG,Pharand C.Resistance to clopidogrel a review of the evidence[J].J Am Coll Cardiol,2005,45(8):1157-1164.
5 Collet JP,Hulot JS,Anzaha G,et al.High doses of clopidogrel to overcome genetic resistance:the randomized crossover CLOVIS-2(Clopidogrel and Response Variability Investigation Study 2)[J].JACC Cardiovasc Inrerv,2011,4(4):392-402.
6 FDA drug safety communication:Reduced dffectiveness of Plavix(clopidogrel) in patients who are poor metabolizers of the drug[EB/OL].http://www.fda.gov/Drugs/DrugSafty/Postmarket Drug Safety Information for Patientsand Providers/ucm203888.htm.
7 Geisler T,Langer H,Wydymus M,et al.Low response to clopidogrel is associated with cardiovascular outcome after coronary stent implantation[J].Eur Heart J,2006,27(20):2420-2425.
8 Bonello L,Tantry US,Marcucci R,et al.Consensus and future directions on the definition of high on-clopidogrel platelet reactivity to adenosine diphosphate[J].J Am Coll Cardiol,2010,56:919-933.
9 谭大伟,朱平,李小鹰.氯吡格雷抑制血小板功能的两种检测方法比较:血小板聚集实验与血小板膜糖蛋白检测[J].中国组织工程研究与临床康复,2007,11(11):2021-2024.
10 Gurbel PA,Bliden KP,Hiatt BL,et al.Clopidogrel for coronary stenting:Response variability,drug resistance,and the effect of pretreatment platelet reactivity[J].Circulation,2003,107(23):2908-2913.
11 Gurbel PA,Bliden KP,Butler K,et al.Randomized double-blind assessment of the ONSET and OFFSET of the antiplatelet effects of ticagrelor versus clopidogrel in patients with stable coronary artery disease:The ONSET/OFFSET study[J].Circulation,2009,120(25):2577-2585.
12 Gurbel PA,Bliden KP,Butler K,et al.Response to ticagrelor in clopidogrel nonresponders and responders and effect of switching therapies:The RESPOND study[J].Circulation,2010,121(10):1188-1199.
