农杆菌介导棉花和玉米非组培转化方法探索
2014-02-07刘新星罗俊杰陈玉梁陈子萱裴怀弟李忠旺
刘新星,罗俊杰,陈玉梁,陈子萱,裴怀弟,李忠旺
(甘肃省农业科学院生物技术研究所,甘肃兰州 730070)
农杆菌介导棉花和玉米非组培转化方法探索
刘新星,罗俊杰,陈玉梁,陈子萱,裴怀弟,李忠旺
(甘肃省农业科学院生物技术研究所,甘肃兰州 730070)
采用农杆菌介导植物萌发种子基因转化方法,在棉花和玉米上转化外源目的基因,进行非组培转化法的探索。结果表明,针刺对棉花和玉米种子的萌发没有影响,但对2种作物的出苗率有明显抑制作用。转化过程中,棉花的共培养时间不宜超过24 h,玉米不宜超过48 h。经大田筛选及PCR检测,棉花未获得转化植株,玉米获得转化植株共7株,转化率达0.14%,其中加入AS(乙酰丁香酮)的处理获得6株,不加AS处理获得1株。
非组培转化;农杆菌介导;转化率;棉花;玉米
近年来,植物基因工程技术取得了重要进展,在农作物品种改良和育种方面发挥着越来越重要的作用。目前植物遗传转化所采用的受体系统,大都依赖于细胞组织培养技术才能获得转基因植株,周期长并存在一定的局限性。因而,一些非组培的转化方法近年来迅速发展起来[1],萌动种胚法就是其中一种。刚刚萌动的种胚是最理想的感受态之一[2~3],如果在种子吸胀过程中,辅以划胚处理,从而使细菌有更多的机会进入萌发胚,使整个胚萌动与发育这个细胞生长分化极其活跃的过程(2~3 d)均在菌液中进行,萌发胚的生长点将极易被转化[4]。萌动种胚法主要利用种子萌动时细胞分裂加快、生活力旺盛、具最佳感受态的特点,一方面靠吸胀作用吸入外源DNA,另一方面辅助划胚露出生长点,在AS(乙酰丁香酮)作用下,通过活体农杆菌对伤口的侵袭作用,从而形成转化分生组织及新的生长点,分化出转化苗。AS是一种酚类化合物,可诱发农杆菌内Ti或Ri质粒DNA上Vir区基因的活化和高效表达,现已被广泛应用于农杆菌介导的遗传转化中[5]。孙毅等发明了农杆菌介导植物萌发种子基因转化方法,已申报中国、美国、加拿大和欧洲发明专利[6]。梁雪莲对玉米的试验证实,此种转化方法既省去繁琐漫长的组培过程,又可获得高于基因枪10倍以上的转化率[7]。该方法在玉米上已试验成功,棉花上还没有相关报道。鉴于目前棉花转化困难的最主要原因是难以组培和基因型依赖性强,我们拟利用非组培途径萌动种胚法转化棉花,采用棉花和玉米作为试验材料,试图取得在棉花遗传转化上的突破。
1 材料与方法
1.1 供试材料及预处理
1.1.1 供试材料指示棉花品种为陇绿棉3号,玉米品种为陇单023,均由甘肃省农业科学院作物研究所提供。根癌农杆菌为LBA4404,所用的植物表达载体为PBI121。
1.1.2 材料预处理精选经硫酸脱绒后的棉花种子,先用70%乙醇涮洗30 s,再用30%过氧化氢浸泡3 h,后用无菌水冲洗5~8遍,在无菌水中浸泡12~16 h催芽至种子露白,于超净工作台中剥去种皮。用无菌针灸用针在种子胚芽生长点刺2~3下,备用。挑选籽粒饱满的玉米种子,先用70%乙醇浸泡3min,再用1 g/kg升汞消毒10 min,后用无菌水冲洗3~5次,在无菌水中浸泡5~6h,于超净台里用无菌针灸用针在胚芽刺2~3下,备用。
1.1.3 菌液准备将储存在-70℃冰箱的原始菌液,在含有相应抗生素的YEB平板上进行画线培养,28℃黑暗培养2 d。挑取平板上的单菌落加入含有相应抗生素的5 mL YEB液体培养基中,在220 r/min,28℃的恒温摇床上振荡培养至对数生长期。将菌体按1∶50的比例进行二次活化,活化好的菌液离心后用MSB液体重悬菌体,作为共培养液备用。棉花选用卡那霉素为抗性筛选基因的菌液进行介导,玉米选用Basta除草剂为抗性筛选基因的菌液进行介导。
1.2 PCR分子检测
采集抗性植株和未转化植株的新鲜叶片,棉花采用本实验室改良的方法提取基因组DNA[8],玉米使用试剂盒提取基因组DNA,进行PCR鉴定。
1.3 实验设计
1.3.1 针刺与菌液共培养对种子萌发和出苗的影响取未预处理和经过预处理的棉花种子和玉米种子各100粒,每处理分别置于有菌液的培养皿中黑暗培养,第3天统计发芽数。后将发芽的种子播种于含有蛭石的营养钵中,14 d后统计出苗数。
1.3.2 共培养时间对种子萌发的影响选取经过预处理的棉花和玉米种子各150粒,每处理50粒种子,分别放入相应制备好的共培养液中进行培养,在摇床110 r/min下共培养24、36、48 h。然后用无菌水反复冲洗残留菌液,置于铺有无菌滤纸的培养皿内进行催芽,统计分析共培养时间对种子萌发的影响。
1.3.3 AS(乙酰丁香酮)对转化率的影响共设2个处理,处理1在配制好的菌液中加入200 μmol/L AS,处理2不加AS,2次重复。将经过预处理的玉米、棉花种子各1 000粒按实验设计放置于相应菌液中,在摇床110 r/min下玉米培养48 h、棉花培养24 h,然后用无菌水反复冲洗残留菌液,置于铺有无菌滤纸的培养皿内进行催芽,待芽长1~2 cm时播种于温室营养钵内,钵内为浇有营养液的蛭石。在温室内生长至3~5片叶时进行抗生素涂抹。棉花用3 000 mg/L的卡那霉素筛选,玉米用0.2%Basta除草剂进行筛选。统计加入AS对棉花和玉米转化率的影响。
1.3.4 棉花鉴定抗性植株的筛选时期将经过预处理的棉花种子在制备好的共培养液中进行培养,在摇床110 r/min下培养24 h,卡那霉素设0、100、200、300、400、500 mg/L6个浓度处理,按设计在MS培养基中分别加入相应浓度的卡那霉素,每处理接种50粒棉花种子于黑暗培养,2次重复,7 d后统计发芽率。
2 结果与分析
2.1 针刺与菌液共培养对种子萌发和出苗的影响针刺对种子的胚有伤害作用,因而影响到种子的萌发和出苗率,不同作物种子受针刺后表现也不同。从表1可以看出,针刺与菌液共培养对2种作物种子的萌发影响不大,对2种作物的出苗率有明显抑制作用。其中玉米的出苗率为23%,棉花出苗率略低,为17%,均较正常种子菌液培养降低72百分点。观察发现,针刺与菌液共培养对棉花幼苗的后期生长有明显的影响,表现为幼苗子叶发黄发枯,新叶生长缓慢,植株生长停滞或逐渐死亡,能够正常生长至3~5片叶的幼苗仅占6%。

表1 针刺与菌液共培养对种子发芽数和出苗数的影响
2.2 共培养时间对种子萌发的影响
观察表明,棉花种子与菌液共培养时间不宜超过24 h,共培养时间为48、60 h处理的种子全部返菌霉变,不能萌发。玉米种子与菌液共培养时间不宜超过48 h,共培养时间为60 h时,种子感菌不易控制,导致种子霉烂死亡。过长时间与菌液共培养会使种子腐烂发霉而不能萌发出苗,这是因为液体中菌体太多,需氧量增大,种子萌发所需的关键要素氧气供应不足。
2.3 AS(乙酰丁香酮)对转化率的影响
实验结果(表2)表明,在菌液中加入200μmol/L AS,可以显著提高转化率,得到更多的抗性植株。棉花中加AS处理下获得5株抗性植株,不加AS处理下未获得抗性植株。玉米中加入AS的处理比不加AS处理获得的抗性植株数提高3倍。2.4棉花鉴定抗性植株的筛选时期
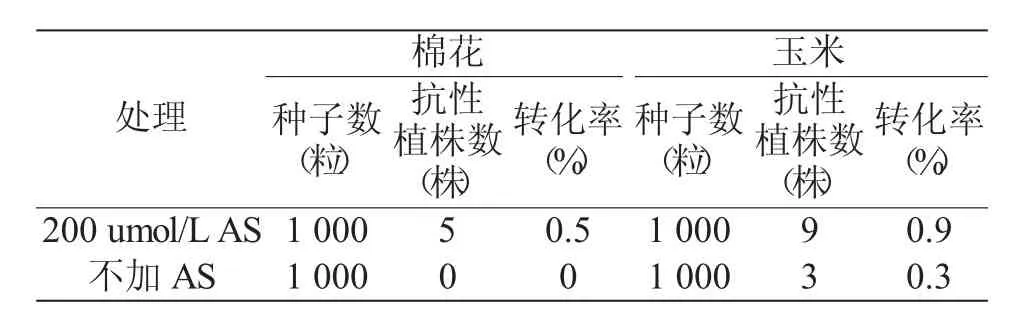
表2 添加AS(乙酰丁香酮)处理的种子转化率
从表3看出,加入不同浓度卡那霉素,棉花种子的发芽率与对照相比无明显差异,均能正常萌发出苗。这与王成杰在小麦非组培转化中的结果一致[9],说明棉花种子与小麦种子一样,在含有抗性筛选素的平板上萌发差异不明显,达不到筛选目的。因此,棉花只能在萌发后苗期及其它生育期进行抗性植株筛选。2.5转化植株检测

表3 不同浓度卡那霉素培养上棉花种子的发芽率
共转化棉花萌动胚3 000个,获得抗性植株17株,经PCR检测未得到阳性植株。共转化玉米萌动胚5 000个,获得抗性植株30株,根据PCR检测结果(图1)获得7株阳性植株,其中添加200 μmol/L AS处理下获得6株,未添加AS处理下获得1株,转化率共计0.14%。

图1 转基因玉米植株PCR检测
3 小结与讨论
1)实验结果表明,针刺对棉花和玉米种子的萌发基本没有影响,但对2种作物的出苗率有明显抑制作用。转化过程中,与菌液共培养的时间因作物品种而异,棉花共培养时间不宜超过24 h,玉米则不宜超过48 h,时间太短使转化效率降低,过长种子易腐烂,移栽后很难成活。经大田筛选及PCR检测,棉花未获得转化植株,玉米获得转化植株共7株,转化率达0.14%,其中加入AS(乙酰丁香酮)的处理下获得6株,不加AS处理下获得1株。此方法操作性强,大大优于愈伤转化,不依赖组培技术,结果稳定,很值得推广。
2)作物种子吸水后,胚内的酶活动加强,呼吸作用骤然上升,糖类、蛋白质以及核酸的合成和转变也迅速地进行。这时的萌动种胚对外界因子的反应十分敏感,胚性细胞开始处于分裂状态,子叶对胚芽的包裹不再严密。此时利用高活力的农杆菌感染处理萌动种胚并进而与之共培养,有利于对种胚生长点的转化,因为宿主细胞DNA的合成和分裂是农杆菌成功转化的一个重要因素。此外萌动种胚的微伤处理不仅利于细菌附着和进入宿主细胞,而且AS可诱导Ti质粒VIR区基因活化[10]。
3)应用农杆菌转化萌动种胚时,划胚技术和工具是关键,需要一定的熟练程度,这样才不至于严重影响划胚种子的萌发和出苗[11]。针刺的深度对转化也有很大影响,过深会使胚丧失活性,而过浅则减少农杆菌感染的机会。不同的种子形状、胚的不同位置、种皮厚薄都影响划胚操作,这些因素的优化还有待进一步试验。
4)虽然这种转化方法具有省时、省工和效率较高等优点,但也存在一些问题。这种方法的转化植株可能是嵌合体,会不会稳定的进行遗传,需要进一步研究。同时这种方法的转化效率相对较低,本研究中棉花没有获得转化植株也表明该方法可能不适用于部分植物,需要继续研究影响转化的因素,提高转化效率[12]。总之,高的转化率得益于农杆菌生物转化、AS的诱导及萌动种胚感受态三者综合作用的结果。
[1]任海红,任小俊,王英,等.非组培遗传转化法在农作物上的应用[J].山西农业科学,2010,38(11):85-88.
[2]许耀,王艇,李宝健.根癌农杆菌介导的外源基因转化植物萌动种胚的研究[J].实验生物学报,1991,24(2):109-114.
[3]杨剑波,许智宏,卫志明,等.影响根癌农杆菌附着禾谷类作物培养细胞的因素[J].实验生物学报,1993,26(1):1-6.
[4]SMITH R,HOOD EE.Agrobacterium tumefaciens transformation of monocotyledons[J].Crop Science,1995,35:301-309.
[5]邓艺,曾炳山,赵思东,等.乙酰丁香酮在农杆菌介导的遗传转化中的作用机制及应用[J].安徽农业科学,2010,38(5):2 229-2 232
[6]孙毅,王景雪,刘少翔,等.农杆菌介导植物萌发种子基因转化方法:中国,01104185[P].2001-07-11.
[7]梁雪莲.农杆菌组培及三种非组培法在小麦和玉米上转化外源Bar基因研究[D].晋中:山西农业大学,2002.
[8]李忠旺,厚毅清,石有太,等.棉花基因组DNA快速提取方法改良[J].甘肃农业科技,2012(4):11-14.
[9]王成杰.农杆菌介导小麦非组培转化方法的探讨[D].北京:中国农业大学,2004.
[10]杨云霞.小麦农杆菌介导不同遗传转化体系的建立及比较研究[D].北京:中国农业科学院,2005.
[11]杜建中,孙毅,郝曜山,等.非组培转化法获得转基因植株及其Basta耐受性研究[J].西北植物学报,2012,32(2):231-240.
[12]王昌涛,赵玉锦,李坤远,等.农杆菌介导玉米萌动胚遗传转化新体系的建立[J].华北农学报,2007,22(5):110-113.
(本文责编:陈伟)
Exploration of the Non-tissue Culture Methods By Agrobacterium-mediated in Cotton and Corn
LIU Xin-xing,LUO Jun-jie,CHEN Yu-liang,CHEN Zi-xuan,PEI Huai-di,LI Zhong-wang
(Institute of Biotechnology,Gansu Academy of Agriculture Sciences,Lanzhou Gansu 730070,China)
We use a new genetic transformation method by agrobacterium-mediated in germinating embryo of cotton and corn intentioned with Sunyi,to explorated and researched of non-tissue culture transformation.The results shows that the acupuncture has no effect on cotton and corn seed germination,but the germination rate was significantly inhibited in two crops.In transformation process,the co-cultivation timein cotton should not exceed a total of 24 hours,corn should not exceed 48 hours;After field screening and PCR testing,the cotton have not got transformed plants,the corn obtained seven and the conversion rate was 1.4%,in which have six under added AS(acetosyringone)treatment,have one without AS treatment.
Non-tissue culture;Agrobacterium-mediation;Conversion rate;Cotton;Corn
Q781
A
1001-1463(2014)11-0011-04
10.3969/j.issn.1001-1463.2014.11.004
2014-10-10
甘肃省农业科学院农业科技创新专项(2012GAAS15-6;2012GAAS12-2)部分内容
刘新星(1986—),女,甘肃平凉人,研究实习员,主要从事作物生理生态与生物技术研究。联系电话:(0931)7612683。E-mail:lxx19860621@163.com
罗俊杰(1962—),男,陕西华县人,研究员,主要从事作物生理生态与培育工作。E-mail:hnsljjie@163.com
