两种稀释液在高精子密度精液分析中的比较应用
2014-02-07谢杏仪方健源何琨仪何思华陈顺仪
谢杏仪,方健源,何琨仪,何思华,陈顺仪
(广州市番禺区中心医院检验科,广东广州511400)
两种稀释液在高精子密度精液分析中的比较应用
谢杏仪,方健源,何琨仪,何思华,陈顺仪
(广州市番禺区中心医院检验科,广东广州511400)
目的探讨原装稀释液和生理盐水作为精子稀释液在高精子密度精液常规分析中的比较应用。方法对88例高密度精液(不液化标本12例,液化密标本76例)标本先取原液粗略估计精子密度,再根据密度大小决定其稀释倍数,分别用生理盐水及原装稀释液对同份精液标本进行稀释后用计算机辅助分析(CASA)系统分析其密度、活力。结果原液的密度、活力明显低于生理盐水(P<0.05)和原装稀释液(P<0.05)的密度与活力,两种稀释液的密度和活力相近(P>0.05);对不液化精液标本未加糜蛋白酶的原液精子密度和活力明显低于加糜蛋白酶后用生理盐水和原装稀释液稀释的精子密度和活力(P<0.05),而加糜蛋白酶后用两种稀释液的精子密度和活力则较为相近(P>0.05)。结论做精液常规分析时,高密度的精液可用生理盐水代替原装稀释液应用于检测。
原装稀释液;生理盐水;精液常规分析
精液常规分析是男性生育能力最常用、最基本的检查方法,精子计数是常规检查的要素之一。人工分析由于其分析效率低,易受检查者技术熟练程度和主观因素的影响,已普遍被计算机辅助分析(computer-aided sperm analysis,CASA)取代。CASA尽管具有检测简单快捷、客观精确、能提供精子动力学的量化数据等优点而得以广泛应用,但当精子密度高时,如直接用CASA分析精液原液,可能会因为精子间或精子与非精子物质间的碰撞频率增加[1],系统不易识别精子与非精子及精子的活动级别,导致产生与被检者精液质量不相符的检验结果。本实验用生理盐水稀释液与原装稀释液分别对高密度精液进行稀释后检测,比较两种稀释液的稀释效果,决定生理盐水是否能取代原装稀释液作为一种新的精子稀释液。
1 材料与方法
1.1 标本来源2012年6月至2012年11月于番禺区中心医院进行精液常规检查的8例门诊病人,所有标本均符合要求,即病人禁欲2~5d用手淫法将一次射出的全部精液收入干净的容器内立即送检[2],放于37oC恒温台保温,观察其液化情况。
1.2 仪器和试剂西班牙SCA精子质量分析系统、显微镜(Olympus CX21),加样枪、恒温台(YOUNING-2000 SCA型)、精液分析标准玻片、原装稀释液、生理盐水、精液采集器(美国Falcon)、5ml滴管、玻片、糜蛋白酶(上海第一生化)。
1.3 方法(1)每天收取4例符合要求的高密度精液标本(密度>50×106/ml),轻轻震摇精液,立即置于恒温台上保温,记录其一般性状(外观、总量、pH、液化时间、黏稠度、凝集程度、有无白细胞及红细胞)。(2)待精液完全液化后(1h不完全液化的标本可加入糜蛋白酶使其液化),混匀,用5ml滴管取少量于干净玻片上,盖上盖玻片镜检,粗略估算精子密度以决定其稀释倍数。先用精子质量分析仪直接对原液充池进行分析,记录其密度、活力及活率。再分别用原装稀释液和生理盐水对同一份标本稀释同等比例后进行分析其密度、活力及活率。每份标本重复分析两次,取平均值。
1.4 统计学处理采用SPSS 17.0软件对数据进行配对t检验分析,以P<0.05为差异有统计学意义。
2 结果
2.1 高密度精液标本通过CASA分析,原液的密度、活力明显低于生理盐水(P<0.05)和原装稀释液(P<0.05)的密度与活力,差异有统计学意义;生理盐水与原装稀释液的密度与活力较相近,(P>0.05)。结果见表1。

表1 CASA分析高密度精液原液、生理盐水、原装稀释液的密度(x±s,×106/ml)、活力(x±s,%)
2.2 不液化精液标本分析结果见表2,可见未加糜蛋白酶的原液精子密度和活力明显低于加糜蛋白酶后用生理盐水和原装稀释液稀释的精子密度和活力(P<0.05),而加糜蛋白酶后用两种稀释液的精子密度和活力则较为相近(P>0.05)。
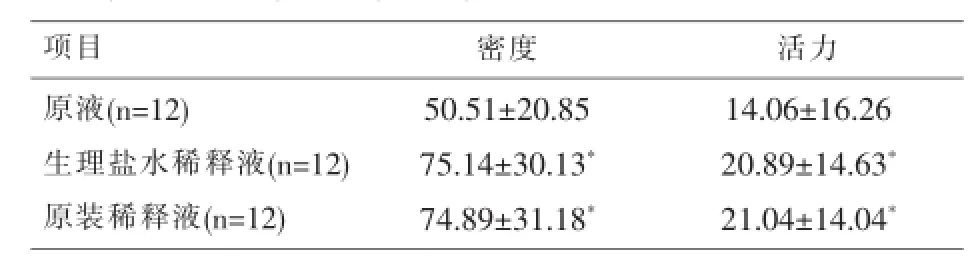
表2 CASA分析不液化精液原液、生理盐水、原装稀释液的密度(x±s,×106/ml)、活力(x±s,%)
3 讨论
传统使用显微镜直接目测精子密度和精子活动率,此种方法分析结果相差大,重复性差,且对精子运动能力的判断缺少严格的量化指标[2]。CASA系统分析是将精液标本通过测定精子运动的吸光度变化,精子形态图像和运动图像放大后被摄像送入图像分析系统,经计算机适时动态分析处理,自动得到精子密度、活力、活率,并能对精子的运动轨迹特征进行分析和分类统计[3]。现今,在运用CASA系统分析精液常规时,对高密度精子予以稀释后再分析已普遍被各实验室应用,但就何种稀释液最能得出于患者精子质量相符的检查结果,尚无统一定论[4]。WHO曾推荐用Dulbecco磷酸盐-葡萄糖-牛血清白蛋白溶液作为稀释液,但有文献报道,用培养液作为稀释液稀释后的精子活力远远好于用患者自体精浆作为稀释液稀释后的精子活力[5]。
现我院使用的原装稀释液为CASA系统公司提供的一种原装配套稀释液,此种稀释液稀释效果佳,但费用昂贵,且不易保存,很容易滋生细菌污染造成浪费,考虑及此,我们尝试用生理盐水作为精子稀释液来探讨其在高密度精液分析中的应用。从试验结果表明:原液的密度明显低于生理盐水稀释液及原装稀释液的密度,差异有统计学意义,可能为精子密度高时,精子间互相挤压重叠而影响计数,这与文献报道的不一致[4],故在对高密度精子进行分析时,需对精液进行稀释后再行检测;生理盐水稀释液的密度及原装稀释液的密度相近,差异无统计学意义。本试验结果也显示,原液的活力均低于原装稀释液和生理盐水稀释后的活力,而用原装稀释液的活力则较生理盐水的活力稍高,可能与原装稀释液的营养较高,能为精子提供能量有关,但两者无统计学差异。对于液化异常(60min液化不完全)的精液标本可用糜蛋白酶加速其液化后,有助于提高精子计数的准确性。试验结果表明,经糜蛋白酶处理后的精液用两种稀释液稀释后的密度与活力均有所提高,两者无统计学差异。文献报道[6]该类标本中由于缺少糜蛋白样酶导致精液液化异常,学者潘天明等也主张用糜蛋白酶稀释高密度精液[7]。
综上所述,用CASA分析高密度精液时,生理盐水可代替原装稀释液,且因其稳定、廉价易得等优点,可广泛应用于临床。
[1]世界卫生组织.人类精液及精子-宫颈黏液相互作用实验室检验手册[M].第4版.北京:人民卫生出版社,2001:82.
[2]熊立凡,刘成玉.临床检验基础[M].第4版.北京:人民卫生出版社,2007:239.
[3]姜建平,郑为平,马锦洪.计算机辅助精液分析系统与人工检测精液结果比较[J].中国男科学杂志,2004,10(8):634-635.
[4]叶明桃,曹云霞.两种稀释液在精液常规分析中的比较应用[J].中国优生与遗传杂志,2008,16(2):110-113.
[5]Farrell PB,Foote RH,McArdle MM,et al.Media and dilution procedures tested to minimize handing effects on human,rabit and bull sperm for computer-assisted sperm analysis(CASA)[J].J Androl,1996,17:293-300.
[6]徐福松,高鸿程.男性病治疗[M].南京:江苏科学技术出版社,199: 141-144.
[7]潘天明,朱积川,李江源.男科实验室诊断技术[M].北京:人民军医出版社,2006:44-82.
R446.19
A
1674-1129(2014)04-0438-02
10.3969/j.issn.1674-1129.2014.04.026
2014-06-03;
2014-06-30)
