血管内皮细胞生长因子受体-2及微血管密度在大肠癌组织中的表达及意义
2014-02-07罗爱华
李 欣 罗爱华
(湖北省宜昌市第二人民医院肿瘤内科,宜昌市 443000)
大肠癌是常见于临床的恶性肿瘤[1],其生长和转移均需要生成新的血管,以供肿瘤循环。新血管生成依赖促血管生成因子和抑血管生成因子的调节。VEGFR-2是促血管生成因子的重要功能受体,具有介导血管内皮生长因子、增加血管内皮细胞和血管通透性的作用[12]。MVD能够反映肿瘤组织中血管的生成状况,是重要参数之一[3]。VEGFR-2和MVD与多种恶性肿瘤的发生、发展以及转移密切相关[4,5]。我院于2010年1月至2013年1月对36例大肠癌患者取癌变组织和癌旁正常组织检测VEGFR-2和MVD的表达,分析二者与大肠癌生长和转移的关系,现报告如下。
1 资料和方法
1.1 一般资料 选择我院收治的大肠癌患者36例,所有患者均符合大肠癌诊断标准[6],且经病理诊断证实。其中男24例,女12例,年龄37~86岁,平均(51.7±5.8)岁,术前均未进行放、化疗。肿瘤部位:直肠18例,乙状结肠10例,降结肠4例,升结肠3例,横结肠1例。组织学分化:低分化12例(33.3%),中分化10例(27.8%),高分化14例(38.9%)。肿瘤直径:大于5 cm者14例(38.9%),小于5 cm者22例(61.1%)。TNM分期:Ⅰ期5例(13.9%),Ⅱ期13例(36.1%),Ⅲ期10例(27.8%),Ⅳ期8例(22.2%)。
1.2 方法 取患者大肠癌组织作为观察组,同一患者癌旁正常组织作为对照组。所有组织标本均采用10%福尔马林固定,并用石蜡包埋,制作若干切片,采用免疫组化S-P法(试剂盒源自美国Santa公司)染色。每例标本选取4张切片,采用免疫组化IHC(来源同上)染色。加一抗:抗VEGFR-2抗体(源自北京博奥森生物技术公司)和抗CD34抗体(来源同上),严格按照试剂盒说明操作。
1.3 观察内容 根据Saito综合计分法计算VEGFR-2 表达[7]:阴性:0~1分;阳性:≥2分。计算阳性率。MVD计数方法[8]:先在低倍镜下(×100)观察确定数目最高区,再在高倍镜下(×200)计数5个视野内微血管数目,其平均值为该切片MVD值。
1.4 统计学分析 采用SPSS 16.0软件对数据进行分析,计量资料采用均数±标准差(x±s)表示,比较采用t检验,计数资料采用百分比表示,比较采用χ2检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1 VEGFR-2表达和MVD计数 VEGFR-2在癌变组织中的阳性表达率58.3%(21/36),显著高于正常组织 22.2%(8/36),MVD在癌变组织中的计数(28.6±9.4)个/HP,显著高于正常组织(10.5±3.9)个/HP,差异均具有统计学意义(P<0.05),见表1。
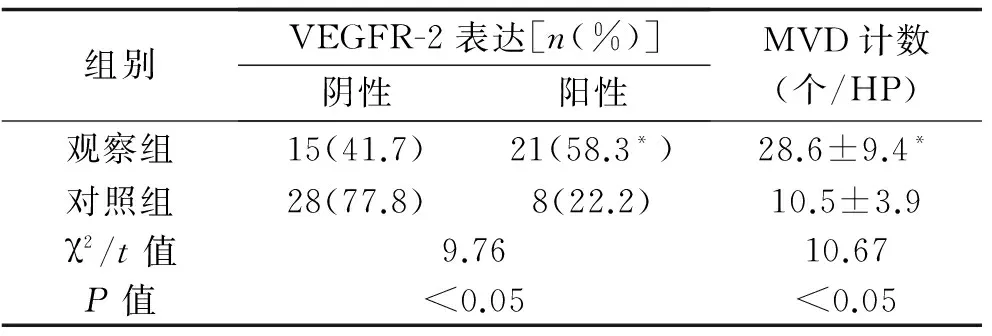
表1 VEGFR-2表达和MVD计数
注:与对照组比较,*P<0.05。
2.2 VEGFR-2表达和临床病理特征的关系 VEGFR-2在癌变组织中的阳性表达与浸润深度增加、远处转移和淋巴转移显著相关,差异均具有统计学意义(P<0.05),见表2。

表2 VEGFR-2表达和临床病理特征的关系 [n(%)]

组织学分化低(n=12)高(n=24)淋巴转移有(n=17)无(n=19)远处转移有(n=8)无(n=28)VEGFR-2阳性5(13.9)16(86.1)13(76.5#)8(23.5)8(100.0△)8(23.5)χ2值2.064.367.35P值>0.05<0.05<0.05
注:与浸润深度少者(T1+T2+T3)比较,*P<0.05;与无淋巴转移者比较,#P<0.05;与无远处转移者比较,△P<0.05。
2.3 MVD计数和临床病理特征的关系 MVD计数在癌变组织中的个数与组织学分化低、浸润深度增加、远处转移和淋巴转移显著相关,差异均具有统计学意义(均P<0.05),见表3。

表3 MVD计数和临床病理特征的关系 [个/HP]

组织学分化低(n=12)高(n=24)淋巴转移有(n=17)无(n=19)远处转移有(n=8)无(n=28)MVD数目35.4±7.4*26.6±9.037.4±8.1△24.6±5.048.7±6.9▲27.3±7.7t值4.925.777.08P值<0.05<0.05<0.05
注:与组织分化高者比较,*P<0.05;与浸润深者(T4)比较,#P<0.05;与无淋巴转移者比较,△P<0.05;与无远处转移者比较,▲P<0.05。
3 讨 论
大肠癌是临床常见的消化道肿瘤,随着医学研究的深入,对大肠癌的病理机制、癌变进展、浸润过程和预后已经有了进一步了解。肿瘤血管生成指的是肿瘤内新生长形成的血管,包括微血管前期到毛细血管形成新血管结构[9]。癌细胞生长到1~2 mm的球状结构时,需要更多营养物质并排出废物,若缺乏血供,则无法继续生长。因此,肿瘤的新生血管可以供肿瘤营养和气体交换等[10]。近年来,诸多临床研究认为[11],肿瘤的新生血管是癌变进展、浸润渐深和肿瘤转移的关键因素。肿瘤通过释放血管生成刺激因子诱导新生血管,如VEGF、碱性成纤维细胞生长因子(bFGF)和血小板内皮细胞生长因子(PDECGF)等。
无论是病理组织还是正常组织中,VEGF均是新血管生成的主要调节因子,并通过与VEGFR的结合发挥生物学效应。VEGFR的主要表达场所是血管内皮细胞[12]。目前,VEGFR-2在大肠癌中表达的研究较少且无一致结论。但对其他系统肿瘤的研究发现,VEGFR-2在肿瘤组织中的阳性表达率升高,且与淋巴结转移密切相关[13]。说明转染了VEGF的肿瘤组织生长迅速,且容易形成比正常组织更多的血管异种移植体。本研究纳入36例大肠癌患者,取癌变组织和正常组织进行VEGFR-2表达和与病理特征关系分析,结果表明,VEGFR-2在癌变组织中的阳性表达率显著高于正常组织,说明VEGFR-2在肿瘤新血管生成中具有重要调节作用,进而在大肠癌的进展和预后中发挥作用。浸润深度深和淋巴转移及远处转移者中,VEGFR-2的表达显著高于浸润深度浅和尚无转移者,说明VEGFR-2的表达和大肠癌浸润和转移关系密切,可能是大肠癌的恶性表型。此外,有研究表明低分化大肠癌中VEGFR-2表达显著更高[14]。但本研究发现,VEGFR-2的表达与组织分化程度无关,这可能是由于本研究样本小,且纳入患者高分化者居多,这需更大样本研究进一步证实。血管生成素-2(Ang-2)也是近年来发现的生成促进因子,大肠癌组织中Ang-2高表达与VEGFR-2高表达具有相关性[15],二者升高均与大肠癌的进展相关。
CD34是血管内皮细胞的最佳标记抗原之一,通过计算MVD,分析各种血管形成刺激因子的表达,可量化血管生成。有研究认为,CD34抗体染色的血管可能是真正的肿瘤新生血管。本研究结果表明,MVD在癌变组织中的计数显著高于正常组织,说明肿瘤组织中的确存在更多的新血管。此外,分化程度低、浸润深度深、淋巴转移及远处转移者中,MVD计数显著高于分化程度高、浸润深度浅和无转移的组织。说明MVD可以反映大肠癌的病变程度、浸润深度和是否转移,可作为衡量指标之一。有研究显示,VEGFR-2表达阳性的大肠癌组织中MVD值显著高于VEGFR-2表达阴性者[16]。当VEGFR-2表达增强时,MVD值随之升高,说明VEGFR-2表达强度和MVD值正相关。本研究并未做此研究,但也可证明VEGFR-2是大肠癌微血管生成的重要因子,而MVD值的增加为大肠癌组织的生长提供了养分,并为大肠癌的浸润及转移提供了渠道。
[1] 崔长富,王 玲,李 园,等.大肠癌中Caspase-8和Caspase-10的表达及其与细胞凋亡的关系[J].中华实验外科杂志,2010,27(1):56-58,后插1.
[2] 张艳辉,刁 磊,杨 庆,等.血管内皮生长因子受体2和血管内皮生长因子受体3的表达与肾乳头状癌生物学行为密切相关[J].中华肿瘤杂志,2010,32(10):752-756.
[3] 张艳辉,杨 庆,崔 巍,等.不同亚型肾细胞癌的微血管密度与临床病理因素的关系[J].中华肿瘤杂志,2010,32(2):117-122.
[4] 邓 东,杨新官,张小波,等.16层螺旋CT灌注成像强化指标和肿瘤微血管密度与肺癌淋巴结转移的关系[J].中华放射学杂志,2010,44(1):24-28.
[5] 张建平,胡三元,倪家连,等.原发性肝细胞癌以及近癌旁组织微血管密度CD105表达及其临床意义[J].中华肝胆外科杂志,2011,17(12):978-981.
[6] 中华医学会外科学分会胃肠外科学组,中华医学会外科学分会结直肠肛门外科学组,中国抗癌协会大肠癌专业委员会,等.结直肠癌肝转移诊断和综合治疗指南(V 2010)[J].中华胃肠外科杂志,2010,13(6):457-470.
[7] 孟庆雯,李 勇,胡宝山,等.血清VEGFR-2浓度预测行肝动脉化疗栓塞肝癌患者的预后[J].中华医学杂志,2013,93(5):341-344.
[8] 薛 康,钱 江,毕颖文,等.综合治疗前后视网膜母细胞瘤微血管密度和血管内皮生长因子表达研究[J].中华眼底病杂志,2011,27(1):12-16.
[9] 刘文静,马 杰,李 克,等.大肠癌组织c-Met和VEGF表达及其与微血管密度关系的初步研究[J].中华肿瘤防治杂志,2012,19(15):1159-1161.
[10] 孙方利,付信娟,孙文琴,等.良恶性大肠肿瘤组织血管内皮生长因子表达与意义[J].中华肿瘤防治杂志,2010,17(21):1758-1760.
[11] 王晓蕾,艾自胜,方建萍,等.胃癌组织中血管内皮生长因子的表达对血管和淋巴管生成的影响及其预后意义[J].中华肿瘤杂志,2008,30(11):837-843.
[12] 曾俊权.血管内皮生长因子C及其受体在血液肿瘤中的研究进展[J].实用肿瘤杂志,2011,26(1):80-82.
[13] 贺建业,吴庆华,伍冀湘,等.乳腺癌相关淋巴水肿与VEGF-C及VEGFR-3的关系[J].中华普通外科杂志,2009,24(11):900-903.
[14] 李光明,范跃祖.大肠癌组织淋巴管生成与淋巴转移相关性的研究[J].中华肿瘤防治杂志,2008,15(3):202-205.
[15] 冯 曼,高志芹,冯 昌,等.促血管生成素在大肠癌组织的表达及其临床病理意义[J].临床肿瘤学杂志,2010,15(9):785-788.
[16] 刘新兰,段 瑜,魏建敏,等.VEGFR-2、MVD在大肠癌组织的表达及其临床意义[J].现代肿瘤医学,2013,21(5):1059-1062.
