基于ITS序列的菊花花枯病实时荧光PCR检测方法
2014-02-06陈吴健张明哲林晓佳吴志毅吴旭耀
陈吴健,张明哲,林晓佳,吴 蓉,吴志毅,陈 曦,武 扬,吴旭耀
(1.浙江出入境检验检疫局,浙江杭州 310016;2.杭州出入境检验检疫局,浙江杭州 310012)
基于ITS序列的菊花花枯病实时荧光PCR检测方法
陈吴健1,张明哲1,林晓佳1,吴 蓉2,吴志毅1,陈 曦1,武 扬1,吴旭耀1
(1.浙江出入境检验检疫局,浙江杭州 310016;2.杭州出入境检验检疫局,浙江杭州 310012)
根据菊花花枯病菌与其近似种在ITS序列上的差异,构建特异性引物和探针,并用菊花上常见的病害及其近似种进行验证。结果表明,供试菌株中仅菊花花枯病菌表现出阳性扩增信号,其他菌株和空白对照均未检测到荧光信号。该法可检测到100 fg的阳性DNA,完成整个检测只需约2 h,可快速、灵敏地完成进出境菊花产品中菊花花枯病菌的检测。
菊花花枯病;实时荧光PCR;特异性检测
菊花花枯病(Didymella ligulicola)是菊花上的重要病害,1982年被列入EPPO(欧洲和地中海植物保护组织)检疫性有害生物A2名单中,属于我国的检疫性病害。1904年该病在美国北卡罗那州首先发现并报道;随着菊花切花和盆栽菊花的大量生产,为害日益严重,英、德、荷兰、丹麦、加拿大、肯尼亚、坦桑尼亚、日本、澳大利亚、新西兰等国均有发生,我国目前尚无发生报道[1]。
该病对环境适应能力很强,可在各种恶劣的自然条件下发生,尤其在温室中常年都可发病。因此该病一旦定殖,将会对我国的菊花产业带来毁灭性的打击,即使花费大量的人力和财力,也很难得到根治。鉴于该病危害性严重,适应性强,且我国尚无分布,因此加强检疫是防止该病传入我国的首要手段。但由于切花产品的特殊性,检疫周期的长短直接影响着切花产品的品质,传统的检疫手段耗时长,难度大,且无法从无症状植株上检出该病,因此筛选出适宜、准确、快速的检疫鉴定方法,已成为我国菊花生产及菊花商品进出境亟待解决的问题。
本研究根据菊花花枯病菌与其近似种在ITS序列上的差异,设计了特异性的引物和TaqMan-MGB探针,将实时荧光PCR方法运用于菊花花枯病菌的检测,现将结果报告如下。
1 材料和方法
1.1 供试菌株
取菊花常见病害及其近似菌株进行试验。标准菌株Didymella ligulicola从CABI购买;番茄亚隔孢菌从ATCC购买,其余供试菌株均为本实验室分离鉴定(表1)。

表1 供试菌株的学名及其寄主
1.2 通用引物和扩增程序
课题组根据标准菌株提取DNA,用真菌通用引物ITS4和ITS5扩增ITS序列,由大连宝生物技术有限公司合成(ITS4:5'-TCCTCCGCTTATTGATATGC-3';ITS5:5'-GGAAGTAAAAGTCGTAACAA-GG-3')。扩增程序为:96℃热变性3 min;进行35个循环,每个循环94℃1 min,55℃1 min,72℃2 min,最后72℃延伸7 min[2]。
1.3 特异性引物、探针的设计
基于真菌rDNA存在着广泛的保守区域,可用作引物的结合位点,同时存在不同区域进化水平不同的特性,选取菊花花枯病菌rDNA的内转录间隔区(internal transcribed spacer,ITS)序列,运用NCBI数据库信息和DNASTAR软件的序列比较分析功能,结合PCR引物、探针设计的原则,设计具有菊花花枯病菌特异性的实时荧光PCR引物和探针。
1.4 样品制备
取健康菊花叶片表面洗净后,分别接种菊花黑斑病病原细极链格孢(Alternaria tenuissima)和链格孢(A.alternata),灰霉病病原灰葡萄孢(Botrytis cinerea),白锈病病原堀柄锈菌(Puccinia horiana),菊花花枯病菌(D.ligulicola),25℃保湿培养24 h后,取叶片提取DNA[3]。
1.5 菌株和样品DNA提取
供试菌株在PDA上培养后,刮取菌丝,液氮研磨后,取0.1~0.2 g备用;剪取有病斑的菊花叶片组织,液氮充分研磨,取0.1~0.2 g,用PROMEGA试剂盒提取DNA。
1.6 实时荧光PCR扩增
PCR试剂均购自宝生物工程(大连)有限公司。反应体系为20μL,包括10μL 2×Premix Ex Taq、上下游引物(5μmol·L-1)各0.4μL和探针(5μmol·L-1)0.8μL,2μL模板DNA、0.4μL 50×ROX Reference DyeⅡ,加无菌水6μL补至20μL。
实时荧光PCR检测使用仪器为App lied Biosystems的7500 Fast Real-time PCR System。扩增反应条件为:50℃预热2 min;95℃变性10 min;95℃15 s,60℃1 min,40个循环。
2 结果与分析
2.1 引物和探针
通过Genbank,blast比对,寻找同属近似种的差异位点,设计特异性引物DL1和DL2,探针Probe-DL,由于涉及到专利和知识产权保护,引物和探针序列在本文中不公开。
2.2 方法特异性检测
用表1中的菌株对设计的引物和探针进行特异性检测,结果如图1所示。只有菊花花枯病菌有阳性扩增,荧光信号以指数形式增长,其他菌株均未检测到荧光信号。说明设计的引物和探针对菊花花枯病具有很好的特异性。

图1 方法特异性的检测结果
2.3 方法灵敏度验证
将标准菌株DNA测定浓度后,按梯度稀释为1~6个不同浓度,分别取含有1 ng,100 pg,10 pg,1 pg,100 fg和10 fg的菌丝DNA用于实时荧光PCR检测,结果显示,1~5梯度的菌丝DNA均能检测到扩增的荧光信号,表现为阳性扩增,10 fg的菌丝DNA和阴性对照未检测到扩增信号(图2)。
结果表明该检测方法的检测灵敏度达到100 fg的菌丝DNA。
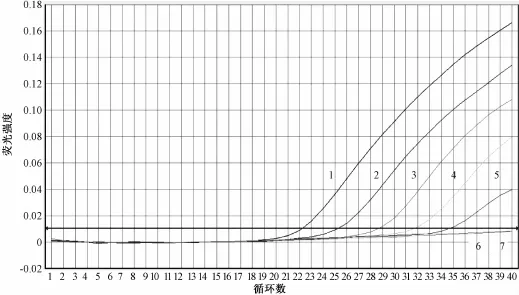
图2 方法灵敏度的检测结果
2.4 菊花样品的检测
将1.4节中制备的样品DNA进行实时荧光PCR检测,标准菌株作为阳性对照,健康的菊花叶片作为阴性对照。结果表明,阳性对照和接种菊花花枯病菌的样品可见阳性扩增曲线,接种其他菌株的样品和阴性对照无扩增信号。说明该法不仅可用来鉴定菊花花枯病菌菌株,也可用于检测进出境菊花产品中是否携带菊花花枯病菌(图3)。

图3 菊花样品的检测结果
3 小结和讨论
菊花花枯病菌是菊花的毁灭性病害,该病主要侵染菊花花冠,流行快,几天内可使花冠完全腐烂;也可使切花在运销过程中大量落花,给商品菊花造成很大的损失。据报道,1975年该病造成了康涅狄格州温室商品菊花50%以上的损失[4]。为保护菊花产业的健康发展,我国将菊花花枯病菌列入进境检疫性有害生物名录,用检疫手段严防其传入。
目前,传统的形态学检疫方法周期长、难度大,已无法满足当今进出口贸易的实际需求,特别是鲜切花产品,因此分子生物学方法正在被越来越多地应用到进出口植物检疫中。PCR、实时荧光PCR等技术在油菜茎基溃疡病、苜蓿黄萎病菌、油棕猝倒病菌等检疫性真菌病害的鉴定中已得到广泛应用[5-7],大幅降低了一线检疫人员的工作强度,缩短了检测周期,提高了检出率。
本研究采用标准菌株,通过对其ITS区序列特征的研究,首次建立了菊花花枯病菌的实时荧光PCR特异性检测方法,并通过样品的验证表明,该方法快捷、灵敏度高、特异性强,能够检测到100 fg以上的菊花花枯病DNA样本,整个检测过程为2 h左右,能满足进出境菊花及菊花产品快速通关的要求。
[1] 朱培良,葛起新.一种危险性病害-菊花疫病[J].植物检疫,1987,1(4):298-301.
[2] 叶云峰,付岗,刘威,等.猫豆炭疽病病原分离与鉴定[J].植物保护,2013,39(1):97-98.
[3] 方中达.植病研究方法[M].北京:中国农业出版社,1998.
[4] Pethybridge S J,Hay F S.Influence of Phoma ligulicola on yield and site factors on disease development in Tasmanian pyrethrum crops[J].Australasian Plant Pathology,2001,30(1):17–20.
[5] 周国梁,尚琳琳,林泓,等.油菜茎基溃疡病菌的实时荧光PCR检测[J].植物病理学报,2011,41(1):10-17.
[6] 杜洪忠,吴品珊,严进.苜蓿黄萎病菌实时荧光PCR检测方法[J].植物检疫,2011,25(2):45-47.
[7] 张慧丽,王建峰,段维军,等.油棕猝倒病菌实时荧光PCR检测方法[J].植物保护,2012,38(6):98-100.
(责任编辑:张瑞麟)
S 432.44
B
0528-9017(2014)11-1695-04
文献著录格式:陈吴健,张明哲,林晓佳,等.基于ITS序列的菊花花枯病实时荧光PCR检测方法[J].浙江农业科学,2014(11):1695-1698.
2014-06-24
浙江检疫局重点科技项目(2013ZKZ04);浙江检疫局科技项目(ZK201110)
陈吴健(1983-),男,农艺师,研究方向为植物病菌真菌、线虫的检疫鉴定。E-mail:cw j@ziq.gov.cn。
