人脂肪来源干细胞与膀胱脱细胞基质-丝素蛋白双层支架的生物相容性研究
2014-02-05吴稼晟张明孙康卢慕峻
赵 阳 吴稼晟 周 哲 周 娟 张明 李 伟 王 忠 孙康 卢慕峻
人脂肪来源干细胞与膀胱脱细胞基质-丝素蛋白双层支架的生物相容性研究
赵 阳 吴稼晟 周 哲 周 娟 张明 李 伟 王 忠 孙康 卢慕峻
目的观察人脂肪来源干细胞(Human adipose derived stem cells,hASCs)在膀胱黏膜下脱细胞基质-丝素蛋白(Bladder acellular matrix graft-silk fibroin,BAMG-SF)双层支架材料中的生长情况,分析其生物相容性。方法取hASCs,置于BAMG-SF浸提液中培养,CCK-8法检测其细胞活力,评价BAMG-SF支架的细胞毒性并绘制生长曲线。扫描电镜观察BAMG-SF双层支架材料的表面形貌。将hASCs传代扩增后接种到BAMG-SF双层支架材料上,体外培养1周后,转至裸鼠皮下培养1周、2周,HE染色观察细胞在支架上的生长情况。HLA免疫荧光鉴定裸鼠皮下双层支架上细胞的种属来源。结果hASCs在BAMG-SF双层支架浸提液中可保持较高的增殖率,根据细胞相对增殖率与细胞毒性分级关系证实BAMG-SF双层支架浸提液无细胞毒性。由hASCs在BAMG-SF浸提液和DMEM培养基中的生长曲线可知,BAMG-SF有利于hASCs的生长。将hASCs接种到BAMG-SF双层支架材料上,经过体外、内培养,hASCs均能长入支架的空隙内,且体内培养比体外培养有更多的hASCs细胞长入支架。HLA检测显示支架内细胞部分为hASCs。结论新型BAMG-SF双层支架材料安全无毒,与hASCs生物相容性好,可作为细胞载体应用于组织工程膀胱的研究。
人脂肪来源干细胞膀胱黏膜下脱细胞基质丝素蛋白双层支架材料组织工程
膀胱大面积缺损的修复一直是临床面临的难题。利用胃肠道替代膀胱是目前最常用的方法,但存在着慢性尿路感染、结石、穿孔、尿瘘、电解质紊乱,以及继发肿瘤等诸多并发症。组织工程技术为膀胱修复与重建开辟了一条崭新的途径,利用组织工程技术修复大面积膀胱缺损已成为新的研究热点[1-3]。人脂肪来源干细胞(Human adipose derived stem cells,hASCs)来源丰富,取材方便,具有多向分化潜能,可作为种子细胞进行膀胱修复,研究潜能巨大[4-5]。膀胱黏膜下脱细胞基质(Bladder acellular matrix graft,BAMG)是将同种或异种膀胱组织去除细胞,抗原等成分,仅保留细胞外基质成分,因来源于膀胱组织,与人膀胱组织结构最接近,生物相容好,具有修复膀胱组织的独特优势,是较为理想的天然生物支架[6-8]。丝素蛋白(Silk fibroin,SF)由蚕茧缫丝脱胶得到,来源丰富,是一种无生理活性的天然结构性蛋白[9]。丝素蛋白有良好的生物相容性,无毒,无刺激性,可部分生物降解,其降解产物对组织无毒副作用,丝素本身具有良好的机械性能和理化性质,如良好的柔韧性和抗拉伸强度、透气透湿性、缓释性等,而且经过不同处理可以得到不同的形态,如纤维、溶液、粉、膜以及凝胶等[10-11]。
本实验将hASCs置于BAMG-SF浸提液中培养,检测BAMG-SF的细胞毒性,并将hASCs种植于BAMG-SF支架上,进行体外、体内培养,观察细胞生长情况,探讨BAMG-SF作为hASCs的支架材料用于组织工程膀胱缺损修复的可行性。
1 材料与方法
1.1 材料
hASCs取自我院整复外科抽脂术后废弃的人脂肪组织(获患者知情同意)。BAMG由猪膀胱经实验室处理后获得,BAMG+SF由上海交通大学材料科学与工程学院制作并提供。兔抗人HLA抗体(Abcam公司,美国)。
1.2 方法
1.2.1 hASCs的分离培养
将获取的人脂肪组织用PBS冲洗3遍,洗去其中的血液和肿胀液。加入等体积的0.1%胶原酶Ⅳ,37℃恒温振荡消化1 h,1 500 r/min离心5 min,去除悬浮的脂肪和上清液。加入含10%胎牛血清的低糖DMEM培养基,将细胞重悬。置于37℃含5%CO2的培养箱中进行培养。48 h后首次更换培养液,以后每3天换液1次。待细胞生长融合达80%~90%后,0.25%胰酶-EDTA消化,按1∶3进行传代培养。
1.2.2 BAMG-SF双层支架的制备及扫描电镜观察
将制备的BAMG剪成15 mm×15 mm的小块,去离子水洗涤10余遍后,均匀铺在模具底部,将350 μL丝素蛋白滴在BAMG上,冻干后得到BAMG-SF双层支架,支架孔径约100 μm,孔间连通性较好。将材料制备成10 mm×10 mm的补片,乙醇消毒备用。将上述方法制备得到的BAMG-SF双层支架喷金镀膜,在液氮中脆断,喷金处理后,扫描电镜观察。
1.2.3 hASCs在BAMG-SF支架浸提液与DMEM培养基中增殖率的测定
BAMG-SF支架用75%乙醇浸泡过夜,PBS洗去残留乙醇,并加入低糖DMEM完全培养基,置于37℃、5%CO2的培养箱中24 h,收集浸提液,备用。将第3代hASCs接种于96孔板中培养24 h后,吸出培养基,分别添加100 μL低糖DMEM完全培养基(对照组)和100 μL BAMG-SF浸提液(实验组),继续培养。于第1、3、5天,每组各取6个孔。每孔加入10 μL CCK-8溶液,混匀后继续培养2 h。然后酶标仪测定450 nm波长时的A值,计算相对增殖率,并据此进行毒性分级。
1.2.4 hASCs在BAMG-SF支架浸提液与DMEM培养基中细胞生长曲线的测定
将第2代的hASCs接种在10 cm×10 cm的培养皿中,每皿约5×105个细胞。培养皿分为两组:对照组加DMEM培养基,实验组加BAMG-SF支架材料浸提液,放入培养箱中,在第1、2、3、4天时,将细胞消化,计算细胞数量,绘制细胞生长曲线图。
1.2.5 hASCs种植于BAMG-SF支架
将消毒后备用的BAMG-SF支架用PBS冲洗后,加入低糖DMEM完全培养基预培养过夜。将上清及材料表面的培养基吸净,选取生长较好的第3代hASCs,制成密度为2×107cells/mL的细胞悬液。每个材料表面均匀滴加50 μL细胞悬液,静置2 h后沿培养皿边缘缓慢加入低糖DMEM完全培养基,并置于37℃、5%CO2及饱和湿度的培养箱中培养。用于体内试验的细胞-材料复合物,在体外培养2 d后植入裸鼠皮下。用于体外实验的支架,仍继续在培养箱中培养,3 d换液一次。
1.2.6 组织学观察
体外培养的细胞-支架复合物于培养1周后取材,体内培养的支架材料在1周、2周后分别取材。4%多聚甲醛固定4 h,乙醇梯度脱水,石蜡包埋,切片(4 μm厚),HE染色,光镜下观察细胞在支架内的生长情况。
1.2.7 体内培养的细胞-支架复合物免疫荧光检测
体内培养的细胞-支架复合物于2周后取材,冰冻切片。将切片浸水10 h,洗去OCT,柠檬酸微波法修复抗原,自然冷却,用0.3%的Triton破膜15 min,滴加羊血清封闭非特异性抗原,一抗为兔抗人HLA抗体,4℃过夜,二抗为带有红色荧光标记的羊抗兔抗体,DAPI染细胞核,荧光封片剂封片,避光保存。
1.2.8 统计学分析
SPSS l7.0软件行统计学分析。数据以x±s表示。实验组与对照组各时间点A值的比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 hASCs的形态和生长特性
原代细胞培养6~8 h后,有部分成纤维细胞样细胞贴壁。贴壁细胞呈梭形,其间可见少量三角形、多边形细胞(图1A)。随着培养时间延长,细胞形态为典型的梭形。培养4~6 d,细胞可达80%~90%融合,7~8 d可形成100%融合的致密单层。传代后的细胞形态主要为梭形,少数为三角形或多边形(图1B)。我们前期实验中的流式细胞鉴定显示,CD29表达为99.77%,CD44表达为97.1%,CD73表达为96.54%,CD105表达为93.06%,CD45表达为0.37%,CD34表达为1.38%[12]。结果证实得到的是hASCs。
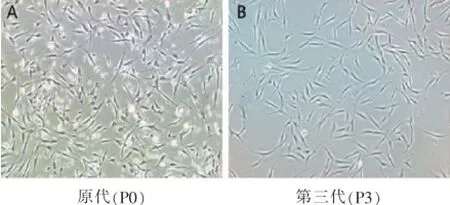
图1 hASCs形态学观察(40×)Fig.1 Histological observation of hASCs(40×)
2.2 支架材料的制备
制备的BAMG-SF双层支架外观呈白色,扫描电镜观察孔径为100 μm左右。横截面显示,上面是SF,下面是BAMG(图2)。

图2 BAMG-SF支架材料大体观及扫描电镜观察Fig.2 Gross and SEM observation of BAMG-SF
2.3 hASCs在BAMG-SF支架浸提液与DMEM培养基中增殖率和生长曲线的测定
在第1、3、5天,BAMG-SF浸提液(实验组)中hASCs的增殖是DMEM完全培养基(对照组)的98.8%、104.2%和111.1%,平均相对增殖率是104.7%,实验组与对照组无显著差异(P>0.05),说明BAMG-SF浸提液对hASCs增殖无明显影响。两组的生长曲线无显著差异(图3)。依据细胞相对增殖率与细胞毒性分级关系,浸提液在第1、3、5天的细胞毒性分别是I级、0级和0级,说明BAMG-SF浸提液无细胞毒性。
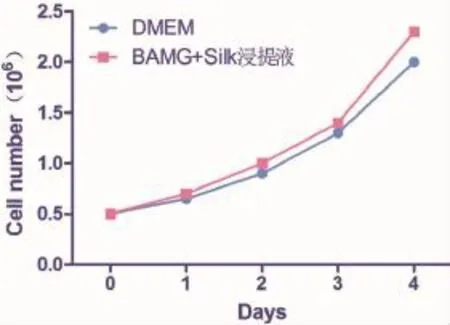
图3 hASCs在BAMG-SF支架浸提液与DMEM培养基中的生长曲线测定Fig.3 The growth curves of hASCs cultured in theleaching solution of the BAMG-SF and DMEM
2.4 细胞在支架上的生长情况
如图4所示,hASCs种植到BAMG-SF双层材料后,经过体内外培养,hASCs均能够长入支架材料的空隙内。细胞-材料复合物体外培养1周,发现细胞黏附在材料边缘生长,少量细胞渗透入支架材料内部浅层;体内培养1周后,发现细胞黏附在材料表面,部分在浅层,少量在材料内部;体内培养2周后,发现大量细胞渗透进入材料内部。同时,利用免疫荧光检测HLA发现,支架内细胞部分阳性染色,说明进入支架内部的细胞一部分是hASCs,一部分是裸鼠自体细胞。
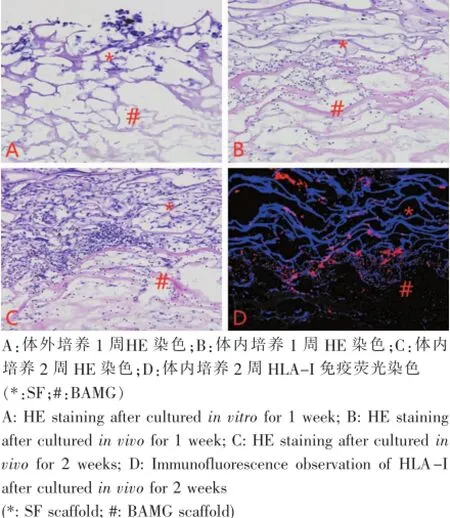
图4 hASCs复合BAMG-SF双层支架组织学检测及免疫荧光检测(200×)Fig.4 Morphological observation and immunofluorescence observation of BAMG-SF bilayer scaffold combined with hASCs(200×)
3 讨论
全球约有4亿患者罹患膀胱疾病,仅美国每年就有约5万例患者被诊断为膀胱癌[13]。特别是浸润性膀胱癌,需要进行全膀胱切除,却缺乏有效的修复手段,常用胃肠道代膀胱进行修复,不仅存在多种并发症,还会造成供区严重损伤。近年来,组织工程的发展为膀胱重建带来了希望。
理想的膀胱修复材料应具有以下性能:良好的生物相容性,可靠的机械性能,能抵抗腹膜内及腹膜外感染,不影响正常肾功能,具有良好的收缩能力,并通过神经和膀胱平滑肌再生后具有自主排尿功能等[14-16]。BAMG来源于膀胱组织,与人膀胱组织结构最接近,生物相容较好,具有膀胱组织修复的独特优势,是一种较为理想的天然生物支架。我们前期研究发现,尿路上皮细胞、膀胱平滑肌细胞与BAMG体外构建,能够形成类似正常膀胱壁的组织结构,实现材料降解与组织器官再生同步化,显示出人工合成支架材料无可比拟的优势。但天然BAMG由于孔隙率低,不利于细胞的渗透和厚层组织的再生[17-18]。丝素蛋白(SF)是近年来修复膀胱缺损的常用合成材料之一,其细胞生物相容性好,并具有一定的机械强度,多孔结构也较适合细胞和组织的长入,本身无毒,降解产物也无生物毒副作用,尤其是其直接修补猪膀胱大范围缺损的成功,展现了Silk作为膀胱扩大修补材料的巨大应用潜能,但单纯致密的SF却存在不易降解等缺点[19-20]。
因此,我们将多孔SF和BAMG复合,形成BAMG-SF双层复合材料。其中,BAMG具有良好的生物相容性,起到较好的防水性能,而多孔SF主要为平滑肌细胞提供了生长黏附的空间,有利于平滑肌的快速长入,弥补了单纯BAMG修补膀胱时因相对致密,平滑肌细胞不易长入,膀胱容量过大,易使膀胱壁扩张变薄,憩室形成等缺点,又解决了致密SF不易降解的问题。所以,本实验选用BAMG-SF作为支架研究对象。
本实验中,cck-8实验结果和生长曲线都显示各时间点实验组和对照组无显著差异(P>0.05),说明BAMG-SF浸提液不存在明显的细胞毒性。hASCs种植于BAMG-SF支架后,经体外、体内培养,细胞均能长入BAMG-SF支架的孔隙内,说明BAMG-SF支架具有良好的细胞亲和性。
实验发现,体内培养比体外培养有更多的细胞长入支架,可能是由于体内环境为细胞生长提供了丰富的血供和营养。体外培养1周时,有少量细胞黏附生长在BAMG-SF支架的边缘,可能由于细胞与材料黏附不牢,经过石蜡包埋处理的复杂过程,部分脱落;体内培养1周,细胞黏附生长在BAMG-SF支架的边缘,且已有部分渗透到材料内部,体内培养2周后,大量细胞能渗透到材料内部,同时细胞周围可见大量细胞外基质。HLA-I免疫荧光检测发现,支架材料内部分细胞阳性表达,说明BAMG-SF支架内的细胞来源于人,即hASCs。
综上,BAMG-SF复合材料适合hASCs的黏附、生长和增殖。BAMG-SF可以作为理想的支架材料,进一步用于组织工程膀胱修复的研究。
[1]Brehmer B,Rohrmann D,Becker C,et al.Different types of scaffolds for reconstruction of the urinary tract by tissue engineering[J]. Urol Int,2007,78(1):23-29.
[2]Tu DD,Chung YG,Gil ES,et al.Bladder tissue regeneration using acellular bi-layer silk scaffolds in a large animal model ofaugmentation cystoplasty[J].Biomaterials,2013,34(34):8681-8689.
[3]Seth A,Chung YG,Gil ES,et al.The performance of silk scaffolds in a rat model of augmentation cystoplasty[J].Biomaterials,2013, 34(20):4758-4765.
[4]Zhao Z,Yu H,Xiao F,et al.Differentiation of adipose-derived stem cells promotes regeneration of smooth muscle for ureteral tissue engineering[J].J Surg Res,2012,178(1):55-62.
[5]Zhang R,Jack GS,Rao N,et al.Nuclear fusion-independent smooth muscle differentiation of human adipose—derived stem cells induced by a smooth muscle Environment[J].Stem Cells, 2012,30(3):481-490.
[6]Zhu WD,Xu YM,Feng C,et al.Bladder reconstruction with adipose-derived stem cell-seeded bladder acellular matrix grafts improve morphology composition[J].World J Urol,2010,28(4): 493-498.
[7]Zhu WD,Xu YM,Feng C,et al.Different bladder defects reconstructed with bladder cellular matrix grafts in a rabbit model[J]. Urologe A,2011,50(11):1420-1425.
[8]Song L,Murphy SV,Yang B,et al.Bladder acellular matrix and its application in bladder augmentation[J].Tissue Eng Part B Rev,2014,20(2):163-172.
[9]Altman GH,Diaz F,Jakuba C,et al.Silk-based biomaterials[J]. Biomaterials,2003,24(3):401-416.
[10]Unger RE,Michael W,Kirsten P,et al.Growth of human cells on a non-woven silk fibroin net:a potential for use in tissue engineering[J].Biomaterials,2004,25(6):1069-1075.
[11]Meinel L,Hofmann S,Karageorgiou V,et al.The inflammatory responses to silk films in vitro and in vivo[J].Biomaterials,2005, 26(2):147-155.
[12]Zhang M,Peng Y,Zhou Z,et al.Differentiation of human adiposederived stem cells co-cultured with urothelium cell line toward a urothelium-like phenotype in a nude murine model[J].Urology, 2013,81(2):e15-e22.
[13]Staack A,Hayward SW,Baskin LS,et al.Molecular,cellular and developmental biology of urothelium as a basis of bladder regeneration[J].Differentiation,2005,73(4):121-133
[14]Zhang YY,Kropp BP,Lin HK,et al.Bladder regeneration with cell-seeded small intestinal submucosa[J].Tissue Eng,2004,10 (1-2):181-187.
[15]Maurer S,Feil G,Stenzl A,et al.Stratified urothelium and its relevance in reconstructive urology[J].Urologe A,2005,44(7): 738-742.
[16]Engelhardt EM,Stegberg E,Brown RA,et al.Compressed collagen gel:a novel scaffold for human bladder cells[J].J Tissue Eng Regen Med,2010,4(2):123-130.
[17]卢慕峻,王忠,周广东,等.组织工程化膀胱壁复层结构的体外构建[J].中华泌尿外科杂志,2007,28(z1):67-70.
[18]卢慕峻,王忠,董国勤,等.聚羟基乙酸作为支架材料体外构建复层膀胱壁结构的探讨[J].临床泌尿外科杂志,2009,24(12):935-938.
[19]Mauney JR,Cannon GM,Lovett ML,et al.Evaluation of gel spun silk-based biomaterials in a murine model of bladder augmentation [J].Biomaterials,2011,32(3):808-818.
[20]Gomez P,Gil ES,Lovett ML,et al.The effect of manipulation of silk scaffold fabrication parameters on matrix performance in a murine model of bladder augmentation[J].Biomaterials,2011,32 (30):7562-7570.
Human Adipose-Derived Stem Cells and its Biocompatibility with Bladder Acellular Matrix Graft-Silk Fibroin Bilayer Scaffold
ZHAO Yang1,WU Jiasheng2,ZHOU Zhe1,ZHOU Juan1,ZHANG Ming1,LI Wei2,WANG Zhong1,SUN Kang2,LU Mujun1.
1 Department of Plastic and Reconstructive Surgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China;2 Shanghai Jiaotong University School of Materials Science and Engineering,Shanghai 200240,China.Corresponding author:LU Mujun(E-mail:lumujun@163.com).
ObjectiveTo observe the growth of human adipose-derived stem cells(hASCs)in bladder acellular matrix graft-silk fibroin(BAMG-SF)bilayer scaffold and to analyze the biological compatibility of BAMG-SF with hASCs.Methods hASCs were isolated from human subcutaneous adipose tissue after collagenase digesting,filtrating and centrifuging,then cultured in the leaching solution of BAMG-SF.The cytotoxicity of scaffold was evaluated by CCK-8 cell viability assay,and the growth curves were also observed.Surface morphology on BAMG-SF was observed by scanning electron microscopy (SEM).The hASCs of passage 3 were seeded onto the BAMG-SF bilayer scaffolds for 1 week,then the BAMG-SF bilayer scaffolds seeded with hASCs were transplanted into nude mouse for 1 week or 2 weeks.The growth of cells in BAMG-SF biomaterials was observed by HE staining.The species origin of these cells in the BAMG-SF scaffolds cultured in vivo was detected by Immunofluorescence.ResultshASCs maintained high proliferation rate in the leaching solution of BAMG-SF and the BAMG-SF scaffolds were nontoxic absolutely.According to the growth curves of hASCs cultured in the leaching solution of the BAMG-SF and DMEM,BAMG-SF scaffolds were conducive to the growth of hASCs.The histological study found that hASCs could grow into the space of the BAMG-SF scaffolds after cultured in vitro and in vivo.There were more cells in the scaffolds cultured in vivo than in vitro.Immuno-fluorescence suggested that some of the cells inside the scaffoldswere hASCs.ConclusionBAMG-SF bilayer scaffolds are nontoxic and have a good biocompatibility with hASCs,which can be used as a vehicle for hASCs in bladder defect reconstruction.
Human adipose-derived stem cells;Bladder acellular matrix graft;Silk fibroin;Bilayer scaffold; Tissue engineering
Q813.1+2
A
1673-0364(2014)06-0309-05
2014年8月21日;
2014年10月9日)
10.3969/j.issn.1673-0364.2014.06.003
国家自然科学基金项目(81070605,81370860);上海交通大学“医工(理)交叉研究基金”(YG2011MS14)。
200011上海市上海交通大学医学院附属第九人民医院泌尿外科(赵阳,周哲,周娟,张明,王忠,卢慕峻);200240上海市上海交通大学材料科学与工程学院(吴稼晟,李伟,孙康)。
卢慕峻(E-mail:lumujun@163.com)。
