软骨形态发生蛋白1诱导的瘢痕成纤维细胞体内成软骨能力的实验研究
2014-02-05沈聪聪侯亦康许祐荣
沈聪聪 柴 岗 曲 淼 侯亦康 许祐荣 张 艳
软骨形态发生蛋白1诱导的瘢痕成纤维细胞体内成软骨能力的实验研究
沈聪聪 柴 岗 曲 淼 侯亦康 许祐荣 张 艳
目的探讨软骨形态发生蛋白1(CDMP1)诱导的瘢痕成纤维细胞在体内环境下的软骨构建能力。方法取瘢痕切除术后丢弃的增生性瘢痕组织,提取瘢痕成纤维细胞。将瘢痕成纤维细胞与PGA/PLA支架复合,CDMP1软骨诱导液(CDMP1终浓度为100 ng/mL)进行诱导培养2周,设为诱导组(n=10);将常规培养液培养的瘢痕成纤维细胞-材料复合物植入裸鼠体内作为阴性对照,设为非诱导组(n=4);将软骨细胞-材料复合物植入裸鼠体内作为阳性对照,设为软骨组(n=4)。分别于4周和8周后取材,进行各组湿重、糖胺聚糖(GAG)含量测定,HE染色、Safranine-O染色和Ⅱ型胶原免疫组化染色。结果体内培养4周、8周后各组湿重、GAG含量测定显示,诱导组均高于非诱导组(P<0.05)。体内培养4周后,诱导组HE染色结果显示,瘢痕成纤维细胞诱导后出现软骨细胞陷窝结构;Safranine-O染色结果示,GAG均匀分布于基质;免疫组织化学染色示部分瘢痕成纤维细胞基质中COLⅡ阳性表达。8周时,诱导组的类软骨结果相对4周时更加成熟,更加符合软骨结构分布。结论在CDMP1诱导下,瘢痕成纤维细胞与PGA/PLA材料复合,在体内可以形成类软骨组织,具备一定的成软骨能力。
瘢痕成纤维细胞软骨细胞软骨形态发生蛋白1诱导分化
软骨缺损的治疗一直是整形外科面临的严峻问题。目前,临床上常用的替代治疗手段均存在许多问题。自体软骨细胞移植修复也存在细胞供区不足、体外培养周期长、供区易发生病变和软骨细胞表型不易保持等缺点。组织工程技术的建立为修复和替代受损组织提供了一种新的方法。
研究发现,真皮成纤维细胞具有多向分化潜能[1],并能诱导成软骨细胞[2-3]。大面积烧伤伴软骨缺损的患者,皮源紧张,但有大量废弃的瘢痕组织,而瘢痕成纤维细胞与皮肤成纤维细胞同样具有强大的体外增殖能力及基质分泌能力,能够分泌大量胶原及细胞外基质,为软骨组织构建提供了契机。
本研究的前期实验已经证明,瘢痕成纤维细胞在体外单层培养和三维环境下均可向软骨细胞表型分化,并具备一定的软骨分化潜能[4]。在本实验中,我们将瘢痕成纤维细胞与PGA/PLA生物材料的复合物植入体内,探讨其在体内环境下的成软骨能力。
1 材料与方法
1.1 仪器与材料
Ⅰ型胶原酶(Worthington公司,美国);FBS基础培养液、DMEM培养液(Hyclone公司,美国);胰蛋白酶(上海实生生物制品有限公司);CDMP1(Research Diagnostics公司,美国);鼠抗人I型胶原单克隆抗体、羊抗鼠二抗(Santa公司,美国)。
恒温CO2培养箱(Forma Scientific公司,美国);普通台式离心机、高速冷冻离心机(Heraeus公司,美国);倒置相差显微镜(Nikon公司,日本);超净工作台(苏州安泰空气技术有限公司);电泳仪(天能科技有限公司);热循环仪(Biometra公司,美国);100 mm培养皿、离心管(FALCON公司,美国)。
1.2 取材与细胞培养
取我科手术切除瘢痕3例(1名男性,2名女性,年龄7~20岁,获患者知情同意),超净台内去除表皮及皮下组织,剩余瘢痕增生部分剪碎移入离心管,加入10倍体积的0.3%Ⅰ型胶原酶,37℃、3 h、100目细胞滤器过滤后离心,2 000 r/min,10 min,弃上清,加入10%FBS的DMEM培养液混浴,接种至100 mm的培养皿。待细胞融合至80%时,以1×104cells/cm2密度传代,体外扩增至第4代进行培养。
取手术废弃的部分肋软骨(获患者知情同意),分离软骨细胞常规培养。
1.3 PGA/PLA支架材料的制作
取无纺PGA纤维加入1.5%的PLA二氯乙烷溶液约0.4 mL,待其自然干燥后取出,真空保存备用。
1.4 细胞接种和诱导
配制CDMP1诱导液(2%胎牛血清F-12培养液,CDMP1终浓度为100 ng/mL)。各组细胞悬液0.3 mL均匀种植于PGA/PLA支架上,于37℃、5%CO2、100%饱和湿度下培养4~5 h后,加入含10%FBS的LG-DMEM培养液继续培养。3 d后换为软骨诱导液诱导培养2周。同时,制备软骨细胞-材料复合物。
1.5 实验动物分组和手术回植
6周龄雄性裸鼠20只,麻醉意外死亡2只,共18只用于实验。将CDMP1体外诱导后的细胞材料复合物植入裸鼠体内,为诱导组,10只;将常规培养液培养的细胞-材料复合物植入裸鼠体内作为阴性对照,为非诱导组,4只;将软骨-细胞材料复合物植入裸鼠体内作为阳性对照,为软骨组,4只。随机分组,裸鼠背部表面麻醉,正中作约1 cm长度切口,向两侧分离,使皮肤与皮下组织分离,将体外培养的细胞-材料复合物植入裸鼠皮下,左侧为实验组,右侧阴性对照组,背部中央为阳性对照组,丝线缝合伤口。
1.6 术后大体观及湿重测定
分别于4周和8周后取材,比较各组标本大小、外形及弹性,并对各组标本湿重进行测量。
1.7 GAG含量测定
取材后对细胞-材料复合物进行检测,将复合物于去污裂解液中剪碎,经盐酸胍等处理后,以阿利辛蓝染色并沉淀,经DMSO溶解后在600 nm波长下测定其吸光度值,以硫酸软骨素绘制标准曲线,根据比色结果与标准曲线,计算样本内GAG的含量。
1.8 组织学和免疫组织化学染色
取材后收集样本,10%磷酸缓冲福尔马林溶液固定,石蜡包埋,切成5 μm厚的切片。以HE、safranin-O染色及免疫组化染色,分别显示复合物的组织学形态和软骨特异指标的分布。
1.8.1 HE染色
切片脱蜡入水后,PBS漂洗,苏木素染色20 min,水洗,1%盐酸乙醇分化,再水洗脱水,伊红染料染色,乙醇梯度脱水,树胶封片,光学显微镜下观察。
1.8.2 Safranin-O染色
取材后,切片脱蜡至水,苏木素染色5 min,盐酸乙醇分化5 sec(提插数下),自来水冲洗15 min,Safranin-O染色10 min,快速水洗20 sec,乙醇梯度脱水,二甲苯透明,中性树脂封片,光镜下观察。
1.8.3 免疫组织化学
将切片脱蜡至水;PBS漂洗3次,3%过氧化氢溶液封闭内源性过氧化物酶,PBS漂洗,0.4%胃蛋白酶(pH 2.0)37℃消化30 min,正常羊血清(用1% BSA进行1∶10稀释)室温下孵育30 min封闭非特异性抗原;加入鼠抗人Ⅱ型胶原单克隆抗体(1% BSA 1∶100稀释)4℃过夜,PBS漂洗;加入HRP标记羊抗鼠二抗,37℃孵育30 min,PBS漂洗;加入二氨基联苯氨(DAB)显色;苏木素复染,中性树脂封片。以不加鼠抗人Ⅱ型胶原单克隆抗体作为空白对照,正常软骨组织为阳性对照。
1.9 统计学处理
结果数据以x±s表示,两组间比较采用t检验,多组间比较采用方差分析。P<0.05认为差异有统计学意义。统计软件为SPSS v1.15。
2 结果
2.1 细胞材料复合物大体观及湿重检测
大体观察:体内培养4周后,所有的复合物均变得相对光滑,外观光泽。诱导组与非诱导组稍有皱缩,基本保持了材料的原有形态。诱导组直径约4.5 mm,形状良好,触之有一定弹性;非诱导组虽能保持一定外观,但基质分泌较少,韧性较差,质地较松软;软骨组生长良好,基质分泌旺盛,形状规则,外观均呈乳白色,有弹性。湿重测定示,软骨组为92.75±1.53 mg,诱导组为75.69±0.97 mg,非诱导组为43.21±0.43 mg,3组之间差异有统计学意义(P<0.05)。
体内培养8周后,诱导组呈现特有的软骨光泽,较体内培养4周有所成熟;非诱导组质地松软,生长欠佳;软骨组生长良好。湿重测定示,软骨组为101.24±2.53 mg,诱导组为80.09±1.27 mg,非诱导组为35.15±2.03 mg,3组差异显著(P<0.05)(图1、2)。
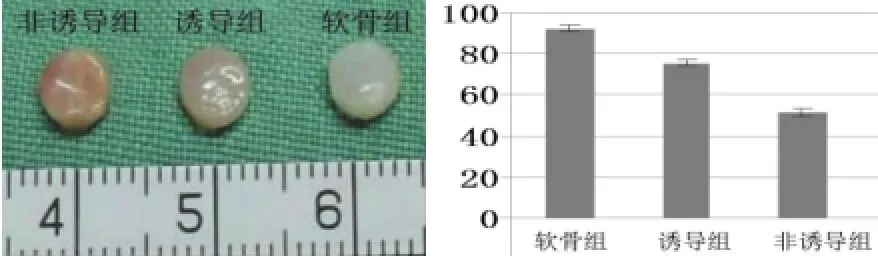
图1 细胞材料复合物体内培养4周后大体观及湿重测定Fig.1 Gross view and the wet weight of HSFBs-PGA/PLA complex in each group after cultured for 4 weeks in vivo

图2 细胞材料复合物体内培养8周后大体观及湿重测定Fig.2 Gross view and the wet weight of HSFBs-PGA/PLA complex in each group after cultured for 8 weeks in vivo
2.2 GAG定量检测
HSFBs-PGA/PLA复合物植入体内4周、8周后行GAG含量测定。结果显示,诱导组GAG含量均明显高于非诱导组,诱导组与非诱导组差异有统计学意义(P<0.05)(表1)。

表1 体内培养4、8周后各组GAG定量检测Table1 GAG content in each group after cultured for 4 or 8 weeks in vivo
2.3 组织学和免疫组织化学染色
2.3.1 HE染色
细胞-材料复合物体内培养4周后取材,HE染色显示,软骨组与正常软骨组织的组织学特征十分接近,形成了成熟连续的软骨组织,可见到大量成熟的软骨陷窝,无纤维组织形成,但新生软骨内部的组织结构均较周边松散,可见到尚未降解的支架材料。诱导组细胞材料复合物以纤维性组织为主,较为紧密,部分区域可见到软骨样组织,部分细胞出现陷窝结构;非诱导组呈现均一的纤维样结构,组织结构松散,镜下未发现软骨特征性陷窝结构。体内培养8周后HE染色显示,诱导组部分细胞出现陷窝结构,非诱导组镜下未发现软骨特征性陷窝结构(图3)。
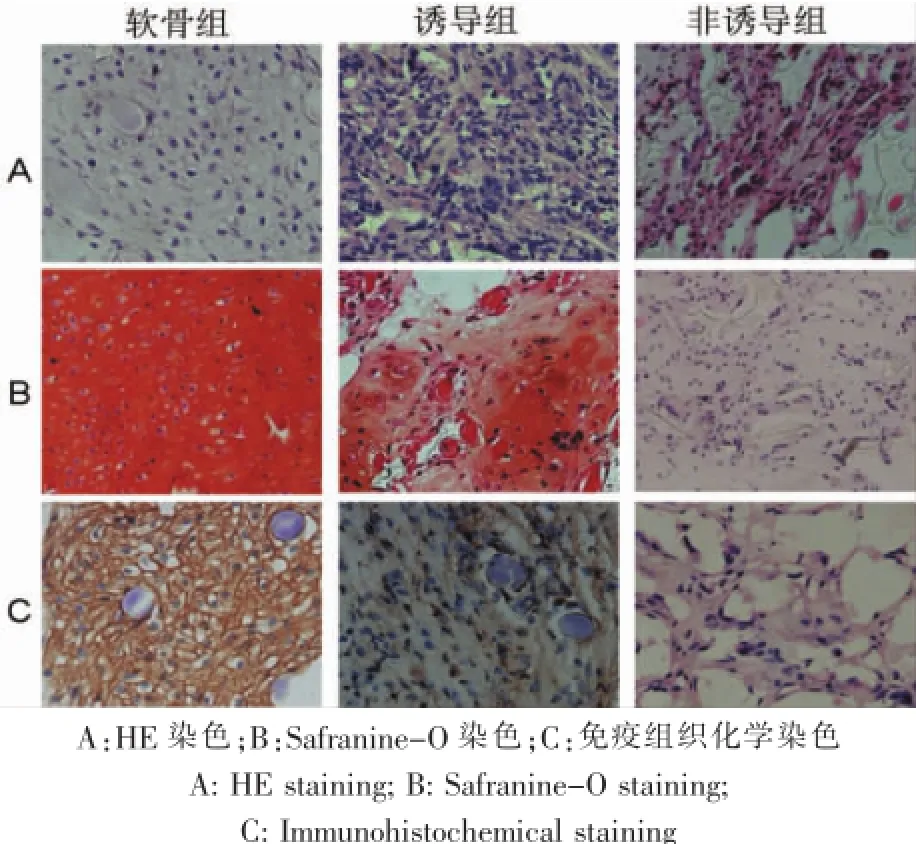
图3 细胞-材料复合物体内培养4周后各组组织学及免疫组织化学观察Fig.3 Histological and immunohistochemical observation of each group after culturing for 4 weeks in vivo
2.3.2 Safranine-O染色
细胞-材料复合物诱导4周后取材,Safranine-O染色显示,诱导组阳性染色,着色均一,相对软骨组着色稍浅;非诱导组着色阴性;软骨组着色呈强阳性,着色均一,提示大量GAG分泌。8周后取材行Safranine-O染色,软骨组着色均一,强阳性;诱导组均匀染色,相对软骨组着色稍浅,提示GAG均匀分布于基质;非诱导组着色阴性(图3)。
2.3.3 免疫组织化学染色检测
细胞-材料复合物诱导4周后取材,免疫组织化学染色显示诱导组部分区域出现阳性着色,着色相对不均一,提示部分瘢痕成纤维细胞出现COLⅡ的表达;非诱导组免疫组化染色呈现阴性结果;软骨组染色结果呈阳性,着色均匀。诱导8周后,诱导组部分区域着色阳性;非诱导组免疫组化染色呈阴性;软骨组细胞染色强阳性,着色均匀(图4)。

图4 细胞-材料复合物体内培养8周后各组组织学及免疫组织化学观察Fig.4 Histological and immunohistochemical observation of each group after culturing for 8 weeks in vivo
3 讨论
由于软骨的再生能力很有限,软骨缺损的修复一直是临床治疗的难题。传统的治疗方法,如软骨下打孔、骨髓刺激法、软骨膜移植法或使用人工代用品都存在一定的缺点,并不能完全修复透明软骨的原有结构。组织工程的发展,使组织构建成为可能,为软骨缺损的修复提供了新的方法及思路。
综合考虑来源、取材的创伤以及诱导分化的效率问题,我们需要寻找一种来源广泛,能够向软骨细胞诱导分化,而且更容易为患者所接受的种子细胞。真皮成纤维细胞在机体分布广泛、取材方便、增殖力强,已成为当前组织工程种子细胞研究的重点[5]。与软骨细胞不同的是,真皮成纤维细胞保留了中胚层间质细胞增殖力强的特性,多次传代后仍能保持强大增殖力。对于临床上大面积烧伤伴软骨缺损的患者而言,患者皮源紧张,无多余皮肤可取,切取正常皮肤亦会增加感染风险,患者很难接受。研究证明,瘢痕成纤维细胞(HSFBs)与DFs同样具有强大的体外增殖能力及基质分泌能力,能够分泌大量胶原及蛋白聚糖。同时,HSFBs具有部分干细胞的特性,在特定条件下能够表达干细胞相关标志物。Yang等[6]提取瘢痕疙瘩中的成纤维细胞,在特定诱导条件下发现瘢痕成纤维细胞具有干细胞样分化潜能,能够表达神经角质细胞相关标志物,并能够向神经细胞分化诱导。Moon等[7]从头皮瘢痕中分离瘢痕成纤维细胞,采用各种诱导体系对瘢痕成纤维细胞进行培养诱导,结果显示瘢痕成纤维细胞能够表达间充质干细胞的标志物CD13、CD29、CD44、CD90等,并能够向骨组织细胞、脂肪细胞、软骨细胞、肌腱细胞及上皮细胞等方向分化,证明了瘢痕成纤维细胞具有多向分化潜能。
软骨形态发生蛋白(CDMP1,cartilage-derived morphogenetic protein1)是骨形态发生蛋白(BMP,bone morphogenetic protein)家族中的一类特异性生长因子,是与软骨形态发生和发育最为相关的一类生长因子,CDMP1主要通过调节间质前体细胞的分化,参与正常软骨组织的生长并促进软骨损伤的修复过程[8-9]。研究表明,CDMP1能够诱导间充质干细胞向软骨表型分化并表达特异性软骨基质[10],而瘢痕成纤维细胞具有间充质干细胞的特性,具有向软骨细胞分化的潜能。因此,本实验采用软骨形态发生蛋白作为诱导剂。而进行组织工程软骨构建,生物支架材料是必不可少的一个因素。支架材料对软骨组织的形成具有重要作用,它能够为细胞提供一个稳定的三维空间结构,便于细胞黏附生长[11]。理想的支架材料应具备以下特点[12]:良好的生物相容性,良好的生物降解性,具有三维立体多孔结构,以及一定的可塑性和机械强度。Grande等[13]的研究发现,PGA/ PLA支架材料具有促进蛋白聚糖合成,促进软骨细胞增殖、分化和基质合成的作用。
本研究中,细胞-材料复合物体内培养4周后,大体观察发现,软骨组外观类似于软骨组织,基质分泌旺盛,皱缩不明显,有弹性,外形尚基本保持。诱导组外观良好,稍有皱缩,触之略有弹性,但相对软骨组稍差,组织块直径及厚度略有减小,外形尚能保持;非诱导组细胞材料复合物皱缩变形,结构相对松散,厚度也明显变薄,无法保持原有外形,弹性较差,与软骨组差距明显。8周标本大体观发现,诱导组基质进一步增加,外观良好,相对4周而言,软骨光泽及光滑程度明显增加。而非诱导组虽重量和光滑程度增加,但结构相对松散,弹性较差,抗外力能力明显不足。各组细胞-材料复合物的湿重及GAG含量检测表明,随着体内培养时间的延长,各组湿重及GAG含量均进一步增加,而诱导组在湿重及GAG定量测定中均优于非诱导组,差异有统计意义。4周取材HE染色显示,软骨组与正常软骨组织的组织学特征十分接近,形成了连续的软骨组织,可见到大量的软骨陷窝,软骨细胞之间大量基质分泌,无明显纤维组织形成。诱导组细胞材料复合物结构较为紧密,部分区域可见到软骨样组织,细胞出现陷窝结构,陷窝结构在细胞材料复合物边缘多于中央,中央大部分区域仍可见到大量纤维组织形成;非诱导组呈现弥散的纤维性组织,组织结构松散,镜下未发现明显软骨特征性陷窝结构。8周标本相对4周标本而言更为成熟,细胞间基质增加,诱导组结构更加紧密,软骨陷窝数量增多,陷窝结构更加明显,更加符合软骨结构分布。非诱导组未见到明显变化,仍为纤维性结构为主,未见软骨组织特征性结构出现。COLⅡ为软骨细胞特异标志物,对细胞材料复合物体内培养4周后进行COLⅡ免疫组织化学染色,诱导组部分区域出现阳性着色,着色相对均一,提示部分瘢痕成纤维细胞出现COLⅡ的表达;非诱导组免疫组化染色结果呈现阴性结果,未有COLⅡ的表达;软骨组细胞染色结果呈阳性,整个细胞材料着色均匀,提示COLⅡ的高度表达。体内培养8周细胞材料复合物COLⅡ免疫组织化学染色结果表明,诱导组部依然为阳性着色,着色均一,与非诱导组的阴性结果形成明显对比。Safranine-O染色的结果同样验证了上述结果。
本实验结果表明,在CDMP1诱导下,瘢痕成纤维细胞在体内可以形成类软骨组织,具备一定的体内成软骨能力,经过4周诱导后瘢痕成纤维细胞形成的类软骨组织相对成熟,体内培养8周后的细胞材料复合物较4周更加成熟,虽然与正常软骨仍有一定差距,但在外形和结构上更加接近软骨组取材标本。随着培养时间和实验条件的改善,瘢痕成纤维细胞有望在体内构建更加成熟稳定的软骨组织,成为软骨构建的种子细胞来源之一。
[1]Huang HI,Chen SK,Ling QD,et al.Multilineage differentiation potential of fibroblast-like stromal cells derived from human skin [J].Tissue Eng Part A,2010,16(5):1491-1501.
[2]Yin S,Cen L,Wang C,et al.Chondrogenic transdifferentiation of human dermal fibroblasts stimulated with cartilage-derived morphogenetic protein 1[J].Tissue Eng Part A,2010,16(5):1633-1643.
[3]Zhao G,Yin S,Liu G,et al.In vitro engineering of fibrocartilage using CDMP1 induced dermal fibroblasts and polyglycolide[J]. Biomaterials,2009,30(19):3241-3250.
[4]马晓飞,张艳,柴岗,等.软骨形态发生蛋白1诱导瘢痕成纤维细胞表达软骨表型的实验研究[J].组织工程与重建外科,2012,8 (2):78-83.
[5]崔磊,尹烁,邓辰亮,等.软骨形态发生蛋白1诱导真皮成纤维细胞表达软骨细胞表型的实验研究[J].中华医学杂志,2004,84 (15):1304-1309.
[6]Yang JH,Shim SW,Lee BY,et al.Skin-derived stem cell in human scar tissues:a novel isolation and proliferation technique and their differentiation potential to neurogenic progenitor cells[J]. Tissue Eng Part C,2010,16(4):619-629.
[7]Moon JH,Kwak SS,Park G,et al.Isolation and characterization of multipotent human keloid-deriv ed mesenchymal-like stem cells[J].Stem Cells Dev,2008,17(4):713-724.
[8]Felin JE,Mayo JL,Loos TJ,et al.Nuclear variants of bone morphogenetic proteins[J].BMC Cell Biol,2010,11:20.
[9]Tsumaki N,Tanaka K,Arikawa-Hirasawa E,et al.Role of CDMP-1 in skeletal morphogenesis:promotion of mesenchymal cell recruitment and chondrocyte differentiation[J].J Cell Biol, 1999,144(1):161-173.
[10]Bai X,Xiao Z,Pan Y,et al.Cartilage-derived morphogenetic protein-1 promotes the differentiation of mesenchymal stem cells into chondrocytes[J].Biochem Biophys Res Commun,2004,325 (2):453-460.
[11]Vacanti CA,Langer R,Schloo B,et al.Synthetic polymers seeded with chondrocytes provide a template for new cartilage formation [J].Plast Reconstr Surg,1991,88(5):753-759.
[12]Boyan BD,Hummert TW,Dean DD,et al.Role of material surfaces in regulating bone and cartilage cell response[J]. Biomaterials,1996,17(2):137-146.
[13]Grande DA,Halberstadt C,Naughton G,et al.Evaluation of matrix scaffolds for tissue engineering of articular cartilage grafts [J].J Biomed Mater Res,1997,34(2):211-220.
ChondrogenicDifferentiationofHypertrophicScar-DerivedFibroblastsInitiatedbyCartilage-derived Morphogenetic Protein 1 in Vivo
SHEN Congcong,CHAI Gang,QU Miao,HOU Yikang,XU Yourong,ZHANG Yan.
Department of Plastic and Reconstructive Surgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,200011 Shanghai,China.Corresponding author:Zhang Yan(E-mail:13651817522@163.com).
ObjectiveTo explore the chondrogenesis potential of hypertrophic scar fibroblasts(HSFBs)induced by cartilage-derived morphogenetic protein 1(CDMP1)in vivo.MethodsHypertrophic scar fibroblasts(HSFBs)were isolated from discarded hypertrophic scar.HSFBs combining with PGA/PLA scaffold as HSFBs-PGA/PLA complex were induced by CDMP1(100 ng/mL)for 2 weeks.Then the complex were transplanted into nude mice as induced group(n=10).The complex that not induced were treated as negative control,named as un-induced group(n=4),while the chondrocytes-PGA/PLA complex were treated as positive control,named as chondrocyte group(n=4).After 4 and 8 weeks,the complex in each group was harvested for wet weight test,proteoglycan(GAG)content test,HE staining,Safranine-O staining and immunochemistry staining.ResultsAfter 4 and 8 weeks in vivo,the wet weight and GAG content in induced group were both higher than in un-induced group(P<0.05).In induced group,after cultured for 4 weeks in vivo,chondrocyte-like lacuna structure was observed by HE staining,uniform distribution of GAG was observed by Safranine-O staining,and positive expression of collagen typeⅡwas revealed by immunohistochemical staining.After 8 weeks of culturing in vivo,chondrocyte-like structure in induced group was more mature and more in line with the structure distribution of cartilage.ConclusionHSFBs combining with PGA/PLA had the potential to develop into polygonal chondrocyte-like tissue by the induction of CDMP 1.
Hypertrophic scar fibroblasts;Chondrocytes;Cartilage-derived morphogenetic protein 1; Transdifferention
Q813.1+2
A
1673-0364(2014)06-0324-05
2014年10月11日;
2014年11月6日)
10.3969/j.issn.1673-0364.2014.06.006
上海市科委自然科学基金(12ZR1416900)。
200011上海市上海交通大学医学院附属第九人民医院整复外科。
张艳(E-mail:13651817522@163.com)。
