利拉鲁肽对肥胖大鼠体质量、血脂水平和下丘脑炎症通路的影响研究
2014-02-03栗红蕊孙高洁王守俊郑州大学第一附属医院内分泌及代谢病科郑州450052
崔 岩,栗红蕊,孙高洁,王 姣,王守俊(郑州大学第一附属医院内分泌及代谢病科,郑州 450052)
利拉鲁肽对肥胖大鼠体质量、血脂水平和下丘脑炎症通路的影响研究
崔 岩*,栗红蕊,孙高洁,王 姣,王守俊#(郑州大学第一附属医院内分泌及代谢病科,郑州 450052)
目的:研究利拉鲁肽对肥胖大鼠体质量和血清中总胆固醇(TC)、甘油三酯(TG)水平及下丘脑炎症通路的影响。方法:取大鼠分别用基础饲料和高脂饲料喂养8周后,分为正常对照组、肥胖组、肥胖-利拉鲁肽组。正常对照组和肥胖组大鼠腹腔注射0.9%氯化钠注射液,肥胖-利拉鲁肽组大鼠腹腔注射利拉鲁肽100μg/kg,每日2次,连续8周。末次给药后隔夜禁食处死大鼠,称体质量,检测各组大鼠给药前和末次给药后血清中TC、TG水平和下丘脑细胞核因子κB(NF-κB)mRNA及细胞因子信号转导抑制因子3(SOCS-3)蛋白的表达。结果:与正常对照组比较,肥胖组大鼠体质量和血清中TC、TG水平及下丘脑NF-κB mRNA、SOCS-3蛋白表达水平均明显升高(P<0.01);与肥胖组比较,肥胖-利拉鲁肽组大鼠体质量和血清中TC、TG水平及下丘脑NF-κB mRNA、SOCS-3蛋白表达水平均较明显降低(P<0.01)。结论:利拉鲁肽能显著改善高脂诱导肥胖大鼠的体质量增加、血脂紊乱,其机制可能涉及下丘脑炎症调节通路的改善。
利拉鲁肽;肥胖;大鼠;下丘脑;细胞核因子κB;细胞因子信号转导抑制因子3
*硕士研究生。研究方向:肥胖与炎症的关系。电话:0371-66295062。E-mail:370482686@qq.com
#通信作者:主任医师,博士。研究方向:糖尿病的发病机制及防治。电话:0371-66295062。E-mail:wangshoujun02@126.com
近年来肥胖的发生率逐年上升,已经成为世界范围的公共卫生问题[1]。肥胖不仅是脂肪的过度积累,而且与2型糖尿病、动脉粥样硬化、高血压和脂肪肝等疾病的发生密切相关,其带来的心理社会问题也不容忽视[2]。因此,探索安全、有效、耐受性好、能够降低肥胖相关疾病风险的药物具有重要意义。新型降糖药物利拉鲁肽是一种胰高血糖素样肽1(GLP-1)受体激动药,其不仅具有葡萄糖浓度依赖性促进胰岛素释放、保护胰岛β细胞的功能[3],也具有抑制食欲及摄食、减轻体质量等作用,提示利拉鲁肽也可能使肥胖者受益[4]。近年研究发现,肥胖与炎症反应密切相关,表现为系统性的慢性低度炎症状态[5]。研究表明,基因型和高脂饮食诱导的肥胖大鼠下丘脑炎性反应较正常大鼠均明显增强,伴随中枢胰岛素抵抗,提示作为机体摄食及能量平衡的调控中枢,抑制下丘脑炎症信号通路对肥胖及其他代谢综合征的治疗具有重要意义[6-7]。Parthsarathy V等[8]发现利拉鲁肽具有神经系统保护作用,能够减轻阿尔茨海默病模型大鼠下丘脑中慢性炎症反应。郭南京等[9]研究也表明,利拉鲁肽可显著改善OLETF(Otsuka Long-Evans Tokushima Fatty)模型大鼠血清炎症指标。本实验应用利拉鲁肽对高脂喂养建立的肥胖大鼠模型进行干预,观察利拉鲁肽对肥胖大鼠体质量和血清中总胆固醇(TC)、甘油三酯(TG)水平及下丘脑炎症细胞核因子κB(NF-κB)mRNA及细胞因子信号转导抑制因子3(SOCS-3)蛋白的影响。
1 材料
1.1 仪器
-80℃低温冰箱(日本Sanyo公司);低温高速离心机(德国Eppendorf公司);美国UVP凝胶成像分析系统、电泳仪和电泳槽(北京六一仪器厂)。
1.2 药品与试剂
利拉鲁肽注射液(丹麦诺和诺德制药公司,批号:DP50185,规格:3m l∶18mg);基础饲料和高脂饲料(河南省动物实验中心);Trizol新型总RNA抽提试剂[宝生物工程(大连)有限公司];反转录和聚合酶链式反应(PCR)试剂盒(全式金生物技术有限公司);引物均由上海生工生物技术有限公司合成;兔抗大鼠SOCS-3抗体(美国Cell signaling technology公司);β-肌动蛋白(β-actin)抗体(北京博奥森公司);辣根过氧化物酶标记二抗(美国Bio-rad公司);大鼠TG、TC酶联免疫吸附(ELISA)试剂盒(美国RD公司)。
1.3 动物
5周龄健康清洁级SD大鼠48只,♂,体质量130~160 g,由河南省动物实验中心提供,使用许可证号:SCXK(豫)2010-0002。
2 方法
2.1 建模与分组[10-12]
将48只大鼠适应性喂养1周后,随机数字表法分为基础饲料组(n=8)和高脂饲料组(n=40)喂养8周。以基础饲料喂养的大鼠为正常对照组,将体质量大于正常对照组大鼠平均体质量+1.96倍标准差的高脂饲料喂养大鼠分为肥胖组和肥胖-利拉鲁肽组。正常对照组和肥胖组大鼠腹腔注射0.9%氯化钠注射液(生理盐水),肥胖-利拉鲁肽组大鼠腹腔注射利拉鲁肽100μg/kg[10],每日2次,连续8周。
2.2 标本采集
于实验前和实验开始第8、16周,观察各组大鼠活动、饮食情况和体质量。
于实验开始第8周末,各组大鼠过夜禁食12 h采集尾血,静置2 h,4℃、3 000 r/m in(离心半径100mm)离心15m in,分离血清,-80℃保存待测。16周末,各组大鼠隔夜禁食12 h后断头处死,收集全血,分离血清,-80℃保存;迅速分离下丘脑组织并置液氮冻存,待测。
2.3 ELISA法检测血清中TC、TG水平
采用ELISA法检测各组大鼠血清中TC、TG水平,步骤严格按照试剂盒说明进行操作,每组设置3个复孔。
2.4 下丘脑中NF-κBm RNA检测
取各组大鼠下丘脑组织约50mg,采用Trizol法提取下丘脑总RNA,检测RNA浓度及纯度,反转录得到cDNA,进行PCR反应。上下游引物分别为β-actin:5′-TGGAATCCTGTGGCATCCATGAAAC-3′、5′-TAAAACGCAGCTCAGTAACAGTCCG-3′,扩增片段长度349 bp;NF-κB:5′-GAGAGCCCTTGCATCCTTTA-3′、5′-CTTCCCTTTGGTCTTTCTGT-3′,扩增片段长度100 bp。NF-κB基因扩增条件为:94℃预变性5 m in;94℃变性30 s,56.4℃退火30 s,72℃延伸20 s,共35个循环;72℃10m in。扩增产物均进行2%琼脂糖凝胶电泳成像,目的条带与β-actin条带吸光度比值进行NF-κBmRNA表达半定量结果分析。
2.5 下丘脑中SOCS-3蛋白检测
配制裂解液为苯甲基磺酰氟(PMSF)-细胞组织快速裂解液(RIPA)(1∶99,现用现配)。取各组大鼠下丘脑组织50mg,加入500μl裂解液,置于高通量组织匀浆机匀浆,冰浴静置15 m in后取上清,BCA蛋白定量法测定蛋白浓度。取待测蛋白样品37.5μg,100℃5min使蛋白变性,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转移至硝酸纤维素膜上,封闭液室温封闭2 h,加入兔抗大鼠SOCS-3抗体,4℃孵育过夜,TBST缓冲液洗涤3次,加入辣根过氧化物酶标记二抗37℃孵育1 h,TBST缓冲液洗涤3次,磷酸盐缓冲液(PBS)洗涤1次,Image Studio Ver2.0软件测灰度值,计算其与β-actin的比值。
2.6 统计学处理
采用SPSS 17.0统计软件对所得数据进行统计处理,数据均以±s表示。两独立样本比较采用t检验,多组间比较采用方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
3 结果
3.1 基本情况
实验过程中,正常对照组大鼠活动好,饮食正常;肥胖组食欲旺盛,肥胖-利拉鲁肽组较肥胖组摄食减少,两组大鼠活动量均减少;至实验结束时未有大鼠死亡。
3.2 指标结果
实验前,基础饲料组与高脂饲料组大鼠的体质量比较差异无统计学意义(P>0.05)。实验开始8周末,将高脂饲料组大鼠中17只体质量是基础饲料组平均体质量+1.96倍标准差的大鼠分为肥胖组,肥胖发生率为42.5%。与基础饲料组比较,肥胖组大鼠体质量和血清中TC、TG水平均明显升高(P<0.05),结果见表1。
表1 大鼠不同时间体质量和血清中TC、TG水平比较(±s)Tab 1 Com parison of body weight and serum level of TC and TG atdifferent time(±s)
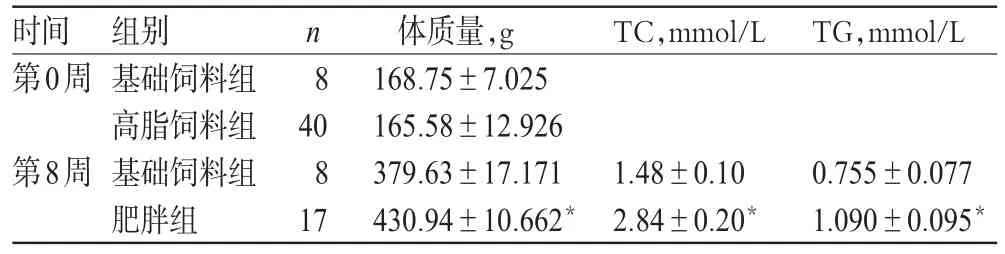
表1 大鼠不同时间体质量和血清中TC、TG水平比较(±s)Tab 1 Com parison of body weight and serum level of TC and TG atdifferent time(±s)
与基础饲料组比较:*P<0.01vs.normal controlgroup:*P<0.01
时间第0周n8 TC,mmol/L TG,mmol/L 0.755±0.077 1.090±0.095*第8周组别基础饲料组高脂饲料组基础饲料组肥胖组40 8 17体质量,g 168.75±7.025 165.58±12.926 379.63±17.171 430.94±10.662*1.48±0.10 2.84±0.20*
16周末,与正常对照组比较,肥胖组和肥胖-利拉鲁肽组大鼠体质量和TC、TG水平均明显升高(P<0.01);与肥胖组比较,肥胖-利拉鲁肽组大鼠体质量和TC、TG水平均明显降低(P<0.01),结果见表2。
表2 大鼠给药后体质量和血清中TC、TG水平比较(±s)Tab 2 Comparison of body weight and serum level of TC and TG aftermedicatio(n±s)
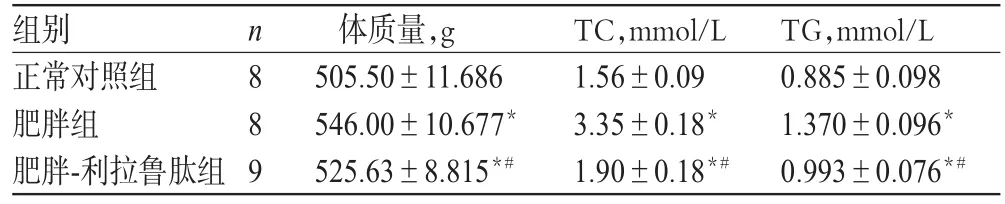
表2 大鼠给药后体质量和血清中TC、TG水平比较(±s)Tab 2 Comparison of body weight and serum level of TC and TG aftermedicatio(n±s)
与正常对照组比较:*P<0.01;与肥胖组比较:#P<0.01vs.normal controlgroup:*P<0.01;vs.obesity group:#P<0.01
组别正常对照组肥胖组肥胖-利拉鲁肽组TG,mmol/L 0.885±0.098 1.370±0.096*0.993±0.076*# n889体质量,g 505.50±11.686 546.00±10.677*525.63±8.815*# TC,mmol/L 1.56±0.09 3.35±0.18*1.90±0.18*#
3.3 下丘脑中NF-κBm RNA和SOCS-3蛋白表达
与正常对照组比较,肥胖组大鼠下丘脑中NF-κBmRNA和SOCS-3蛋白表达均明显升高(P<0.01);与肥胖组比较,肥胖-利拉鲁肽组大鼠下丘脑中NF-κBmRNA和SOCS-3蛋白表达均明显降低(P<0.01),电泳图见图1,结果见表3。
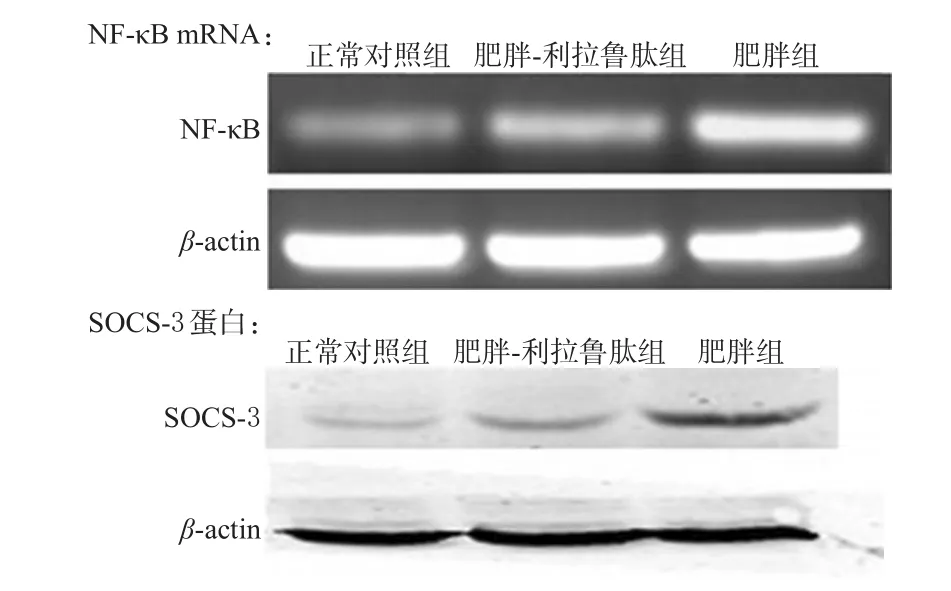
图1 大鼠下丘脑中NF-κBm RNA和SOCS-3蛋白表达电泳图Fig 1 Electrophoregram of the expression of NF-κB m RNA and SOCS-3 protein in hypothalamusof rats
表3 大鼠下丘脑中NF-κBmRNA及SOCS-3蛋白表达灰度值比较(±s)Tab 3 Com parison of the expression of NF-κB m RNA and SOCS-3 protein in hypothalamusof rat(±s)

表3 大鼠下丘脑中NF-κBmRNA及SOCS-3蛋白表达灰度值比较(±s)Tab 3 Com parison of the expression of NF-κB m RNA and SOCS-3 protein in hypothalamusof rat(±s)
与正常对照组比较:*P<0.01;与肥胖组比较:#P<0.01vs.normalcontrolgroup:*P<0.01;vs.obesity group:#P<0.01
组别正常对照组肥胖组肥胖-利拉鲁肽组SOCS-3/β-actin 0.103±0.021 0.569±0.031*0.228±0.032# n889 NF-κB/β-actin 0.151±0.061 0.591±0.048*0.375±0.031#
4 讨论
肥胖是机体脂肪堆积过多和(或)分布异常、体质量增加,是包括遗传、环境、心理因素等多种因素相互作用引起的慢性代谢性疾病。近年来,大量的研究发现肥胖个体通常伴随着炎性因子分泌的增加,呈现慢性低度炎症状态[5],IKKβ/NF-κB通路的激活发挥着重要的作用[13]。作为肥胖发生重要危险因素的高脂饮食可以与免疫系统交互作用,导致肥胖及相关代谢综合征炎性反应的发生。
GLP-1是肠道L细胞在进食后分泌的一种重要的肽类激素,具有优异的糖调节功能,在糖尿病治疗方面具有广阔的应用前景[14]。目前关于GLP-1能否缓解肥胖状态下丘脑炎症反应的研究较少,故本文研究了GLP-1长效类似物利拉鲁肽对肥胖大鼠体质量和血清中TC、TG及下丘脑炎症通路的影响。
下丘脑能够整合多种神经、内分泌、营养有关的信号,在调节代谢和维持能量平衡方面均具有重要功能[15]。肥胖状态下IKKβ/NF-κB通路的激活和SOCS-3等相关因子表达显著增加[16],可抑制下丘脑神经核团内胰岛素和瘦素信号转导,影响神经肽γ等多种神经内分泌激素的分泌及交感神经活性,引起食欲增加及机体能量消耗减少,从而加剧肥胖和相关代谢性疾病的发展[17]。而Hölscher C等[18]的研究表明,GLP-1能够穿过血脑屏障,其受体广泛分布于下丘脑,具有神经保护作用,可促进神经元的发生,抑制凋亡和氧化应激,减少退行性神经系统疾病神经元内空斑形成和慢性炎症反应。
本实验结果表明,利拉鲁肽能显著改善高脂诱导肥胖大鼠体质量增加、血脂紊乱,其机制可能涉及下丘脑炎症调节通路的改善。
[1] Sharma M,Branscum P.Novel and emerging approaches to combat adolescent obesity[J].Adolescent Health Medicine and Therapeutics,2010,1(9):9.
[2]Mehran AE,Templeman NM,BrigidiGS,etal.Hyperinsulinemia drives diet-induced obesity independently of brain insulin production[J].CellMetab,2012,16(6):723.
[3] 陈群峰,王永祥.利拉鲁肽临床研究进展[J].世界临床药物,2013,34(5):312.
[4] 马培奇.抗肥胖药物研究进展[J].上海医药,2013,34(5):52.
[5] 詹莉莉,杨志秋,傅正伟.肥胖与慢性炎症的研究进展[J].中国细胞生物学学报,2011,33(3):297.
[6]Zhang X,Zhang G,Zhang H.Hypothalamic IKKβ/NF-κB and er stress link overnutrition to energy imbalance and obesity[J].Cell,2008,135(1):61.
[7] Kleinridders A,Könner AC,Brüning JC.CNS-targets in control of energy and glucose homeostasis[J].Curr Opin Pharmacol,2009,9(6):794.
[8] Parthsarathy V,Hölscher C.The type 2 diabetes drug liraglutide reduces chronic inflammation induced by irradiation in themouse brain[J].Eur JPharmacol,2013,700(1/ 3):42.
[9] 郭南京,孙嘉,湛奕,等.利拉鲁肽对糖耐量异常大鼠血清炎症指标的影响[J].山东医药,2012,52(17):7.
[10] 洪涛,董艳华,涂晶,等.利拉鲁肽对肥胖大鼠胰岛素敏感性的影响[J].中国医药科学,2012,2(13):57.
[11] Liu JY,Liu Y,Chen L,et al.Glucagon-like peptide-1 analog liraglutide protects against diabetic cardiomyopathy by the inhibition of the endoplasmic reticulum stress pathway[J].JDiabetesRes,2013:630 537.
[12] 王晓珂.炎性反应与高脂饮食诱导的肥胖和胰岛素抵抗关系的研究[D].武汉:华中科技大学,2011:27.
[13] Li J,Tang Y,CaiD.IKKβ/NF-κB disruptsadulthypothalam ic neural stem cells to mediate a neurodegenerative mechanism of dietary obesity and pre-diabetes[J].Nat Cell Biol,2012,14(10):999.
[14] 母义明.基于肠促胰素治疗的药物比较:GLP-1类似物利拉鲁肽的临床优势[J].中华内分泌代谢杂志,2012,28(9):8.
[15] Velloso LA,Torsoni MA,Araujo EP.Hypothalam ic dysfunction in obesity[J].Rev Neurosci,2009,20(5/6):441.
[16] García-cáceres C,Yi CX,Tschöp MH.Hypothalam ic astrocytes in obesity[J].Endocrinol Metab Clin North Am,2013,42(1):57.
[17]Arruda AP,M ilanskiM,Coope A,etal.Low-grade hypothalamic inflammation leads to defective thermogenesis,insulin resistance,and impaired insulin secretion[J].Endocrinology,2011,152(4):1 314.
[18] Hölscher C.Potential role of glucagon-like peptide-1(GLP-1)in neuroprotection[J].CNS Drugs,2012,26(10):871.
Effects of Liraglutide on Body Weight,Serum Lipid and Hypothalam ic Inflamm atory Pathway in Obese Rats
CUIYan,LIHong-rui,SUN Gao-jie,WANG Jiao,WANG Shou-jun(Dept.of Endocrinology and Metabolic Disease,The First Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China)
OBJECTIVE:To study the effects of liraglutide on body weight,TC,TG and the expression of hypothalam ic inflammatory pathway in obese rats.METHODS:Rats were given basal feed and high-fat diet;8 weeks later,they were divided into normal control group,obesity group and obesity-liraglutide group.Normal control group and obesity group were given 0.9%Sodium chloride injection intraperitoneally,and obesity-liraglutide group was given liraglutide 100μg/kg tw ice a day for consecutive 8 weeks.Rats were sacrificed after fasting overnight follow ing last adm inistration to weigh body weight.The levels of TC and TG in serum,the expression of NF-κB mRNA and SOCS-3 protein were detected beforemedication and after lastmedication.RESULTS:Compared w ith normal control group,body weight,the levels of TC and TG in serum,the expression of NF-κB mRNA and SOCS-3 protein were increased significantly in obesity group(P<0.01);compared w ith obesity group,above index of obesity-liraglutide group were decreased significantly(P<0.01).CONCLUSIONS:Liraglutidemay significantly improve the increase of body weight and dyslipidem ia in high-fat diet induced obese rats,and themechanism m ight be associated w ith the improvement of hypothalamic inflammatory pathways.
Liraglutide;Obesity;Rats;Hypothalamus;NF-κB;SOCS-3
R965
A
1001-0408(2014)17-1571-03
DOI 10.6039/j.issn.1001-0408.2014.17.11
2013-12-10
2014-02-13)
·药房管理·
