体素内不一致运动磁共振成像后处理中单指数和双指数模型的比较
2014-01-30王丽雯常飞燕
王丽雯 谢 晟* 王 蕾 常飞燕 王 武
体素内不一致运动MRI(intravoxel incoherent motion-MRI,IVIM-MRI)是近年来新发展的一种磁共振成像技术,实际上就是通过特殊的弥散加权成像(diffusion weighted-imaging,DWI)序列在体素水平分离出“扩散”和“灌注”这两种因素[1-2]。该技术可以在一定水平上反映出组织的灌注情况。前期研究表明,IVIM的测量指标要明显优于传统的DWI[3-4]。IVIM的后处理模型有多种,其中常用的选择包括单指数模型和双指数模型。本研究通过测量普通病例组中正常脑组织和转移瘤中的IVIM参数,分析评价这两种模型测量的一致性。
1 资料与方法
1.1 一般资料
选取在中日友好医院行颅脑核磁共振增强扫描确定脑内无病灶的患者30例(普通病例组)及转移瘤患者30例(转移瘤组)进行IVIM和灌注加权成像(perfusionweighted imaging,PWI)扫描。普通病例组患者中男性14例,女性16例;年龄13~78岁,平均年龄为49.3岁。其中包括垂体瘤2例,脑膜瘤5例,未见明显异常强化灶19例,听神经鞘瘤1例,桥前池表皮样囊肿1例。磁共振平扫及增强扫描显示除局灶性肿瘤本身外,其余脑实质均未见异常。转移瘤组患者中男性18例,女性12例,年龄39~88岁,平均年龄为58.5岁。临床确诊为脑转移瘤的病例,其中肺癌转移24例,乳腺癌转移3例,结肠癌转移3例。
1.2 MR检查方法
应用美国GE 3.0T Discovery750磁共振扫描仪和8通道相控阵头颅线圈对患者进行头颅MRI扫描。普通病例组及转移瘤组均进行了磁共振头颅平扫及增强扫描,序列包括:轴位T1WI FLAIR序列(TR 1750 ms,TE 24 ms,矩阵384×320,NEX=1),轴位及矢状位T2WI序列(TR 7411ms,TE 94 ms,矩阵512×512,NEX=1),IVIM序列(扫描参数为:TR 6000 ms,TE 91.2 ms,矩阵192×192,NEX=1,b值分别取0、50 s/mm2、100 s/mm2、150 s/mm2、200 s/mm2、300 s/mm2、500 s/mm2、1000 s/mm2、1500 s/mm2、2000 s/mm2和3000 s/mm210个值,扫描时间共4 min 6 s)。常规平扫后患者均进行了磁共振增强头颅扫描。应用高压注射器按照2.0 mmol/kg的剂量以3.0 ml/s的速率套管经肘前静脉团注造影剂钆喷葡萄酸胺(Gd-DTPA),随后以相同速率注射生理盐水20 ml冲洗残留在血管内的对比剂。PWI应用EPI序列,TR/TE/FA(1500 ms/80 ms/60o),层厚5 mm,连续扫描60次,扫描时间为90 s。随后进行增强T1WI FLAIR序列扫描(矢状位、横轴位、冠状位)。所有序列FOV均为24 cm×24 cm,层厚及间隔为5.0 mm,1.5 mm。20层覆盖全脑。
1.3 数据分析
IVIM序列原始图像在AW VolumeShare 4工作站上,利用Funtool软件进行图像后处理,利用单指数模型可得到慢速扩散表观扩散系数(apparent diffusion coefficient,ADC)值(slow ADC mono)、快速扩散ADC值(fast ADC mono)、快速扩散ADC值分数(Ff mono),利用双指数模型可得到慢速扩散ADC值(slow ADC Bi)、快速扩散ADC值(fast ADC Bi)、快速扩散ADC值分数(Ff Bi)。PWI序列原始图像后处理得到血流量(cerebral blood flow,CBF)图和血容量(cerebral blood volume,CBV)图。在各个参数图上测取不同脑组织结构(包括双侧额叶、顶叶、颞叶、枕叶及半卵圆中心白质)感兴趣区域(region of interest,ROI)的值(如图1所示)。
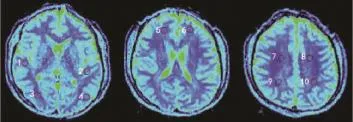
图1 头颅IVIM参数测量的ROI放置位置
所有ROI均为圆形,在普通病例组中面积约为90 mm2。在转移瘤组病例中,通过增强扫描后的图像确定转移瘤的病灶大小及位置,在对应的IVIM后处理图像上设置相应的ROI。测量时避开静脉窦、外周血管、脑脊液及部分容积效应,保持测量时ROI位置一致。
1.4 统计学方法
利用SPSS 17.0统计学软件,计量资料用均数±标准差。在普通病例组中,对两种模型所测得的值分别进行变异度计算;并对两种模型的测量参数分别进行配对t检验、绘制两种模型参数的Bland-Altman图。在转移瘤组中,绘制两种模型参数的Bland-Altman图。在普通病例组中,用Pearson法对所有ROI的两种模型的测量参数分别与CBF,CBV绝对测量值做相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 普通病例组分析结果
在普通病例组中,共测量10个ROI,各参数测量数据见表1。

表1 30例普通病例组中ROI各参数测量值
普通病例组ROI的CBF值为(32.90±24.46) ml/min·100g-1,CBV为(3.44±2.16)ml/100 g。
普通病例组的单指数模型、双指数模型各测量指标的各个ROI的变异度及所有ROI的总体变异度见表2。
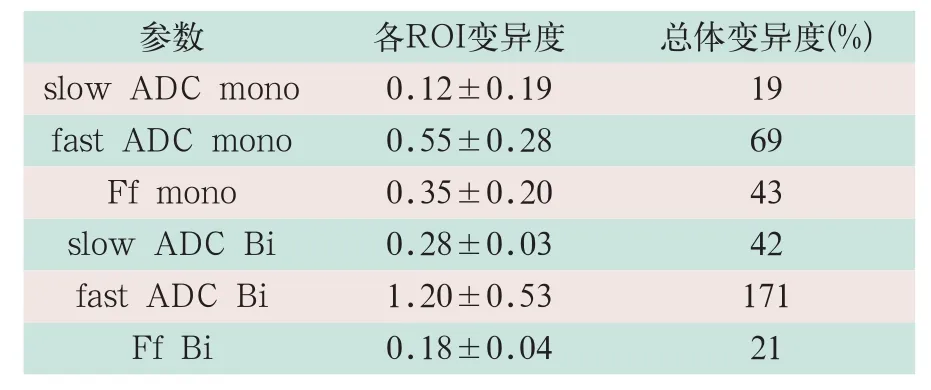
表2 30例普通病例组中ROI各参数测量值的变异度
单指数模型slow ADC mono与双指数模型slow ADC Bi的测量值进行配对t检验,差异有统计学意义(t=26.37,P=0.00)。单指数模型fast ADC mono与双指数模型fast ADC Bi进行配对t检验,差异有统计学意义(t=-5.93,P=0.00)。单指数模型Ff mono与双指数模型Ff Bi做配对t检验,差异有统计学意义(t=-17.05,P=0.00)。
将两种模型的3种参数测量值分别进行Bland-Altman绘图(如图2、图3、图4所示)。
以SlowADC为例,即以均值(slow ADC mono值+slow ADC Bi值)/2为横坐标、差值slow ADC mono值-slow ADC Bi值为纵坐标生成散点图。并在图形区域内加三条横线从上到下依次为Mean+1.96SD、Mean和Mean-1.96SD,即差值slow ADC mono值-slow ADC Bi值的均数及差值的95%分布范围(即为一致性界限,LoA,mean±1.96SD)。其中单指数模型slow ADC mono值与双指数模型slow ADC Bi值的Bland-Altman绘图中有14个点位于LoA范围外面,表明slow ADC mono值与slow ADC Bi值的一致性较好。(95%的点在LoA范围内,认为两种方法一致性好)。单指数模型fast ADC mono值与双指数模型fast ADC Bi值的Bland-Altman绘图中有10个点位于LoA范围外面,表明fast ADC mono值与fast ADC Bi值的一致性较好。单指数模型Ff mono值与双指数模型Ff Bi值的Bland-Altman绘图中有6个点位于LoA范围外面,表明Ff mono值与Ff Bi值的一致性好。

图2 普通病例组slow ADC mono值与slow ADC Bi值的Bland-Altman图

图3 普通病例组fast ADC mono值与fast ADC Bi值的Bland-Altman图
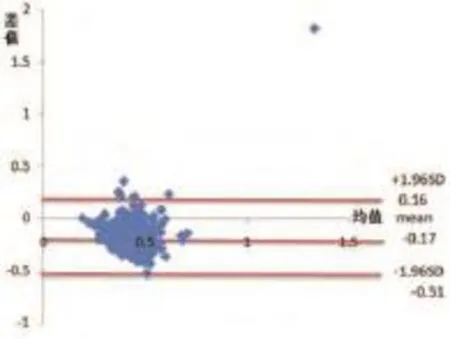
图4 普通病例组Ff mono值与Ff Bi值的Bland-Altman图
2.2 转移瘤组分析结果
转移瘤共测量30个病灶,各指标的测量数据各有30个。转移瘤ROI的slow ADC、fast ADC测量值见表3。
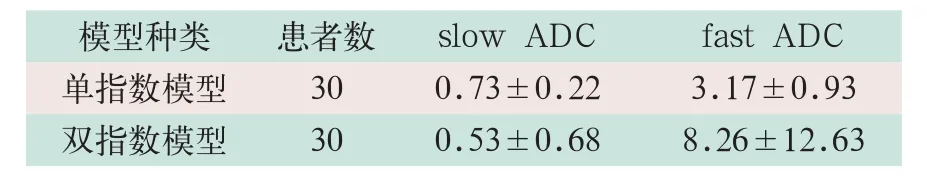
表3 转移瘤ROI各参数测量值(×10-3mm2)
各参数测量值的Bland-Altman图结果显示,双指数模型与单指数模型参数之间的一致性好。
2.3 普通病例组IVIM各指标与PWI指标之间的相关性分析
将普通病例组中的30个ROI的单指数模型与双指数模型的各测量指标与CBF及CBV绝对值进行泊松相关分析,结果显示:①单指数模型fast ADC mono、Ff mono与CBF的相关系数为(r=0.145,r=0.182,P<0.05)呈显著正相关;②单指数模型fast ADC mono、Ff mono与CBV的相关系数为(r=0.226,r=0.123;P<0.05)呈显著正相关;③双指数模型fast ADC Bi、Ff Bi与CBF的相关系数为(r=-0.037,r=-0.21;P<0.05),其中Ff Bi与CBF在0.05水平上呈显著负相关;④双指数模型fast ADC Bi、Ff Bi与CBV的相关系数为(r=0.099,r=-0.246;P<0.05),其中Ff Bi与CBV在0.05水平上呈显著负相关。
3 讨论
由于DWI技术独特的运动敏感对比度,已成为常规MRI成像技术的重要补充。IVIM的概念最早由Le Bihan等[5]提出,微循环中血液的运动可以看作是一个类似扩散的过程,其扩散敏感因子为b,在低b值(<200 s/mm2)的条件下可以测量。在运用足够多的b值进行扩散信号的采样、以及应用双指数拟合分析,可以分开组织的扩散和微循环相关的扩散,从而得到可测量的微循环的效应。IVIM的另一优点是,只要b值的分布合理,其测量参数就不再受b值的影响[6]。目前,IVIM在临床上已被广泛应用于各个脏器,并且被证明能够用来分析灌注对于扩散的贡献[7-8]。
传统的DWI通过ADC这一定量参数对组织内水分子的扩散情况进行定量检测,其数学模型为单指数模型(公式1)[8]:
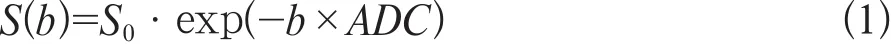
式中S(b)为扩散加权信号强度;S0为不施加扩散梯度时的信号强度;b为扩散敏感因子,与施加的扩散梯度场强、持续时间和时间间隔有关。
单指数模型是目前临床工作中最常用的定量检测组织内水分子扩散情况的方法,确实可以解决很多临床问题,然而,在很多情况下,特别是在高度不均质的组织内部,扩散加权信号实际上是呈多指数衰减方式进行,尤其当b值范围较大时更是如此。有文献报道相比于单指数模型,双指数模型可以更好地描述这种复杂的信号衰减方式[9-10]。
双指数模型假设在一个成像体素内同时存在着快速扩散质子池和慢速扩散质子池两种成分(公式2):
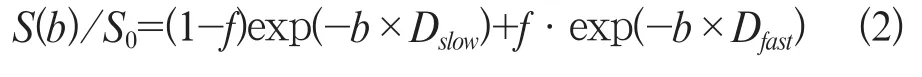
式中f为快速扩散质子池的容积率,Dfast和Dslow为相应的快速和慢速扩散系数。
有文献比较了单指数模型和双指数模型在疾病中的应用,指出双指数模型具有更高的准确性[11-12]。这些文献中的单指数模型通常被用于双b值(b=0和其他值)的数据处理,和本研究中IVIM的单指数模型之间存在较大差异。本研究探讨IVIM数据后处理所使用的单指数模型和双指数模型之间的差别。在Functool软件中,应用单指数模型时,IVIM采集的数据被分为高b值部分(通常b>200 s/mm2),用来拟合慢速扩散ADC,而低b值的部分被单纯用作拟合快速扩散ADC;而在应用双指数模型时,高b值部分数据的曲线被认为是单指数衰减,经过简单的线性拟合即得到慢速扩散ADC和容积率,将其代入低b值数据进行公式(2)的求解,快速扩散ADC也就很容易得到了。但是需要注意的是,如果为了精确求解公式(2),需用Marquardt-Levenberg算法,使用该算法需要预先设定初始值,不适当的初始值会导致拟合失败或者陷入局部最小值而得到错误的结果,需要拟合的变量越多,初始值的设定越困难[13]。为了使结果更加稳定,在临床应用中设定扩散与灌注的ADC有数量级的差别,采取以上所述双指数模型的简化办法求解,因此存在着许多未知的影响因素[14]。
本研究首次比较了商业化软件Functool提供的两种模型,为临床应用提供参考。本研究的结果表明,单指数模型和双指数模型计算得到的参数具有较好的一致性,从Bland-Altman图中可以得到证明。Bland-Altman图是一种较为全面评价一致性的统计学方法,其同时考虑到数据集中趋势、离散趋势以及相关性[15]。但配对t检验的结果显示,单指数模型和双指数模型得到的数据相差很大,因此不能互相替代。如果在临床上应用,设置正常对照组的情况下,正常对照组的数据变异度越小越好,因此单指数模型得到的参数变异度小于双指数模型,因而在临床上应用更加有优势。此外,IVIM参数尤其Fast ADC,在普通病例组中较大的变异度也说明脑组织的微循环扩散在不同的区域,不同的人群中差别较大,与CBF一样,设置正常值范围不可行,国外在前列腺的研究中同样发现了类似问题[16]。因此,在研究设计时只能选择在个体中病变与对侧进行参数测量值的比较。
PWI是一种依赖于血管内造影剂T2*缩短效应的磁共振技术,因此也被称为动态磁敏感对比增强成像。但由于该技术采集的数据MRI信号强度与造影剂浓度是非线性,因此灌注图像不是绝对定量的,需要应用信号时间曲线估计出ROI的局部CBV和CBF。IVIM中得到的Fast ADC与局部的血流灌注虽然有关,但毕竟不是真正的脑血流量[17]。因此,单指数模型得到的Fast ADC和Fast ADC分数虽然只与CBV和CBF有很弱的正相关,但结果合理;而双指数模型参数与CBV和CBF表现为负相关,明显不合理。从双指数模型计算得到的参数图来分析,其信噪比差,因此测量误差很大,不适合临床应用。由于在转移瘤中PWI得到的CBF与CBV测量的变异范围非常大,不适合进行绝对定量的分析,通常在临床应用肿瘤区域与对侧脑组织的测量比值,因此本研究未进行转移瘤IVIM指标与CBF及CBV绝对值的相关分析。
综上所述,通过对IVIM后处理的单指数模型和双指数模型的测量比较分析发现,尽管单指数模型和双指数模型的参数测量上有较好的一致性,但在正常脑组织中单指数模型测量的变异度较小,Fast ADC与PWI的测量参数CBV和CBF间的相关性较为合理,因此在临床应用中更具有优势。
[1]Yamada Il,Aung W,Himeno Y,et al.Diffusion coefficients in abdominal organs and hepaticlesions:evaluation with intravoxel incoherent motion echo-planar MR imaging[J].Radiology,1999,210(3):617-623.
[2]彭雯佳,陈士跃,陆建平,等.双指数衰减表观扩散系数对大鼠超急性期脑缺血的评价[J].影像诊断与介入放射学,2012,21(1):61-66.
[3]Mulkern RV,Vajapeyam S,Robertson RL,et al.Biexponential ap parent diffusion coefficient parametrization in adult vs newborn brain[J].Magn Reson Imaging,2001,19(6):659-668.
[4]李玉华,陆建平,段秀杰,等.多b值DWI在儿童脑肿瘤中的初步研究[J].放射学实践,2012,27(2):159-163.
[5]Le Bihan D,Breton E,Lallemand D,et a1.Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging[J].Radiology,1988,168(2):497-505.
[6]Koh DM1,Collins DJ,Orton MR.Intravoxel incoherentmotion in body diffusion-weighted MRI:reality and challenges[J].AJR Am J Roent genol,2011,196(6):1351-1361.
[7]Lemke A,Laun FB,Simon D,et al.An in vivo verification of the intravoxel incoherent motion effect in diffusion-weighted imaging of the abdomen[J].Magn Reson Med,2010,64(6):1580-1585.
[8]Chandarana H,Lee VS,Hecht E,et al.Comparison of biexponential and monoexponential model of diffusion weighted imaging in evaluation of renal lesions:preliminary experience[J].Invest Radiol,2011,46(5):285-291.
[9]Mulkern RV,Gudbjartsson H,Carl—Fredrik W,et a1.Multi—component apparent diffusion coefficients in human brain[J].NMR Biomed,1999,12(1):51-62.
[10]Mulkern RV,Zengingonul HP,Robertson RL,et a1.Multi—component apparent diffusion coefficients in human brain:Relationship to spin-lattice relaxation[J].Magn Reson Med,2000,44(2):292-300.
[11]Clark CA,Hedehus M,Moseley ME.In vivo mapping of the fast and slow diffusion tensors in human brain[J].Magn Reson Med,2002,47(4):623-628.
[12]Maier SE,Bogner P,Bajzik G.Normal brain and brain tumor:multi-component apparent dilfusion coefficient line scan imaging[J].Radiology,2001,219(3):842-849.
[13]Sukstanskii AL,Yablonskiy DA.Effects of restricted diffusion on MR signal formation[J].Magn Reson,2002,157(1):92-105.
[14]Luciani A,Vignaud A,Cavet M,et al.Liver cirrhosis:intravoxel incoherent motion MR imaging—pilot study[J].Radiology,2008,249(3):891-899.
[15]萨建,刘桂芬.定量测量结果的一致性评价及Bland-Altman法的应用[J].中国卫生统计,2011,8(4):409-411.
[16]Riches SF,Hawtin K,Charles-Edwards EM,et al.Diffusion-weighted imaging of the prostate and rectal wall:comparison of biexponential and monoexponential modelled diffusion and associated perfusion coefficients[J].NMR Biomed,2009,22(3):318-325.
[17]Wang Z,Su MY,Najafi A,et al.Effect of vasodilator hydralazine on tumor microvascular random flow and blood volume as measured by intravoxel incoherent motion(IVIM)weighted MRI in conjunction with Gd-DTPA-Albumin enhanced MRI[J].Magn Reson Imaging,2001,19(8):1063-1072.
