番茄抗病基因TY-3的SCAR标记及检测
2014-01-28张子君刘文奇李海涛马小青邹庆道
张子君,刘文奇,李海涛,马小青,邹庆道
(辽宁省农业科学院,辽宁沈阳110161)
番茄(Solanum lycopersicum)是世界上栽培最为广泛的蔬菜之一。番茄黄化曲叶病毒病(TYLCVD)是近年来我国番茄生产上严重发生的一种新病害,该病害在山东、河北等番茄主栽区发病严重,有着从南往北逐步扩展的趋势,海城等辽南地区已有该病出现。该病害由烟粉虱传播、由双生病毒侵染引起的病毒病,受害植株叶片黄化、矮缩、坐果率降低,给番茄生产造成严重的损失。除农药防治外,应用抗病品种是防治该病害经济有效的防控措施[1-4]。
随着分子生物学技术的不断深入研究,获得与抗病基因紧密连锁的分子标记对促进番茄抗病育种有着重要意义。SCAR标记方便、快捷、可靠,可以快速检测大量个体,结果稳定性好,重复性高,与传统育种相比,这种方法几乎不受外界环境的影响,尤其是针对一些遗传力较低,易受环境影响的性状,其可靠性大大提高[9]。Ji等[5]利用F2分离群体进行遗传分析和QTL定位后,将抗病基因Ty-3定位到6号染色体的长臂上,距离Ty-1基因位点约20 cM,该位点的显性与加性比率是0.47,且是主效基因。与Ty-3连锁的SCAR标记P6-25是可用来鉴定等位基因Ty-3、Ty-3a和Ty-3b的共显性标记,且目前正被广泛研究[6]。
该研究为获得与抗病基因Ty-3紧密连锁的分子标记,建立抗病基因Ty-3快速、准确的分子检测体系,从分子水平为番茄黄化曲叶病毒病抗病育种提供技术指导。
1 材料与方法
1.1 材料
3份抗病纯和材料(Ty-3/Ty-3)来自台湾亚蔬中心,编号为 CK1、CK2、CK3;3 份感病材料(ty-3/ty-3)来自辽宁省农业科学院蔬菜所番茄课题组,编号为 CK4、CK5、CK6;抗病 F1代杂交种 7 份,均来自上海种都公司,编号为29(迪达),30(迪瑞),31(TY4220),32(迪维斯),33(齐达利),34(TY4430),35(TY1415),这7份杂交种在2011年上海召开的“全国抗黄化曲叶病毒病品种展示会”上均表现抗病;F2代单株28份,编号为100-127,为经济性状优良的33号杂交种齐达利自交分离后代。
1.2 方法
1.2.1 特异引物的设计。抗病基因Ty-3SCAR标记的引物序列,参照付蓉蓉等[7]设计,交由上海生物工程技术公司合成(表1)。
1.2.2 DNA提取。DNA提取采用改良CTAB法,具体方法及步骤参照邱夷鹏等[8]。

表1 引物序列
1.2.3 PCR扩增体系及反应程序。
该引物的PCR反应总体积为25 μL,模板50 ng,dNTP 1.25 μL,引物(10 U)各 1.0 μL,Taq DNA 聚合酶 (2.5 U/μL)0.5 μL,buffer 2.0 μL,Mg2+1.2 μL。PCR的反应程序为:94℃预变性5 min,94℃变性1 min,55℃退火 1 min,72℃延伸 1 min,35个循环;最后72℃延伸10 min。电压5 V/cm下PCR产物利用2.0%琼脂糖凝胶电泳30 min,Goodview染色,Bio-RAD凝胶成像系统拍照。
2 结果与分析
2.1 获得与Ty-3基因紧密连锁的SCAR标记
从图1可以看出,利用特异引物对6份抗、感材料进行PCR扩增,3份抗病纯合材料CK1、CK2和CK3扩增获得600 bp片段,3份感病材料CK4、CK5和CK6获得320 bp片段。

图1 6份材料的PCR扩增图谱
2.2 7份抗病杂交种Ty-3基因的检测
如图2所示,在7份F1代杂交种中,编号为30、31、32、33的4份杂交种经PCR扩增获得600 bp和320 bp两条带,说明这4份材料为含有Ty-3抗病基因的杂交种,编号为29、34、35的3份材料经PCR扩增后获得320 bp大小的片段。

图2 7份抗病番茄F1的PCR扩增图谱
2.3 28份F2代单株抗病基因Ty-3的检测
从图 3 可以看出,101、103、104、106、111、112、113、114、115、116、120、121、125 的 13 个单株 PCR扩增后产生600 bp和320 bp两条带,说明这13份材料为抗Ty-3的杂合体(Ty-3/ty-3);编号为107、110、119、123、124、126、127 的 7 个单株 PCR 扩增后只产生600 bp的一条带,说明这7个单株为含有抗病基因的的纯合体(Ty-3/Ty-3);编号为 100、102、105、108、109、117、118、122 的 8 个单株 PCR 扩增后只产生320 bp的1条带,说明这8份材料不含抗病基因Ty-3,为感病纯合材料(ty-3/ty-3)。
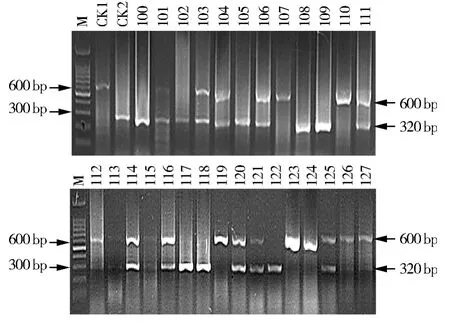
图3 番茄F2材料的PCR扩增图谱
3 结论与讨论
试验利用1个已获得的与番茄黄化曲叶病毒病抗病基因Ty-3紧密连锁的SCAR标记,有效检测到番茄黄化曲叶病毒病抗病基因Ty-3。利用该标记对7个田间表现抗病的番茄F1代杂交种进行检测,其中4个检测结果与田间的抗病表现相一致,另外3个杂交种没有检测到抗病基因Ty-3,但这3份杂交种在2011年上海种都举办的抗TY品种展示会上均表现抗病,由此推测这3份杂交种可能不含Ty-3抗病基因,但有可能含Ty-1、Ty-2或其他抗病基因,因此在田间也表现出抗病性;利用标记对来自抗病杂交种齐达利的28个F2代分离单株进行检测,结果表明,有20个单株含有抗病基因Ty-3,抗病纯合体7株,抗病杂合体13株,8个单株不含抗病基因,由于试验检测的F2单株数量较少,所得的数据只能为抗病材料的选择提供依据,尚不能对抗病基因的遗传规律进行深入分析,还需进一步对所获得结果进行抗性鉴定。
分子标记辅助选择育种(MAS)现已成为作物育种的有力辅助工具,不仅提高了性状选择的准确性,同时也加快了常规育种的进程,分子育种技术与常规育种技术的有机结合,是今后育种的方向。
[1]岳宁,丁铭,董家红,罗延青,等.中国番茄黄化曲叶病毒在云南的发生分布及其遗传多样性 [J].云南大学学报(自然科学版),2008,30(S1):57-62.
[2]赵统敏,余文贵,周益军,等.江苏省番茄黄化曲叶病毒病(TYLCD)的发生与诊断初报[J].江苏农业学报,2007,23(6):654-655.
[3]王冬生,匡开源,袁永达,等.番茄黄化曲叶病毒在上海发生流行的初步观察[J].上海蔬菜,2007,(4):61-62.
[4]吴永汉,张纯胄,许方程,等.温州地区番茄曲叶病毒病发生与防治[J].中国蔬菜,2007,(5):57-58.
[5]Ji Y,Schuster D J,Scott J W.Ty-3,a begomovirus resistance locus near the Tomato yellow leaf curl virus resistance locus Ty-1 on chromosome 6 oftomato [J].MolecularBreeding,2007,20:271-284.
[6]Maxwell D P,Martin C,Salus M S,et al.Breeding tomatoes for resistance to tomato-infecting begomoviruses[EB/OL].International Plant Virology Laboratory University of Wisconsin-Madison.2006,http://www.plantpath.wisc.edu/Geminivirus Resistant Tomatoes/index.htm.
[7]付蓉蓉,刘杨,陈火英.番茄黄化曲叶病的Ty-1和Ty-3抗性基因的 PCR 鉴定[J].分子植物育种(网络版),2011,(9):1647-1652.
[8]邱夷鹏,李海涛,张子君,等.番茄抗晚疫病基因Ph-3的RAPD标记[J].园艺学报,2009,36(8):1227-1232.
[9]邹庆道,吴媛媛,李海涛,等.番茄抗晚疫病Ph-3基因RAPD标记的克隆与 CAPS 标记的建立[J].植物病理学报,2010,41(3):314-318.
