七里海湿地植物种间关系的数量分析
2014-01-26李兰兰莫训强李洪远
李兰兰,许 诺,莫训强,李洪远
种间关联指不同的物种在空间分布上的相互关系,通常是因为群落生境的差异影响了物种分布引起的[1-2]。种间关联包括种间联结性和相关性两方面。种间联结是以物种的存在与否为依据,得到二元数据作为两个物种出现的相似性尺度,是定性的表达;而种间相关还涉及数量的对比关系,是定量的体现[3]。研究种间关联不仅可揭示植物对生境变化的响应和植被的演替机制[4],还可推测群落的演替动态和趋势,从而为植物群落的保护和物种资源的优化利用等提供依据。
针对种间关系的研究,国外有学者运用χ2检验[5]和方差比值法[6]测定物种间联结关系,也有学者研究植物种间关系及其随时间的动态变化[7-8]。在国内,学者们对不同植被类型的优势种种间的联结性做了许多工作,有对亚热带常绿阔叶、落叶阔叶混交林[9]、亚热带常绿阔叶林[10]、热带山地雨林[11]、温带针阔混交林[12]、暖温带落叶阔叶林[13]等山地森林植物群落种间关系的研究,也有对草原植物群落[14]和湿地植物群落[15]种间关系的研究。七里海湿地是天津古海岸与湿地国家级自然保护区的一部分,是典型的古泻湖湿地。
针对七里海湿地的研究主要集中在湿地环境演变[16]、生态系统退化与生态修复[17]、湿地价值评估[18]以及七里海动物多样性[19-20]等方面,而缺乏对七里海植被的相应研究,本研究在野外调查的基础上,对七里海湿地植物群落主要物种的种间关系进行研究,以期为湿地植物的有效保护和利用提供科学依据。
1 研究区与研究方法
1.1 研究区概况
七里海湿地(39°16′—39°19′N,117°27′—117°38′E)地处天津市东部、宁河县西南部,与滨海新区接壤,距北京市130km,距天津市40km,距渤海15km,有俵口、七里海、淮淀、潘庄和造甲城5个乡镇环抱,是天津市古海岸与湿地国家级自然保护区的重要组成部分,属典型的古泻湖湿地生态系统。七里海湿地的中间及东西两侧有潮白河、蓟运河和永定河3条大河流过,其中潮白新河将其分为东七里海和西七里海两个部分。七里海总面积9 500hm2,平均海拔高度2m,其中核心区面积4 800hm2,缓冲区面积4 700hm2。
七里海湿地属于冲击—海积平原的大型古泻湖洼地,地势低平,坡降小于2/10 000,泻湖的海拔高程为2~2.4m,地质构造单元属新华夏构造体系第二沉降带的华北沉降带北部,土壤类型主要为沼泽土,其次是盐化湿潮土。综合区划属暖温带半旱生落叶阔叶林地带(亚湿润)华北平原区[17]。七里海湿地的区域气候属暖温带半干旱湿润季风型,四季分明。年均降水量500~600mm,受季风影响,80%左右的降水量集中在6—8月份,干旱季节明显。年均气温11.2℃,最低月平均气温5.3℃,出现在1月份;最高月平均气温25.7℃,出现在7月份,平均温差31.5℃。
七里海湿地植物的地理区系组成以世界广布属、泛热带成分和北温带、旧世界温带成分为主,湿地植被在物种组成上以菊科(Compositae)、禾本科(Gramineae)、旋花科(Convolvulaceae)、藜科(Chenopodiaceae)等为代表的草本植物为主。乔木和灌木的种类偏少,只有柽柳(Tamarix chinensis)、酸枣(Ziziphus jujuba)、达乌里胡枝子(Lespedeza davurica)、枸杞(Lycium chinense)4 种,其余的均为栽培种。
1.2 研究方法
1.2.1 样地调查 于2012年8—10月进行七里海湿地植被的调查,选择东、西七里海核心区和缓冲区考察样地,采取典型取样法进行植被群落调查,共选取了158个样方,样方大小为1m×1m。记录每个样方的经纬度和高程,并记录群落内各物种种类、数量、高度、覆盖度等特征。在调查的158个样方内,共出现290个物种,选取出现频率>5%的40个物种进行了种间联结性分析(表1)。
1.2.2 种间联结性 种间联结一般采用χ2检验进行定性研究,将40种主要植物是否在158个标准样方中出现转化为158×40的0,1二元数据矩阵,0表示物种在样方中未出现,1表示出现。依据上述原始数据矩阵,构造780个种对的定性数据列入2×2联列表,计算出a,b,c,d的值。由于取样为非连续性取样,因此采用非连续性数据χ2值的Yates的连续校正公式计算:
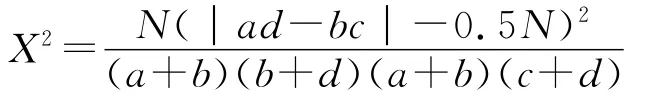
式中:N——取样总数;a——2个种均出现的样方数;b——物种B出现而物种A不出现的样方数;c——物种A出现而物种B不出现的样方数;d——两个物种均不出现的样方数。当ad>bc时为正联结,ad<bc时为负联结,ad=bc时无联结。若X2<X20.05(1)〔X20.05(1)=3.841〕,为关联不显著;若 X20.05(1)<X2<X20.01(1),为关联显著;若 X2>X20.01(1)〔X20.01(1)=6.635〕,为关联极显著。
1.2.3 Spearman秩相关分析 为了使测定结果更加准确,就需要使用数量数据,其中较为常用的是Spearman秩相关分析。本文Spearman秩相关系数检验是采用野外考察数据的秩的大小判断,属于非参数检验,不需要知道原始数据服从于何种分布。采用物种的重要值作为定量数据,通过SPSS 17.0软件完成。

表1 七里海湿地自然保护区40种主要植物及频度
重要值计算公式为:
重要值=(相对盖度+相对频度+相对密度)/3
相对盖度=(某一种的盖度/所有种的盖度之和)×100%
相对频度=(某一种的频度/所有种的频度之和)×100%
Spearman秩相关系数计算公式为:
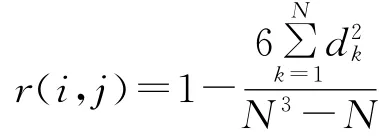
式中:r(i,j)——Spearman秩相关系数;N——样方数;dk=xik-xjk,〔xik,xjk——物种i与物种j在样方k中的秩(重要值)〕。
2 结果和分析
2.1 关联性分析
依据校正后的χ2检验公式,可计算得到研究区内40种主要植物的种间联结半矩阵图,结果表明呈正联结的有357对,占总对数的45.77%,呈负联结的有423对,占总对数的54.23%;正负关联比为0.84。χ2检验的显著率(包含显著与极显著水平)为8.46%,其中正联结显著率为5.77%,极显著正联结种对数为15对,显著正联结种对数为30;负联结显著率为2.69%,极显著负联结种对数为8对,显著负联结种对数为13。可见虽然在种间联结数量上,正联结对数略少于负联结对数,但从显著率上来讲,40个主要物种在总体上仍呈正联结趋势。极显著正联结数目高于极显著负联结数目。从群落系统的演替过程来看,成熟度越高的群落,其物种组成就越趋向于完善,种间关系也更趋向于正联结,以此来保证物种间的稳定共存[1]。
物种间表现出正联结,说明一个物种的存在对另一个物种有利或者两个物种生长所需的环境条件越相似。χ2检验中,15个种对呈极显著正联结。比如,15—37(鹅绒藤—芦苇)种对,鹅绒藤的生长需要芦苇做它的物理支持,因此表现出极显著正联结。从生态因子的角度分析,某些物种对水分和土壤条件有较为一致的需求,并且在养分条件较好的情况下,不至于相互排斥,例如4—7(地肤—藜),5—7(碱蓬—藜)两个种对中的3种植物,常出现在考察区内的道路沿线,对水分的要求均不高,且都为耐盐植物。另外,如31—38(稗—马唐)种对,两种植物均属于农田杂草,分布于撂荒地和路旁、田埂、田间等地,耐旱耐高温,但是从形态特征来讲,考察区域中,马唐多在70cm以下,而稗相对较高,因此两者对环境的需求较一致,但由于生长空间上存在差异,因此竞争较小。
物种间表现出负联结,一个物种的存在对另一个物种有排斥作用,或者两个物种生长所需要的环境条件不同。出现频率大于5%的40个主要物种中,呈极显著负相关的种对有8对。如8—37(繁穗苋—芦苇)种对,芦苇是典型的湿生植物,而繁穗苋出现的生境多为旱生或中生;又如27—34(醴肠—狗尾草)种对,醴肠多出现于低洼、湿润地区,而狗尾草则多出现于荒野、道旁。对水分的要求不同,是两个物种表现出极显著负联结的主要因素。
2.2 相关性分析
由于χ2检验要求把原始数据转化为0,1的二元数据,只表示物种在样方中的存在与否,只能给出定性的数据,确定两个物种之间关联与否,而不能定量地给出关联程度的大小,这就不可避免的损失了一定的信息。
Spearman秩相关检验以物种重要值为数量指标,能够较好地反映物种间的定量关系。在SPSS 17.0软件中计算Spearman秩相关系数,并得到相关系数半矩阵图。
通过Spearman秩相关检验计算结果可知,研究区内呈正相关的种对共有356对,占总对数的45.64%,呈负相关的有424对,占总对数的54.36%。Spearman检验的显著率(包含显著与极显著水平)为35.77%,包含279对相关性种对。其中,极显著正相关种对有27对,显著正相关种对117对;极显著负相关种对有27对,显著负相关种对108对。
在χ2检验中显示的显著和极显著相关种对,在Spearman检验中几乎全部出现,但也有个别在χ2检验中为显著正相关的种对,在Spearman检验中却表现出不相关或负相关,如3—5(地肤—碱蓬)种对,分析原因可能是因为两者对环境有相似的生态适应性,常常共同出现构成共优种群落,但也常见分别独立成为单优种群落,χ2检验只考虑到两个物种在样方中同时出现的次数,因此显示为极显著正相关,但若在Spearman检验中,盖度作为构成重要值的重要指标,若是单优种群落,其中一种在盖度上占绝对优势而另一种相对极少时,就不能显示出两物种间呈显著正相关关系(表2)。
比较χ2检验和Spearman秩相关系数检验的结果(表2),其显著与极显著的种对数,后者均高于前者。对于相关检验显著率,Spearman检验较χ2检验高出27.31%,说明Spearman检验较χ2检验更加灵敏,可以弥补χ2检验的不足。
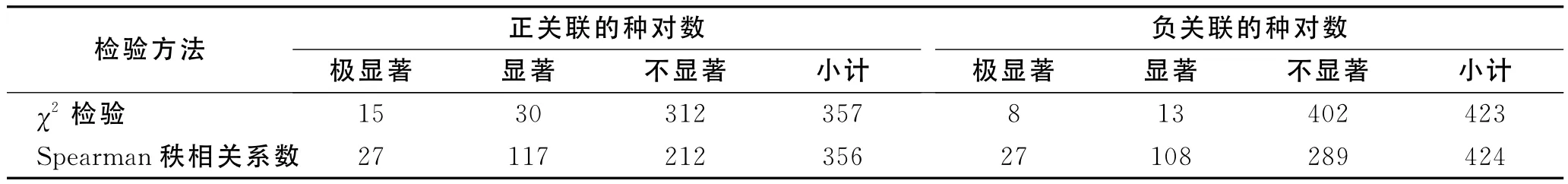
表2 χ2检验和Spearman秩相关系数检验对比
2.3 生态种组的划分
群落中,具有较大联结性和相关性的物种能够联合为一个生态种组,同一生态种组内的物种具有相似的生态习性,对环境条件的适应能力具有一致性,正相关关系明显;不同生态种组内的物种,占据不同的生态位或生态位重叠较小,对环境资源的利用方式有所差异。某一生态种组的缺失将会对群落的结构和功能产生重要的影响。因为种间联结测定值在一定程度上反映了物种间的相互关系以及它们与环境因子的关系,所以可将它们作为生态种组划分的重要依据。本研究根据χ2检验和Spearman秩相关检验结果,参考不同种群对于生态因子的适应性特征,把40个主要植物种划分为以下3大生态种组。
2.3.1 湿生植物种组 芦苇、稗。该组内物种均生活在水分充足地区,多为湿地常流水、有积水、或潮湿环境中,属于典型的水生或湿生植物。由于本研究选取的是出现频率>5%的物种,所以没有统计出现频率低的物种,如香蒲(Typha orientalis)、水葱(Schoenoplectus tabernaemontani)、扁秆藨草(Scir-pus compactus)、水蓼(Polygonum hydropiper)、浮萍(Lemna minor)等。
2.3.2 中生植物种组 藜、鬼针草、葎草、鹅绒藤、繁穗苋、萹蓄、马齿苋、野大豆、无芒稗、长芒稗、铁苋菜、茜草、碱蓬、地肤、牵牛、圆叶牵牛、醴肠、茵陈蒿、龙葵、泥胡菜、稷。该组植物物种对水分的要求不严格,在一定范围内较湿润或较干旱的环境里都可以生活,具有很强的适应性。
2.3.3 旱生植物种组 苦荬菜、苣荬菜、益母草、苍耳、狗尾草、金色狗尾草、刺儿菜、野西瓜苗、猪毛蒿、打碗花、苘麻、独行菜、乳苣、马唐、虎尾草、牛筋草、东亚市藜。该组物种对水分的要求不高,能在比较干旱的环境里生活,常出现于路旁,数量较多,分布广泛。
生态种组是按照χ2检验和Spearman秩相关检验半矩阵图来划分的,各生态种组内的物种之间大多都是正相关,这主要是因为它们具有相近的生物学特征,对生境具有相似的生态适应性以及相互分离的生态位所致。而各生态种组间的种对通常呈负相关,这是由于它们具有不同的生物学特征,对生境具有不同的生态适应性和相互重叠的生态位所致。但也有植物表现出与两个种组间物种都呈正相关情况,分析原因可能是这些植物的生态位较宽,出现了生态位重叠。
3 结论与讨论
3.1 种间关系分析
植物群落内物种间的相互关系是群落重要的数量和结构特征。本研究采用χ2检验和Spearman秩相关分析两种方法,检验了七里海古泻湖湿地40个植物种780个种对间的相关性。本文没有采用Pearson相关分析方法,是因为受到该方法要求物种服从正态分布的局限性。比较两种测度方法的检验结果,发现二者结果具有一致性,但仍存在着差异。这是由于χ2检验属于定性检测,仅能说明2个物种同时存在与否,不能很好地反映数量上的变化关系;Spearman秩相关分析属于非参数检验,不受物种分布形式的要求,且灵敏度较高[9]。二者结合使用,较为准确地反映了七里海湿地主要植物种的种间关系。
在群落发育过程中,群落主要植物正、负相关的种类是随着群落的发展而变化的。随着群落演替的进展,种间关联性如何变化,学者们说法不一。有的学者[21]认为,随着群落的发展演替,群落结构及其种类组成将逐渐趋于稳定,种间的正负相关性也将趋向于正相关,以求得物种间的稳定共存,且演替时间越长或越接近成熟,正相关的种对数越多。也有学者[22]认为,随着植被群落演替的进展,各种群之间、种群与环境之间进行不断地调节,个体数量维持稳定,种间和种内竞争逐渐减弱,各组成种群分别占据进一步分化了的生态位并能和谐共生于群落之中,种对间联结关系也变得较为松散,因此演替成熟阶段的植物群落很可能表征为优势种间没有正联结,少数发生负联结,多数为单独分布。七里海湿地主要植物种具有相关性的种对数(279对,包含显著和极显著)占总种对数(780对)的比例偏低,为35.77%,说明七里海植物的种间关系比较松散,种对间的独立性较强,本研究结果认为在农业、渔业和旅游开发程度较高的地段,植被可能处于退化状态。在种对数量上,呈正相关的种对数小于呈负相关的种对数,正负关联比为0.84;但从χ2检验结果来看,正联结显著率(5.77%)大于负联结显著率(2.69%),40个主要物种在总体上仍呈正联结趋势。这说明在保留比较完好的核心区,植被的物种组成还是比较稳定的,但仍没有达到演替的顶极阶段,当受到外界干扰时群落还会发生波动。种群间的联结关系是十分复杂的,要想得到全面的认识还需结合生态生理方面实验的验证。
种间联结测定值不仅能够揭示群落中物种间的相互关系,还能在一定程度上反映它们与环境因子的关系,但是种间联结方法有着自身的缺陷:(1)只能够测群落中两个物种间的关系,但种群间的关系不局限于两两之间;(2)测定结果仅能说明竞争的结果或现状,描述的是种群之间关系的外在现象,并不能揭示种间关系的内在过程;(3)样方大小对测定结果有影响,不同尺度上的种间联结会不相同,且物种间的相互作用是有一定空间范围的[9,23]。因此,建议使用多物种联结方法来测定多物种间的相关关系,野外调查时尽量采用样带法或固定样地长期监测,最好尝试将种间联结和环境因子结合起来,这样可能会更加合理地解释种间关系。
3.2 生态种组分析
七里海湿地中40种主要植物划分成了湿生植物种组、中生植物种组和旱生植物种组这3大生态种组,其中湿生植物物种数量减少,中生植物物种的数量增加趋势明显,由人类开发活动导致的湿地资源占用、水污染和水资源匮乏等问题可能是其主要原因。七里海湿地属于典型的退海形成的古泻湖湿地,植被演替基本遵循水生演替的一般过程,即:(1)自由漂浮植物阶段;(2)沉水植物阶段;(3)浮叶根生植物阶段;(4)挺水植物阶段;(5)湿生草本植物阶段;(6)木本植物阶段。前5个阶段基本是自然演替过程,第6个阶段主要是人工胁迫的过程。七里海湿地目前正处于第5个阶段,有向第6个阶段发展的趋势。水分是七里海湿地主要植物种的主导环境因子,对水分因子适应性相似的物种之间一般呈现正相关,而对水分条件有不同需求的物种之间一般呈负相关。同一种组内物种相互呈正相关而不同种组间呈负相关,但也有植物(如鹅绒藤、苍耳等)表现出与两个种组间物种都呈正相关情况,分析原因可能是这些植物的生态位较宽,对水分和土壤的广泛适应性,使其在部分区域出现了生态位重叠的现象。
研究结果表明,随着湿地的进一步退化,植物群落结构也会由于环境因子的不同作用而发生变化。随着退化演替的进行,生态种组的类型和结构必然会发生变化,湿生性的植物如香蒲、水葱、扁秆藨草、水蓼等物种的数量和出现频度均降低,中生或旱生的物种如野大豆、狗尾草和苍耳等数量增加并将在湿地中占据优势,生态种组的类型有向中生、旱生植物种组转化的趋势。
[1] 王伯荪.植物种群学[M].广东 广州:中山大学出版社,1989.
[2] Greig S P.Quantitative Plant Ecology [M].Oxford:Blackwell Scientific Publications,1983.
[3] 高永恒,曾晓阳,周国英,等.长江源区高寒湿地植物群落主要种群种间关系分析[J].湿地科学,2011,9(1):1-7.
[4] Moore P D,Chapman S B.Methods in plant ecology[M].2nd.London:Blackwell Scientific Publications,1986.
[5] Dice L R.Measure of the amount of ecological association between species[J].Ecology,1945,26(3):297-302.
[6] Schluter D.A variance test for detecting species association with some example applications[J].Ecology,1984,65(3):998-1005.
[7] Mourad M M,Sharawy S W.The interspecific relationships of Astragalus species in Egypt assessed by the morphoanatomical characters of the pod[J].Feddes Repertorium,2010,121(1/2):38-58.
[8] Myster R W,Pickett S T A.Dynamics of associations between plants in ten old fields during 31years of succession[J].Journal of Ecology,1992,80(2):291-302.
[9] 郭志华,卓正大,陈洁,等.庐山常绿阔叶、落叶阔叶混交林乔木种群种间联结性研究[J].植物生态学报,1997,21(5):424-432.
[10] 邓贤兰,刘玉成,吴杨.井冈山自然保护区栲属群落优势种群的种间联结关系研究[J].植物生态学报,2003,27(4):531-536.
[11] 王文进,张明,刘福德,等.海南岛吊罗山热带山地雨林两个演替阶段的种间联结性[J].生物多样性,2007,15(3):257-263.
[12] 孙中伟,赵士洞.长白山北坡锻树阔叶红松林群落木本植物种间联结性与相关性研究[J].应用生态学报,1996,7(1):1-5.
[13] 牛莉芹,上官铁梁,程占红.中条山中段植物群落优势种群的种间关系研究[J].西北植物学报,2005,25(12):2465-2471.
[14] 房飞,胡玉昆,张伟,等.高寒草原植物群落种间关系的数量分析[J].生态学报,2012,32(6):1898-1907.
[15] 李秋玲,范庆安,马晓勇,等.山西黄河湿地植被优势种群种间关系[J].生态学杂 志,2007,26(10):1516-1520.
[16] 秦磊.天津七里海古泻湖湿地环境演变研究[J].湿地科学,2012,10(2):181-187.
[17] 王祖伟,刘明舵,李兆江,等.七里海湿地环境生态系统退化与修复[J].水土保持研究,2005,12(5):244-247.
[18] 胡蓓蓓,徐利淼,李兆江,等.天津市七里海湿地价值评估[J].安徽农业科学,2012,40(21):11001-11004.
[19] 王凤琴,苏海潮,刘利华,等.天津七里海湿地鸟类区系及类群多样性研究[J].天津农学院学报,2003,10(3):16-22.
[20] 冀潇檬,曾昭春,郭冉,等.七里海浮游生物及底栖动物的初步调查研究[J].河北渔业,2012(6):33-36.
[21] 杜宁,郭卫华,吴大千,等.昆嵛山典型林下灌草层植物种间关系研究[J].山东大学学报,2007,42(3):71-77.
[22] 娄彦景,赵魁义.三江平原毛苔草群落近30年演替过程中的种间联结性分析[J].生态学杂志,2008,27(4):509-513.
[23] 林勇明,吴承祯,洪伟,等.长苞铁杉林乔木层优势种群种间关联及尺度效应研究[J].广西植物,2005,25(6):526-532.
