与黄瓜霜霉病抗性相关基因连锁的分子标记研究
2014-01-25孟攀奇蔡丽静张桂华杜胜利
孟攀奇,蔡丽静,张桂华,杜胜利
(1.天津科润黄瓜研究所,300192;2.河北承德市兴隆县农牧局)
与黄瓜霜霉病抗性相关基因连锁的分子标记研究
孟攀奇1,蔡丽静2,张桂华1,杜胜利1
(1.天津科润黄瓜研究所,300192;2.河北承德市兴隆县农牧局)
以黄瓜抗霜霉病和感霜霉病亲本组合(Q9×Q10)的F2分离群体为试材,采用BSA法筛选到了1个AFLP引物组合P11M70在抗病池和感病池间表现多态,抗病池和抗病亲本均具有大小约304 bp的特异谱带,感病池和感病亲本均扩增出了大小约为301 bp的特异片段。经F2单株验证及连锁分析,该特异片段与霜霉病抗病相关基因相连锁,连锁距离为5.22 cM。对特异片段的测序结果显示,两片段的大小分别为304 bp和301 bp,且2个片段的差异仅为3个“A”碱基的插入或缺失以及1个“C-T”的碱基突变。将该AFLP标记成功地转换为了简单实用的SCAR标记。
黄瓜;霜霉病;抗性相关基因;分子标记
黄瓜霜霉病是黄瓜三大主要病害之一,流行年份可导致黄瓜减产达30%~50%。应用抗病品种防治植物病害是最为经济、安全、有效的途径。以往抗病品种的选育主要采用常规育种技术,对材料抗病性的鉴定依靠田间鉴定方法,受环境因素影响较大,鉴定结果也不够准确,即便是采用人工接种抗病鉴定技术,也由于其病原菌活体寄生的原因而受到季节限制。分子标记技术的飞速发展,为利用与目标基因紧密连锁的分子标记进行性状鉴定提供了一条新途径。
目前关于黄瓜霜霉病的分子标记研究已有部分报道。丁国华等[1]找到了1个RAPD标记,与黄瓜霜霉病抗性基因之间的连锁距离为7.85 cM。白智龙等[2]分春秋两季进行了黄瓜霜霉病抗性QTL的检测,共检测到3个QTLs,其中贡献率最大的1个QTL在春秋两季的贡献率分别达到了36.4%和27.3%。张素勤等[3]筛选到了1个与控制黄瓜霜霉病某个感病基因连锁的AFLP标记,该标记解释霜霉病抗性表型变异的11.34%。但上述文献所报道的分子标记与黄瓜霜霉病抗性基因间的遗传连锁距离均较远,用于黄瓜霜霉病抗性辅助育种尚有较大误差。
本研究分别以高抗和高感黄瓜霜霉病的2个材料为亲本,配制F2分离群体,采用苗期人工接种抗病性鉴定技术和田间抗病性直接鉴定方法,对F2分离后代的抗性进行了鉴定;同时,结合BSA法(分离群体混合分析法)采用AFLP技术,筛选与黄瓜抗霜霉病性状基因相连锁的分子标记,为利用分子技术进行黄瓜抗霜霉病辅助育种以及霜霉病抗性基因的克隆奠定基础。
1 材料与方法
1.1 试验材料
供试材料为高抗和高感黄瓜霜霉病的黄瓜高代自交系Q9、Q10及其F2分离后代。AFLP引物购自上海生工生物工程公司。
试验于2002-2004年在天津科润农业科技股份有限公司黄瓜研究所完成。
1.2 试验方法
①抗性分离群体的构建及黄瓜霜霉病抗病性鉴定 将供试材料播种于塑料温室中,常规管理。采用喷雾法于3片真叶期进行霜霉病苗期人工接种抗性鉴定。采用吕淑珍等[4]所述的分级标准,分别于接种后7、14、20 d左右调查霜霉病的发病情况。
②DNA的提取 选取高抗霜霉病和高感霜霉病的F2单株各5株,组成抗病池和感病池。分单株提取DNA和PCR扩增。DNA提取采用CTAB法[5]。
③AFLP分析 参照Vos等[6]的方法进行AFLP分析。采用MseI和PstI 2种内切酶进行基因组DNA的酶切;预扩增引物不含选择性碱基。
③引物筛选及分子标记的验证 对抗、感亲本及抗、感池内各单株进行PCR扩增,将在抗感亲本间及抗感两池间同时产生差异谱带的引物组合,作为与黄瓜霜霉病抗性相关基因连锁的候补引物组合;然后利用F2单株对候补引物组合进行吻合性验证。
⑤特异片段的测序 特异片段的回收纯化参照张桂华[5]的方法。序列测定由大连宝生物公司进行。
⑥SCAR标记引物的设计与PCR扩增 根据测序结果以及引物设计的原则,用primer 3.0软件设计特异性引物。SCAR扩增条件:94℃预变性5 min;94℃变性1 min,58℃退火1 min,72℃延伸2 min,35个循环;然后72℃延伸7 min。
2 结果与分析
2.1 F2分离群体黄瓜霜霉病抗性的鉴定
根据分级标准将134个F2单株分为抗病、中间类型和感病3个级别,其中抗病单株27株,感病单株32株,中间类型75株,适合性测验分析显示,基本符合1∶2∶1的分离比例 (表1)。表明在本试验所采用的供试材料的遗传背景下,黄瓜对霜霉病的抗性是由单隐性基因控制的,且中间类型单株田间表现偏向于感病亲本,感病相对抗病为显性且为不完全显性。
2.2 与黄瓜霜霉病抗病基因相连锁的分子标记的筛选
筛选到76对在双亲间具有多态性的引物组合,其中共显性AFLP标记(P11M70-304 bp/301 bp)在抗病池和感病池之间也具有相同的多态性。抗病亲本和抗病池单株都具有304 bp的特异片段,感病亲本和感病池单株都有301 bp的特异片段(图1)。
2.3 候补分子标记的验证
用共显性标记P11M70对其他F2单株进行了吻合率的验证。在其余124个F2单株中,共有7株发生了交换。由此计算,所筛选到的标记与目标基因之间的遗传距离为5.22 cM,图2为引物组合P11M70在部分F2单株中的验证。
2.4 分子标记测序
将目标片段回收纯化后测序,测序结果显示,2个片段的大小分别为304 bp和301 bp,该2个片段的差异仅表现在3个“A”碱基的插入或缺失以及1个“C-T”的碱基突变。

表1 黄瓜霜霉病田间鉴定结果

图1 筛选到的共显性AFLP标记P11M70-304 bp/301 bp

2.5 SCAR引物设计与扩增
根据测序结果及引物设计的一般原则,设计了1对特异性引物,谱带理论大小为220 bp和217 bp。图3结果显示,抗病亲本和抗病单株均具有220 bp的特异谱带,感病亲本和感病单株均具有217 bp的特异谱带。将该AFLP标记成功地转换为了简单实用的SCAR标记。与该片段序列有关的内容已申报国家发明专利(专利号为:ZL200410018667.0)。

图2 引物组合P11M70在部分F2单株中的验证
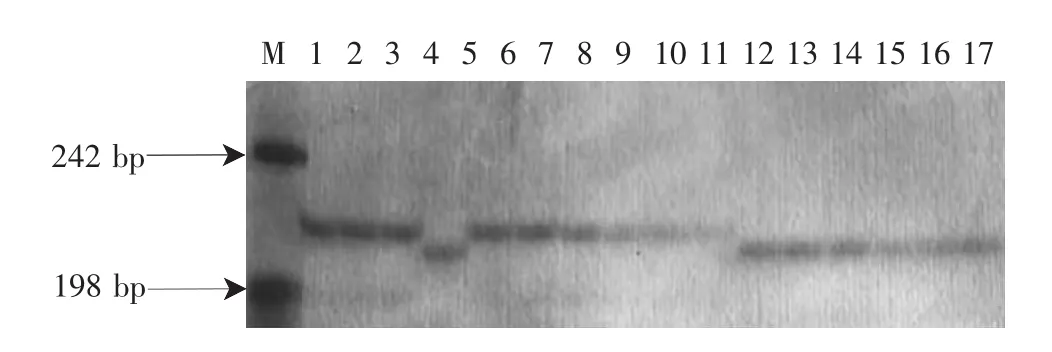
图3 SCAR引物对亲本和部分F2单株的扩增结果
3 讨论与结论
有关黄瓜对霜霉病抗性的遗传规律,前人进行了大量观察研究。可能是研究者所采用的材料的遗传背景不同,即抗性基因组成可能不同,加之没有采用统一的抗性鉴定方法及分级标准,研究结果各不相同。大多研究结果认为,黄瓜对霜霉病的抗性是由多基因控制[4,7~9],但也有单基因控制的报道[10]。本研究对抗霜霉病和感霜霉病亲本材料及其F2分离群体进行了田间抗病性鉴定和AFLP分子标记研究。田间鉴定结果表明,F2分离群体中抗病、中间类型和感病单株的比例约为1∶2∶1,且中间类型单株的抗病性偏向感病亲本,说明在本研究采用的试材的遗传背景下,黄瓜对霜霉病的抗性是由单隐性基因控制的,感病性相对于抗病性为不完全显性。
BSA分析方法是Michelmore等[11]于1991年建立的一种连锁标记分析方法。该方法适合由单基因控制的质量性状。但笔者在研究中发现,若为完全显性,很易建立抗感池,若为不完全显性,在F2后代性状鉴定分级时很容易发生划分错误,即便是一个单株的鉴定失误也会导致分池不准确。本研究中黄瓜对霜霉病的抗性就属不完全显性,所以参照张桂华等[12]的方法组建抗病池和感病池进行标记筛选,筛选到了与控制黄瓜霜霉病抗性基因紧密连锁的AFLP标记,并转换为了简单实用的SCAR标记。
[1]丁国华,秦智伟,周秀艳,等.黄瓜霜霉病抗病基因的RAPD及SCAR标记[J].西北植物学报,2007,27(9):1 747-1 751.
[2]白智龙,袁晓君,蔡润,等.黄瓜霜霉病抗性QTL分析[J].自然科学进展,2008,18(6):706-710.
[3]张素勤,顾兴芳,张圣平,等.黄瓜霜霉病抗性相关基因的AFLP标记[J].西北植物学报,2010,30(7):1 320-1 324.
[4]吕淑珍,张本群,李淑菊.黄瓜霜霉病抗病遗传及抗性鉴定方法研究进展[C]//中国主要蔬菜抗病育种进展.北京:科学出版社,1995:392-394.
[5]张桂华.黄瓜白粉病抗性相关基因的分子标记研究[D].陕西杨凌:西北农林科技大学,2003:23-28.
[6]Vos P,Hongers R,Bleeker M,et al.AFLP:a new technique for DNA fingerprinting[J].Nucleic Acids Res,1995,23(21): 4 407-4 414.
[7]冯东昕,李宝栋.主要瓜类作物抗霜霉病育种研究进展[J].中国蔬菜,1997(2):45-48.
[8]侯锋.黄瓜[M].天津:天津科学技术出版社,1999.
[9]Jenkins J M.Studies on the inheritance of downy mildew resistance and of other characters in cucumbers[J].J Hered, 1946,37:267-276.
[10]Van Vliet G J A,Meysing W D.Inheritance of resistance toPsuedoperonospore cubensisRost.in cucumber(Cucumis sativusL.)[J].Euphytica,1974,23:251-255.
[11]Michelmore R W,Paranand I,Kessali R V.Identification of markers linked to disease resistance gene by bulked segregant analysis:a rapid method to detect markers in specific genomic regions using segregating populations[J]. Proc Natl Acad Sci USA,1991,88:9 829-9 832.
[12]张桂华,杜胜利,王鸣,等.与黄瓜抗白粉病基因连锁的AFLP标记的获得[J].园艺学报,2004,31(2):189-192.
Study on Molecular Markers Linked to Cucumber Downy Mildew Resistance Gene
MENG Panqi1,CAI Lijing2,ZHANG Guihua1,DU Shengli1
(1.Tianjin Kernel Cucumber Research Institute,300192; 2.Xinglong County Agriculture and Animal Husbandry Bureau of Chengde City)
With an F2population between a highly resistant parent Q9 and a highly susceptible parent Q10 as materials, we screened out an AFLP marker P11M70,which showed polymorphism between resistant pool and susceptible pool of cucumber downy mildew disease by using BSA method.The resistant parent and resistant F2plants possessed the 304 bp fragment,and the 301 bp fragment for the susceptible parent and susceptible F2plants.The results of linkage analysis showed that,the AFLP marker was tightly linked to the cucumber downy mildew resistance related gene,and the genetic distance was 5.22 cM.And the results of fragment sequencing showed that,their length were 304 bp and 301 bp respectively,and the difference of the two fragments lied in the insert-deletion(indel)of three A base and a mutation of C to T base.The AFLP marker was successfully converted into SCAR marker.
Cucumber;Downy mildew;Resistance-related gene;Molecular marker
S642.2
A
1001-3547(2014)08-0012-03
10.3865/j.issn.1001-3547.2014.08.004
天津市重大科技专项(工程)项目(12ZCDZNC03500,12ZCDZNC03700)
孟攀奇(1973-),女,硕士,副研究员,主要从事黄瓜品种的推广、研究工作
2014-01-16
