生长因子对硫酸盐还原菌EPS产生及其吸附Cu2+性能的影响
2014-01-23李明明虞艳云岳正波
李明明, 虞艳云, 王 进, 李 青, 岳正波
(合肥工业大学 资源与环境工程学院,安徽 合肥 230009)
硫酸盐还原菌(sulfate reducing bacteria,简称SRB)是一类形态、营养多样化的厌氧异养细菌[1]。文献[2-3]研究表明,SRB菌可以有效地去除废水中的重金属离子,并在处理矿山酸性排水中具有重要作用。随着研究的不断深入,人们发现SRB胞外聚合物(extracellular polymeric substances,简称EPS)在处理重金属的过程中占有重要作用。文献[4]认为EPS在生物修复重金属中起核心作用;文献[5]研究从海水中分离一株SRB,在液体培养时其分泌的EPS与Ni2+、Cr6+与Mo2+形成配体,可以有效去除这几种重金属。
EPS是微生物在生长过程中分泌的一种由多糖、蛋白质等许多高分子物质组成的聚合物[6-7]。EPS含有大量阴离子基团(羧基、羟基及氨基等)[8],可以和重金属离子进行吸附或螯合等作用[9-10]。文献[11]研究 Mn2+、Mo6+和Zn2+对活性污泥内EPS组分的影响,结果表明低质量浓度(0.05mg/L)Mn2+导致EPS中蛋白质、多糖和核酸的含量下降,Zn2+会对EPS中多糖含量造成影响,Mo6+对EPS各组分没有显著影响。文献[12]研究pH值对EPS吸附重金属的影响,发现有30%的重金属吸附到EPS上是不可逆的。
随着人们对EPS研究的深入,如何调节EPS的成分和含量已经成为目前一个现实的问题。大量研究表明培养时间、基质、pH值等生长因子可以影响细菌EPS的分泌。文献[13]分别研究了培养时间、C/N比等对Rhodopseudomonasacidophila分泌EPS的影响;文献[14]研究了环境因素对Pediococcusparvulus2.6分泌EPS的影响;文献[15]研究了pH值、接种量、培养时间等对PseudomonasfluorescensPGM37菌EPS分泌的影响。近年来,采矿、金属冶炼、电镀以及IT等行业会大量排放含Cu废水,其中Cu2+的含量普遍在几十至上百 mg/L[16-17],Cu污染问题亟待有效解决。因此,本文首先研究了不同生长因子对SRB菌分泌EPS的影响,继而进一步考察了不同生长因子作用下SRB菌分泌的EPS对Cu2+的吸附性能。
1 材料和方法
1.1 实验材料
此菌株为硫酸盐脱硫弧菌(Desulfovibrio desulfurican),是由本课题组从合肥市某污水处理厂底部厌氧发酵污泥中分离得到,鉴别号为:HQ022824.1。实验所用培养基是Starkey培养基,具体成分为:K2HPO40.5g,NH4Cl 1.0g,Na2SO40.5g,CaCl20.1g,MgSO42.0g,70%乳酸纳5.0mL,蒸馏水1 000mL,抗坏血酸1%,pH=7.0±0.2。
1.2 实验设计
1.2.1 生长因子对SRB菌分泌wEPS影响
pH 值、接种菌 体浓 度 (TS),w(F/M)和ρ(COD)/ρ(SO42-)是影响SRB生长代谢的重要生长因子。大量研究表明,pH值在6.5~8.0,接种菌体浓度在10%(本研究以TS的量表示接种浓度,在接种菌体浓度为10%时接种TS为45mg/L左右),加入乳酸钠的质量比在63.5~90g/g,ρ(COD)/ρ(SO42-)值在2.0~2.5之间时,SRB 的生 长 代 谢 最 佳[18-21],但 是 相 关文 献 并没有对EPS的产生量进行研究。因此根据文献报道并结合本株菌自身的生长状况选取较宽泛的取值范围,利用序批式实验研究不同pH值、接种菌体浓度(TS),F/M 和COD/SO42-值对SRB产EPS的影响。具体设计见表1所列。
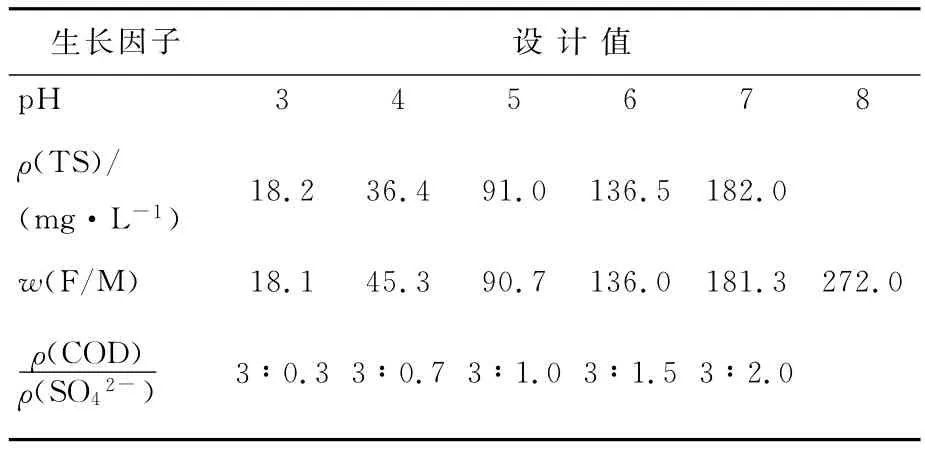
表1 不同生长因子实验设计
实验在磨口锥形瓶中进行,接种前在无菌条件下向培养基中充氮气以排除氧气。接种后置于35℃恒温培养箱中培养44h。反应结束后,测量OD600、EPS含量;对于不同F/M实验,测定反应前后的COD。
1.2.2 EPS对Cu2+的吸附实验
分别取不同影响因子下SRB菌分泌的EPS 10mL置入透析袋中,再将透析袋放入含有40mg/L Cu2+溶液的烧杯中透析24h,然后将透析袋置入蒸馏水中以去除透析袋内游离的Cu2+,反应结束后测量EPS和透析液中的Cu2+含量。整个吸附过程在pH=5的条件下进行以保证体系中的Cu以离子状态存在。
1.3 分析方法
培养结束后将菌液于4℃、4 000r/min下离心15min,取上清液测定SO42-质量浓度和COD质量浓度;离心所得沉淀物用蒸馏水清洗后用加热法提取EPS。首先将沉淀物于80℃水浴中加热10min,然后在4 ℃、14 000r/min下离心15min,取上清液用0.22μm的纤维素膜过滤,将滤液置入3 500Da的半透膜中透析24h以获得EPS样品。
EPS中多糖采用蒽酮法,蛋白质采用lowery法,核酸采用紫外分光光度法测定。重金属Cu2+使用TAS-986型原子吸收分光光度计(北京普析通用仪器有限责任公司)测定;SO42-采用铬酸钡分光光度法测定;COD采用重铬酸钾法测定。EPS的红外光谱采用傅里叶红外光谱仪(Nicolet 67,美国Thermo Nicolet公司)测量。红外样品的制备方法采用吸附压片法[22]。先将KBr溶解于EPS溶液中,再缓慢蒸发使其析出,此时EPS吸附在KBr上,再将析出物加KBr研磨后压片,即可上机测试。扫描波长为800~4 000cm-1。
2 实验结果与讨论
2.1 pH对SRB分泌EPS的影响
pH值对SRB分泌EPS的影响及EPS对Cu2+的吸附如图1所示。从图1a中可以看出,当初始溶液为中性的条件下EPS的产率最高;当pH上升时,EPS产率略微下降;在pH<7时,EPS产率下降趋势明显;当pH<5时,由于SRB死亡,无EPS产生(图中未显示)。这是由于在酸性条件下,羧基、多聚糖酚类和蛋白质肽键消失;而在碱性的条件下,这些基团基本上不受影响[23]。因此,在酸性条件下,EPS随着pH值的上升而上升;在碱性条件下EPS随pH值变化并不明显。
不同初始pH值下SRB产生的EPS对Cu2+的吸附效果如图1b所示,在接近中性的条件下产生的EPS对Cu2+的吸附性能较强,并于pH=8时产生的EPS对Cu2+的吸附效果最佳。在所研究的pH值范围内,当初始pH值为5或9时培养的SRB产生的EPS对Cu2+的吸附性能不佳。这可能是因为在低的pH值下溶液中的H+会和羟基等基团结合,而pH值高时溶液中OH-会与羧基等基团发生反应,因此溶液中Cu2+要通过竞争作用才能与这些基团结合[24],从而导致吸附量降低。
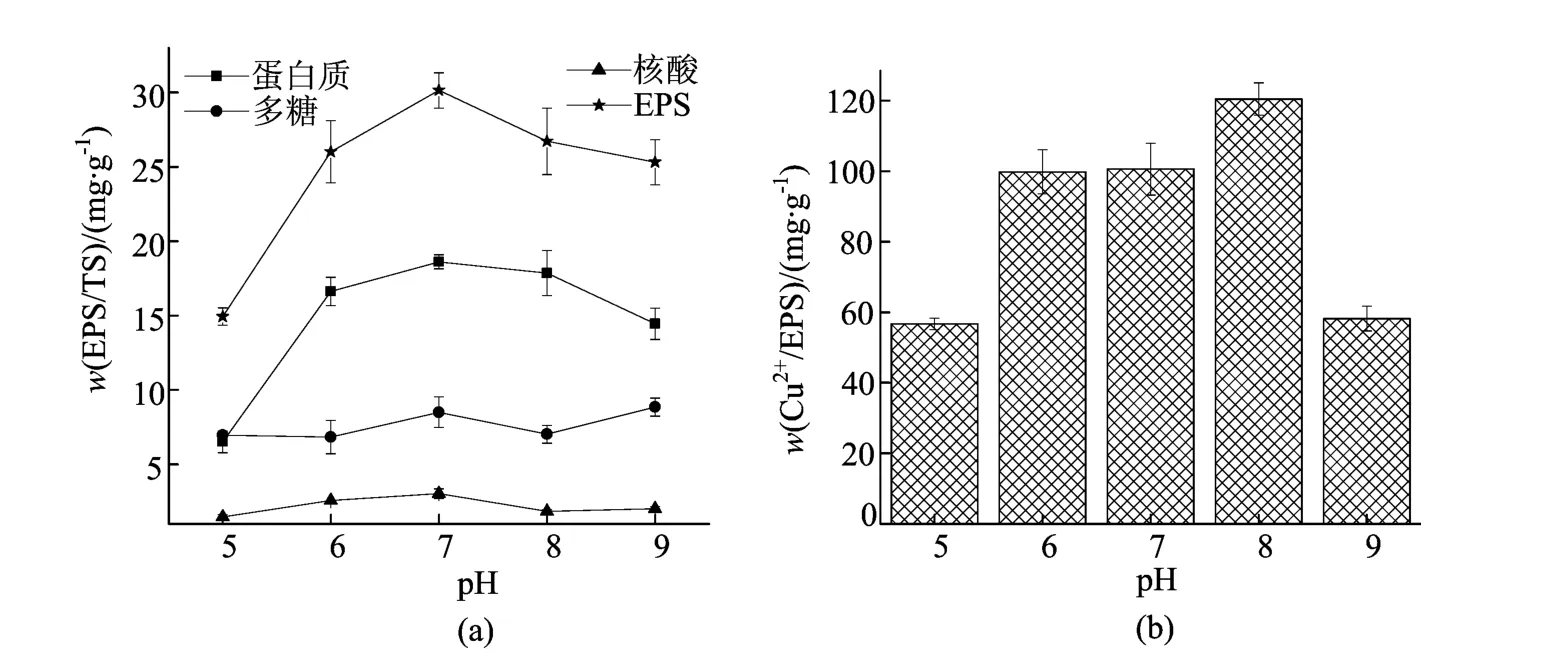
图1 pH值对SRB分泌EPS的影响及EPS对Cu2+的吸附
2.2 接种TS对SRB分泌EPS的影响
接种TS对SRB分泌EPS的影响及EPS对Cu2+的吸附如图2所示。
从图2a中可以看出随着初始接种TS的增加,EPS的产率呈不规则变化。总体来说在低(ρ(TS)=18.2mg/L)和高(ρ(TS)=182mg/L)的初始接种TS情况下EPS产率较高。微生物在生长过程中分泌EPS附着在细胞周围,就像一个细胞壁外的类凝胶层,以延迟扩散的方式延迟或者防止毒性物质和微生物接触或者用化学方法减少毒性物质的伤害[25]。在底物质量浓度不变的情况下,高的接种量意味着高的细菌本底值,底物消耗加快,细菌更早地进入衰亡期,在此阶段会伴有较多细菌胞内物质的溶出和有毒物质积累[26]。虽然在衰亡期释放到溶液中的EPS含量较多[27],但是在高的接种量下由于细胞内物质溶出与有毒物质刺激EPS的含量仍较高。在低的接种量下由于底物质量浓度相同,微生物有更大的生长空间,相比于其他接种量下此时SRB活性较高,因而释放到溶液中的EPS更少[27]。所以在低的接种量下EPS的含量也较高。不同接种TS条件下SRB分泌的EPS对Cu2+的吸附如图2b所示,接种质量浓度过高或过低的条件下产生的EPS均不利于对Cu2+的吸附,总体来说,接种TS处于36.4~136.5mg/L之间时细菌产生的EPS相比于高和低的接种质量浓度下产生的EPS对Cu2+具有更强的吸附能力。在高的接种量下由于SRB处于不利的生长条件下,产生的EPS会抵抗外部不利因素。由此推测,EPS的吸附位点会在此过程中遭到破坏,造成吸附量的降低;低的接种量下细菌适应期延长,虽然会分泌大量的EPS,但是EPS的吸附性能和SRB的活性均保持在较低水平。
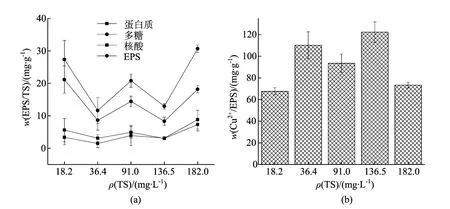
图2 接种TS对SRB分泌EPS的影响及EPS对Cu2+的吸附
2.3 初始F/M对SRB分泌EPS的影响
初始F/M对SRB分泌EPS的影响 及EPS对Cu2+的吸附如图3所示,其中F/M为COD/TS。
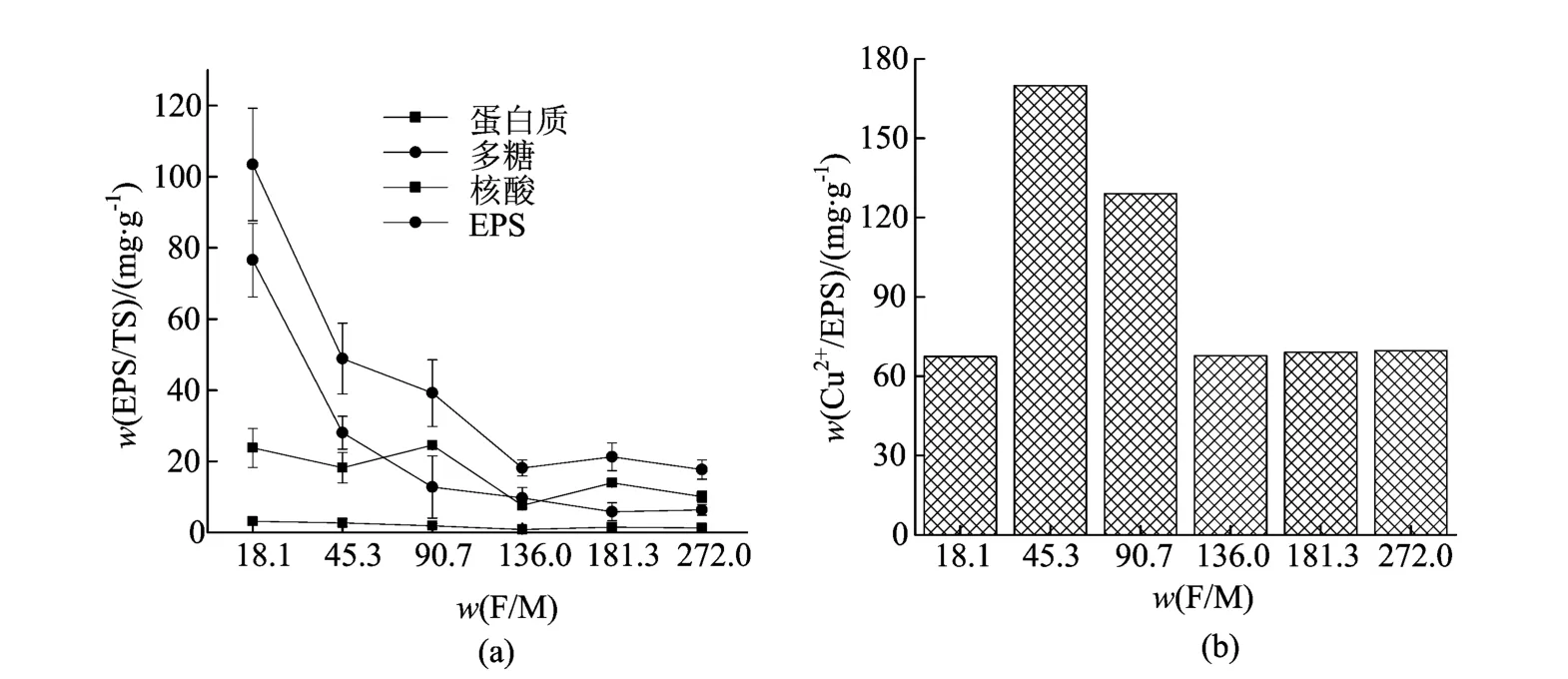
图3 初始F/M对SRB分泌EPS的影响 及EPS对Cu2+的吸附
从图3a中可以看出当w(F/M)从18.1上升到136.0时,EPS的产率出现明显降低;当w(F/M)超过136.0后,EPS的产率基本上不发生变化。这表明在微生物长势不佳的情况下,SRB分泌的EPS较多。因为在接种量不变的情况下,初始COD的质量浓度越低,细菌可利用的营养物质缺乏,细菌更早地进入衰亡期,有毒物质滋生,因此会刺激SRB菌分泌更多的EPS保护细胞[28]。当初始COD质量浓度增加到一定程度后,SRB有足够的碳源,因此分泌的EPS无明显变化。
不同w(F/M)下SRB分泌的EPS对Cu2+的吸附性能如图3b所示。当初始w(F/M)在0~90.7范围内,从SRB菌中提取的EPS对Cu2+的吸附效果显著,在低的C源下,虽然会分泌大量的EPS,但是吸附Cu2+的效果不佳,推测EPS中吸附位点可能会被生长过程中产生的毒性物质破坏,导致其吸附量较低;而随着C源的增加,有毒物质积累缓慢,EPS的吸附位点增多,吸附Cu2+的量也随之增多;当C源的含量超过一定值时,SRB菌生长稳定,在没有不利条件的刺激下细菌分泌的EPS量相对较少且组成成分变化不大,从而吸附Cu2+的量也减少且无明显差异。
2.4 不同初始ρ(COD)/ρ(SO42-)的影响
不同ρ(COD)/ρ(SO42-)对SRB分泌EPS的影响及EPS对Cu2+的吸附如图4所示。
如图4a所示,ρ(SO42-)对SRB分泌EPS的影响显著。在ρ(COD)/ρ(SO42-)为3∶0.3条件下,SRB没有充分的电子受体,生长条件恶劣,会分泌较多的EPS来保护细胞,此时由于细菌处于衰亡期,释放到溶液中的相对较多,所以此时EPS含量并未达到最大;当ρ(COD)/ρ(SO42-)为3∶1.0时,EPS分泌量达到最大。当超过这一比值后,体系中有足够的SO42-供SRB生长利用,细菌在生长过程受到的外界刺激弱,所以产生的EPS的含量降低。
图4b所示的是不同SO42-质量浓度下SRB产生的EPS对Cu2+的吸附性能。在不同初始SO42-质量浓度下产生的EPS对Cu2+的吸附量具有明显差异,在研究的范围内,随着初始SO42-质量浓度升高,SRB菌产生的EPS对Cu2+的吸附能力逐渐降低。
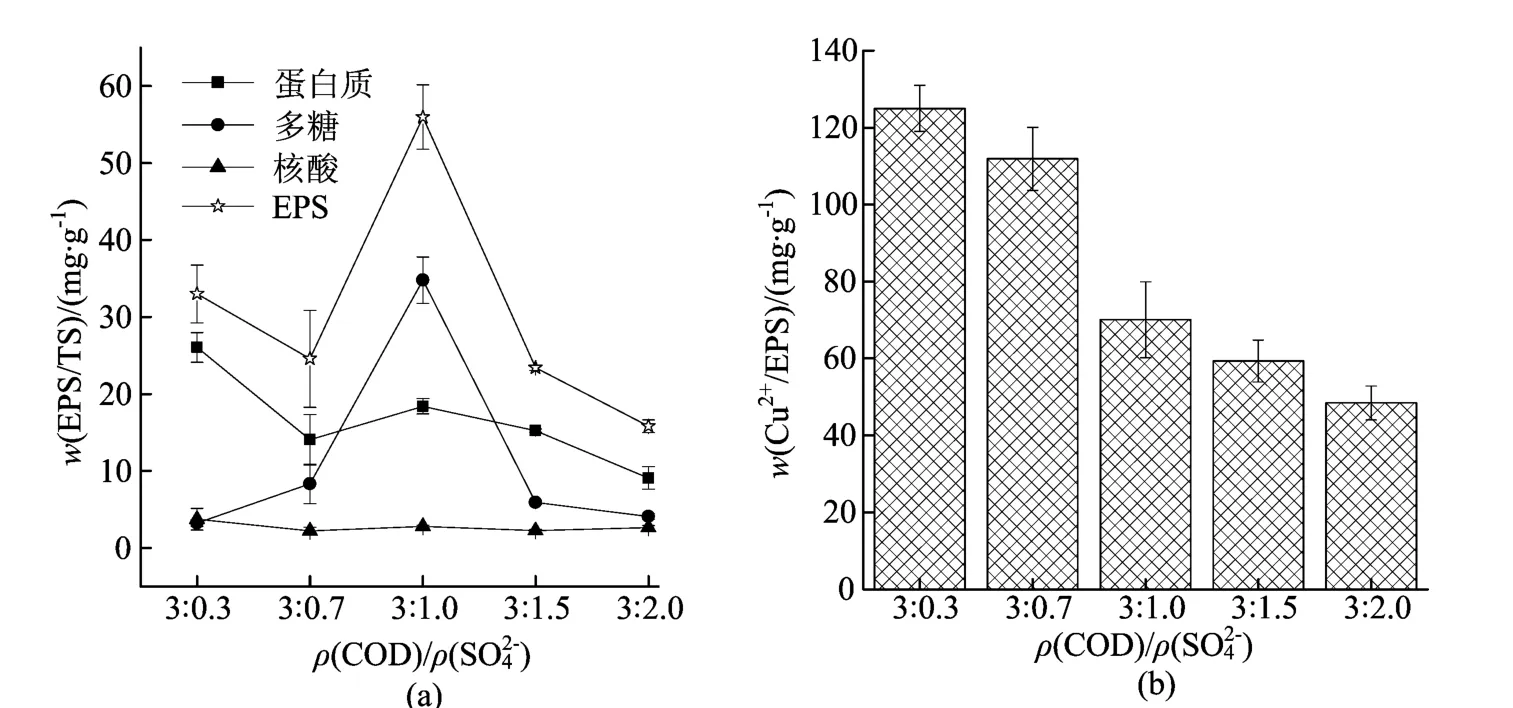
图4 不同ρ(COD)/ρ(SO42-)对SRB分泌EPS的影响及EPS对Cu2+的吸附
2.5 FTIR图谱分析
吸附前后EPS的红外光谱图如图5所示,扫描波数为800~4 000cm-1。3 412cm-1处为—NH2伸缩振动峰;3 479cm-1处为—NH伸缩振动峰,3 555cm-1为—OH伸缩振动产生的峰;1 655cm-1处是C=O和C—N伸缩振动峰(酰胺Ⅰ带);1 378cm-1处是多糖羧基中C=O对称振动;1 109cm-1处C—O伸缩振动峰,1 034cm-1处是P=O振动峰为核酸的磷酸二酯骨架或C—OH振动峰为磷酸化的蛋白质;991cm-1处为C—O—C振动峰。EPS的FTIR光谱显示其含有众多蛋白质和多糖的官能团,进一步证实了其生物化学组成[6,29,30]。
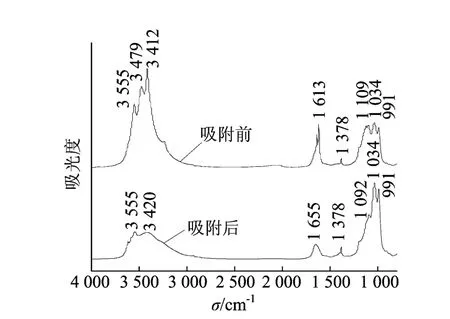
图5 吸附前后EPS的FTIR图
与吸附前相比,吸附Cu2+之后的FTIR峰在峰位置及强度上均发生改变。表征蛋白质的特征峰:3 479cm-1处—NH2峰消失,表明—NH2与Cu2+发生配位作用;3 412cm-1处—NH峰偏移到3 420cm-1处,1 613cm-1处C=O和C—N峰偏移到1 655cm-1处,1 109cm-1处C—O峰偏移到1 092cm-1处,并伴有峰强度的改变。3 555cm-1处—OH、1 378cm-1处C=O表征多糖的特征峰、1 034cm-1处表征核酸的特征峰未发生明显偏移,只是峰强度发生改变。这些结果表明在SRB菌EPS对Cu2+吸附过程中,蛋白质的作用要强于多糖。
3 结 论
(1)在pH=7、初始接种 TS为182mg/L、w(F/M)为18.1和ρ(COD)/ρ(SO42-)为3∶1.0的条件下硫酸盐分泌的EPS最多。
(2)在pH=8、初始接种TS为136.5mg/L、w(F/M)为45.3和ρ(COD)/ρ(SO42-)为3∶0.3的条件下,对硫酸盐还原菌进行培养获得的EPS对Cu2+的吸附性能最佳。
(3)EPS对Cu2+吸附过程中,蛋白质作用强于多糖。
[1]肖利萍,张 镭,李 月.硫酸盐还原菌及其在废水厌氧治理中 的 应 用 [J].水 资 源 与 水 工 程 学 报,2011,22(1):45-49.
[2]王 进,侯成虎,陈 静,等.SRB以油菜秸秆为基质处理酸性矿山排水[J].合肥工业大学学报:自然科学版,2012,35(12):1676-1680.
[3]葛晓光,杨 柳,彭申华,等.一株煤矿地下水硫酸盐还原细菌的分离、鉴定及性质研究[J].合肥工业大学学报:自然科学版,2011,34(3):420-423.
[4]Arundhati P A K P.Microbial extracellular polymeric substances:central elements in heavy metal bioremediation[J].Indian Journal of Microbiology,2008,48(1):49-64.
[5]Beech I B,Cheung C W S.Interactions of exopolymers produced by sulphate reducing bacteria with metal ions[J].International Biodeterioration and Biodegradation,1995,35(1/2/3):59-72.
[6]Cao Y Y,Wei X,Cai P,et al.Preferential adsorption of extracellular polymeric substances from bacteria on clay minerals and iron oxide[J].Colloids and Surfaces B:Biointerfaces,2011,83(1):122-127.
[7]Shen R,Sheng G P,Yu H Q.Determination of main components in the extracellular polymeric substances extracted from activated sludge using a spectral probing method[J].Colloids and Surfaces B:Biointerfaces,2012,94(1):151-156.
[8]Kim S Y,Kim J H,Kim C I,et al.Metal adsorption of the polysaccharide produced fromMethylobacteriumorganophilum[J].Biotechnology Letters,1996,18(10):1161-1164.
[9]Zheng Y,Fang X L,Ye Z L,et al.Biosorption of Cu(II)on extracellular polymers fromBacillussp.F19[J].Journal of Environmental Sciences,2008,20(11):1288-1293.
[10]Liu Y,Lam M C,Fang H H P.Adsorption of heavy metals by EPS of activated sludge[J].Water Science and Technology,2001,43:59-66.
[11]曹相生,龙腾锐,孟雪征,等.Mn2+、Mo6+和Zn2+对活性污泥内胞外聚合物组分的影响[J].环境科学,2004,25(4):70-73.
[12]Gilles G,Francois B,Asmaa S,et al.Effect of pH on cadmium and lead binding by extracellular polymeric substances (EPS)extracted from environmental bacterial strains[J].Colloids and Surfaces B:Biointerfaces,2008,63(1):48-54.
[13]Sheng G P,Yu H Q,Yue Z B.Factors influence the production of extracellular polymeric substances ofRhodopseudomonasacidophila[J].International Biodeterioration and Biodegradation,2006,58(2):89-93.
[14]Velasco S,Arsk¨old E,Paese M,et al.Environmental factors influencing growth of and exopolysaccharide formation byPediococcusparvulus2.6[J].International Journal of Food Microbiology,2006,111(3):252-258.
[15]Zhao L,Fan F,Wang P,et al.Culture medium optimization of a new bacterial extracellular polysaccharide with excellent moisture retention activity[J].Applied Microbiology and Biotechnology,2013,97(7):2841-2850.
[16]Sheng Y X,Cao H B,Li Y P,et al.Effects of various pretreatments on biological sulfate reduction with waste acti-vated sludge as electron donor and waste activated sludge diminution under biosulfidogenic condition[J].Journal of Hazardous Material,2010,179(1-3):918-925.
[17]易正戟,谭凯旋,澹爱丽,等.硫酸盐还原菌及其在工业和矿山废水治理中的应用[J].云南师范大学学报:自然科学版,2006,26(3):39-46.
[18]万海清,苏仕军,朱家骅,等.硫酸盐还原菌的生长影响因子及脱硫性能的研究[J].高校化学工程学报,2004,18(2):218—223.
[19]马忠友,邓 盾,汪建飞,等.一组混合菌群还原硫酸盐的特性[J].中国农学通报,2013,29(8):184—188.
[20]郑 强.生态因子对硫酸盐还原菌生长的影响[J].中国资源综合利用,2009,27(2):25—27.
[21]李建军,叶广运,陈进林,等.一株硫酸盐还原菌的分离鉴定和系统发育分析[J].微生物学通报,2009,36(10):1476-1482.
[22]谢狄霖,陈 忠.含水物质红外光谱测试的样品制备[J].分析仪器,2003(4):52-53.
[23]郑 蕾,田 禹,孙德智.pH值对活性污泥胞外聚合物分子结构和表面特征影响研究[J].环境科学,2007,28(7):1507-1511.
[24]Yin Y R,Hu Y Y,Xiong F.Sorption of Cu(II)and Cd(II)by extracellular polymeric substances(EPS)fromAspergillusfumigatus[J].International Biodeterioration and Biodegradation,2011,65(7):1012-1018.
[25]Wingender J,Neu T R,Flemming H C.Microbial extracellular polymeric substances:characterization,structures and function[M].Berlin:Springer-Verlag 1999:30-31.
[26]陈剑虹.环境工程微生物学 [M].第2版.武汉:武汉理工大学出版社,2009:79-80.
[27]Xu H C,Cai H Y,Yu G H,et al.Insights into extracellular polymeric substances of cyanobacterium Microcystis aeruginosa using fractionation procedure and parallel factor analysis [J].Water Research,2013,47 (6):2005-2014.
[28]Aquino S F,Stuckey D C.Soluble microbial products formation in anaerobic chemostats in the presence of toxic compounds[J].Water Research,2004,38(2):255-266.
[29]方 迪,张瑞昌,赵阳国.硫酸盐还原菌分泌胞外多聚物吸附 Cu2+的特性[J].光谱学与光谱分析,2011,31(10):2819-2823.
[30]Sheng G P,Yu H Q,Wang C M.FTIR-spectral analysis of two photosynthetic H2-producing strains and their extracellular polymeric substances[J].Applied Microbiology and Biotechnology,2006,73(1):204-210.
