利用油茶油体蛋白系统表达金属硫蛋白的载体构建
2014-01-22曾艳玲曾晓峰谭晓风张党权
曾艳玲,曾晓峰,谭晓风,张党权
(中南林业科技大学a.经济林培育与保护省部共建教育部重点实验室;b.经济林育种与栽培国家林业局重点实验室;c.经济林培育与利用湖南省协同创新中心,湖南 长沙 410004)
油茶是目前我国大力推广的优良食用油料树种之一,油茶主产品茶油中油酸含量是所有植物油中最高的[1-3]。长期食用茶油,能降低胆固醇,使人体血脂浓度降低,从而防止血管硬化和血压升高,降低心脑血管系统疾病的发生几率[4]。在不断推广油茶新品种,开发油茶新产业的同时,如何更好更快地提高茶油及其副产品的质和量是油茶科研的重点。
油体蛋白是包被在油体外部的一层磷脂和蛋白质镶嵌而成的半单位膜[5]。目前Tzen等[6]利用油体建立了融合蛋白表达系统,利用油体的疏水性,通过离心可以将油体和水相分离,从而得到分离纯化的目标融合蛋白,由此诞生了植物生物反应器——油体表达系统,并成功获得有生物活性的GUS[7]、水蛭素[8]和木聚糖酶[9]。对于油料植物来说,一方面利用油体表达系统可以融合具有营养价值的外源蛋白,改善种子的营养成分,提高种子食用或作为饲料的品质,另一方面,油体炼油的同时,油体蛋白可分离获得大量的目的蛋白,增加农产品的附加值。为了构建油茶油体蛋白原核表达系统,本研究中选取原核表达载体pET-30a为初始载体,将油茶油体蛋白基因和待表达分离的目的蛋白基因逐步插入载体,旨在为后期在大肠杆菌中诱导表达油茶油体蛋白的同时表达目的融合蛋白提供物质基础和科学依据。
1 材料与方法
1.1 材 料
油茶籽为国审品种‘华硕’[10],采自湖南省长沙市望城县东城镇油茶基地,采样后迅速存于-80℃超低温冰箱备用。载体pET30a和大肠杆菌Escherichia coli菌株BL21(DE3)为本试验保存。
1.2 试 剂
RNA提取和逆转录试剂盒购自Invitrogen公司,TransStartTM FastPfu DNA Polymerase购自北京全式金生物技术有限公司,核酸内切限制酶及T4 DNA连接酶购自Fermentas公司。
1.3 方 法
1.3.1 RNA提取及cDNA合成
根据Invitrogen公司RNA提取和逆转录试剂盒说明书提供的方法操作。
1.3.2 全长cDNA克隆
根据已获得的油茶油体蛋白基因[11]和油茶金属硫蛋白基因[12]全长cDNA序列设计引物,并根据软件分析在引物首端添加合适的核酸内切限制酶。各引物见表1。

表1 引物及酶切位点Table 1 Primers and restriction enzyme cutting sites
PCR反应体系为5×Trans Start Fast Pfu Buffer(Mg2+plus) 10.0μL,2.5mmol/L dNTPs 5.0μL,Trans Start Fast Pfu DNA Polymerase 1.0μL,正反向引物(10μmol/L)各1.0μL,Trans Start Fast Pfu DNA Polymerase 1.0μL,模板1.0μL,无菌水补充体积至50μL。扩增条件为94℃预变性5min,94℃变性30s,55℃退火30s,72℃延伸2min,共30个循环,之后72℃再延伸8min。
1.3.3 大肠杆菌中的诱导表达
将过夜培养的原始菌液按1∶50稀释,培养至OD值为0.5(大约3h)为初始诱导浓度,加入IPTG终浓度为0.5mmol/L,诱导时间为4~5h。经SDS-PAGE电泳检测外源蛋白在大肠杆菌中的诱导表达情况[13]。
1.3.4 电泳检测
琼脂糖凝胶电泳:取3µL待检DNA或PCR产物,与适量溴酚蓝-二甲苯青指示缓冲液充分混匀,点样至1.2%的琼脂糖EB染色的凝胶孔中,在TAE电泳缓冲液中110 V电压下电泳30min左右,在自动凝胶成像系统中观察并照相,根据同时电泳的100bp DNA Plus Ladder谱带作为相对分子质量参照物,粗略估计每条谱带的相对分子质量。
SDS-PAGE电泳:将等体积的2×SDS凝胶上样缓冲液加入到蛋白样品中,沸水浴处理5~10min,然后12 000r/min离心1min,吸取20~40 μL上样。配制12%的分离胶和5%的浓缩胶。按照8 V/cm的电压比例进行电泳,待溴酚蓝完全进入分离胶后,将电压调至15 V/cm,继续电泳至溴酚蓝跑出胶外。电泳完成后将凝胶取出,考马斯亮兰R-250染色,脱色4~5次,进行凝胶成像。
2 结果与分析
2.1 油体蛋白表达系统构建策略
理论上,构建成功的原核油体蛋白表达系统在转化大肠杆菌后,能表达有活性的融合蛋白,不需要繁琐的蛋白纯化过程,而是利用油体中油体蛋白、三酰甘油酯(TAG)和单层凝脂分子(PL)的天然比例混合后,在体外形成油体,通过油体在中性介质中离心漂浮,则可以将融合蛋白与其它杂蛋白分离,然后利用蛋白酶将目的融合蛋白从油体上切离而获得纯化的目的蛋白。
本研究中选择常用的原核表达载体pET-30a,采用“PCR+酶切连接”的方法将油茶油体蛋白基因Co_oleI插入载体,构建油体蛋白表达系统入门重组载体;同样采用“PCR+酶切连接”的方法,将准备通过油体蛋白表达系统获得的活性短肽基因(本研究中拟采用油茶金属硫蛋白基因),插入到入门重组载体的Co_oleI基因下游,并且确保2个基因之间有完整可表达的凝血蛋白酶位点,完成油茶油体蛋白表达系统的构建(见图1)。酶切位点选择遵循以下原则:属于载体多克隆位点,但是目的基因序列内部无此酶切位点;油体蛋白基因插入在待分离目的基因上游,且两者之间有可供酶切的凝血蛋白酶位点。
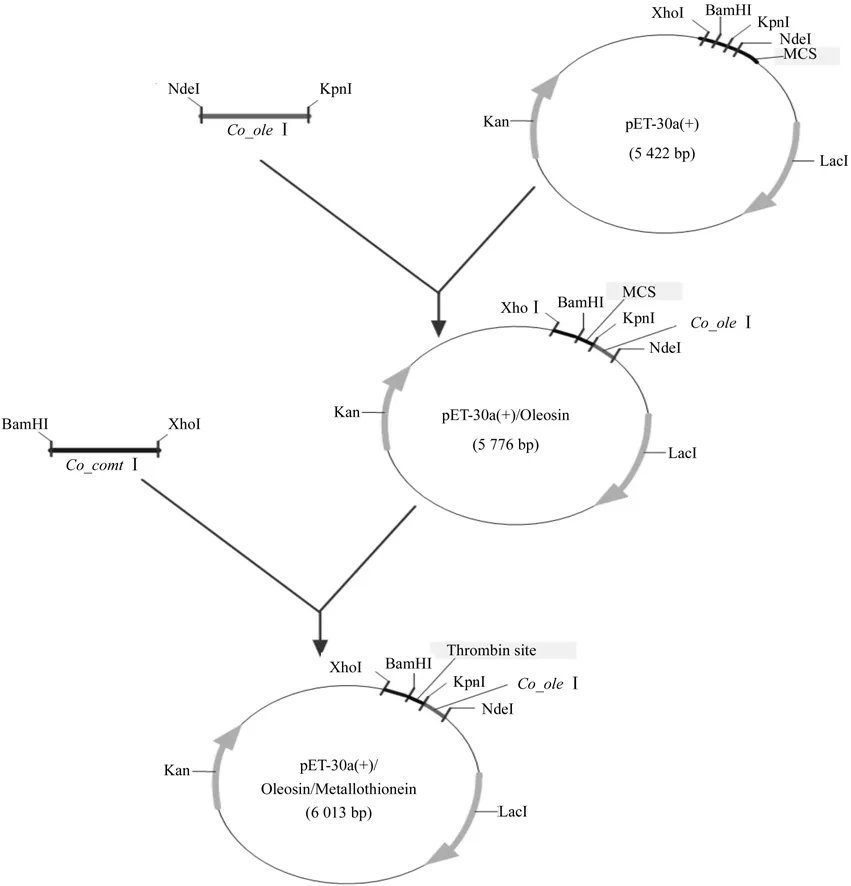
图1 油体蛋白表达系统构建流程(以金属硫蛋白基因为例)Fig.1 Construction of oleosin expression system (metallothionein gene as example)
2.2 油茶油体蛋白基因分离及原核表达
以油茶‘华硕’近成熟种仁cDNA为模板,采用特异引物,PCR扩展获得油茶油体蛋白基因Co_oleI,插入载体pET30a(+)多克隆位点,通过扩增、电泳检测(见图2A)及上海博尚生物技术有限公司测序确定pET30a(+)/Co_oleI重组载体构建成功,转化大肠杆菌BL21诱导表达,产物大小约16.68kDa(见图2B),与预期一致,说明入门重组载体构建成功。
2.3 油茶金属硫蛋白基因分离及原核表达
以油茶‘华硕’近成熟种仁cDNA为模板,采用特异引物,经PCR扩展获得油茶金属硫蛋白基因Co_comtI,插入载体pET30a(+)多克隆位点,通过扩增、电泳检测(见图3A)及上海博尚生物技术有限公司测序确定pET30a(+)/Co_comtI重组载体构建成功,转化大肠杆菌BL21诱导表达,产物大小约7.87kDa(见图3B),与预期一致,说明油茶金属硫蛋白原核表达体系构建成功。
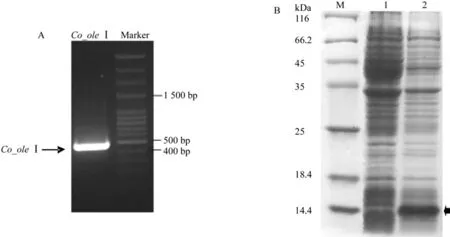
图2 油茶油体蛋白表达系统入门重组载体构建电泳Fig.2 Gel electrophoresis of the entry recombinant vector of oleosin expression system in C.oleifera
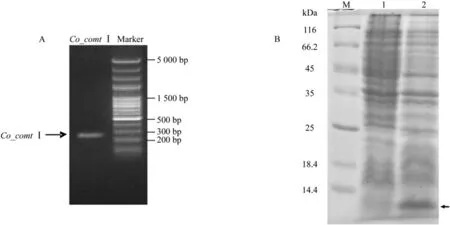
图3 油茶金属硫蛋白基因重组载体构建电泳Fig.3 Gel electrophoresis of the recombinant vector of metallothionein gene in C.oleifera
2.4 油茶油体蛋白+金属硫蛋白的融合表达载体检测
根据本项目中拟定的油茶油体蛋白表达系统构建策略,将油茶金属硫蛋白基因酶切连接至入门重组载体中,经扩增、电泳检测及上海博尚生物技术有限公司测序确定pET30a(+)/Co_oleI/Co_ComtI重组质粒构建成功(见图4)。
3 结 论

图4 油体蛋白表达系统重组载体凝胶电泳检测Fig.4 Gel electrophoresis of oleosin expression system recombinant vector
油体蛋白是油体所特有的一类蛋白,一般占种子总蛋白的2%~10%,对维持油体的稳定极为重要[14]。由于油体蛋白在油料植物种子中高水平积累,当外源基因以融合方式与油体蛋白一起表达时,表达产物通常也能达到较高的水平,而且外源蛋白和油体蛋白形成的重组融合蛋白非常稳定,可在种子中长期、稳定贮藏[15-16]。因此,新型的植物生物反应器(油体表达系统)应运而生。
油体表达系统生产外源蛋白的原理与重组质粒在原核生物体内大量表达外源基因相似,关键步骤在于载体构建。本研究中以大肠杆菌为寄主进行初步试验,结果表明构建油体表达系统需要采用两步克隆法,先构建油体蛋白基因原核表达载体,然后在油体蛋白基因下游插入外源蛋白基因,因为原核生物为多顺反子结构,一个启动子能够同时调控多个结构基因表达,通过两步克隆法构建的油体表达系统能够形成“外源蛋白+油体蛋白”的重组融合蛋白。本研究中成功构建了油茶油体蛋白表达系统的原核重组载体,但是能否正确表达有活性的外源蛋白还需进一步的条件优化试验。油茶油体蛋白表达系统另一关键技术是在外源蛋白和油体蛋白之间引入一个可被蛋白酶酶解的短肽结构。有研究表明[17],油体蛋白的两端插入短肽不会影响油体蛋白在油体上的定位。同时,利用油体中油体蛋白、甘油三酯和磷脂酸肌醇的天然比例混合后,能够在体外形成油体,通过油体在中性介质中离心漂浮,则可以将融合蛋白与其它杂蛋白分离,然后利用蛋白酶将目的融合蛋白从油体上切离而获得纯化的外源蛋白。
[1] 谭晓风,马履一,李芳东,等.我国木本粮油产业发展战略研究[J].经济林研究,2012,30(1):1-5.
[2] 龙正海,王道平.油茶籽油与橄榄油化学成分研究[J].中国粮油学报,2008,23(2):121-123.
[3] 朱 勇,王湘莹,马锦林.不同物种油茶籽仁含油率及其茶油的脂肪酸组成[J].经济林研究,2013,31(2):134-136.
[4] 廖书娟,吉当玲,童荣华.茶油脂肪酸组成及其营养保健功能[J].粮食与油脂,2005,(6):7-9.
[5] Sorgan S K,Jason T C,Tzen,et al.Gene family of Oleosin isoforms and their structural stabilization in sesame seed oil bodies[J].Biosci Biotechnol Biochem,2002,66(10):2146-2153.
[6] Tzen JTC,Lai YK,Chan KL,et al.Oleosin forms of high and low molecular weights are preset in the oil bodies of diverse seed species[J].Plant Physiol,1990,94:1282.
[7] VanRooijen G J H,Moloney M M.Plant seed oil-bodies as carriers for foreign proteins [J].Bio/Technology,1995,13:72-77.
[8] Parmenter D L,Boothe J G,Moloney M M.Production of biologically active hirudin in plant seeds using oleosin partitioning [J].Lant Mol Biol,1995,29(6):1167-1180.
[9] Liu J H,Selinger L B,Cheng K J,et al.Plant seed oil-bodies as an immobilization matrix for a recombinant xylanase from the rumen fungus Neocallimastix Patriciarum [J].Mol Breeding,1997,3:463-470.
[10] 谭晓风,袁德义,袁 军,等.大果油茶良种‘华硕’[J].林业科学,2011,47(12):150.
[11] 谭晓风,胡芳名,谢禄山,等.油茶种子EST文库构建及主要表达基因的分析[J].林业科学,2006,42(1):43-48.
[12] 蒋 瑶,谭晓风,张党权,等.一个油茶金属硫蛋白基因的克隆与序列分析[J].江西农业大学学报,2009,31(4):699-704.
[13] 谷振军,章怀云,张党权,等.赤桉木质素合成途径OMT基因家族的原核表达与纯化研究[J].中南林业科技大学学报,2014,34(6):24-27.
[14] 曾艳玲,谭晓风,张党权,等.油茶脂肪酸代谢途径中关键酶基因调控油脂合成的规律研究[J].中国粮油学报,2014,29(2):26-29,35.
[15] 徐柏森,郭 娟,彭方仁.木本植物营养贮藏蛋白质研究进展[J].植物学通报,2001,18(4):445-450.
[16] 张党权,谭晓风,陈鸿鹏.油茶油脂的生物合成及调控基因的特征[J].中南林业科技大学学报,2007,27(5):106-111.
[17] 程红焱,宋松良.种子的贮油细胞器——油体及其蛋白[J].植物学通报,2006,23(4):418-430.
