醒脑静对颅脑创伤的保护作用*
2014-01-22杨细平商崇智
涂 悦,杨细平,商崇智
(1.武警后勤学院附属医院脑科医院,天津300162;2.天津中医药大学,天津300193)
颅脑损伤(traumatic brain injury,TBI)是神经外科常见病,是导致创伤患者死亡、残疾的主要原因之一,病死率高达30%~50%[1]。目前对于颅脑损伤的治疗包括一般治疗、手术治疗、药物治疗、高压氧治疗和亚低温治疗等等。醒脑静注射液是在安宫牛黄丸的基础上改制而成的水溶性注射液,广泛应用于临床脑血管系统疾病的治疗中。因为是中药,国外对醒脑静的研究很少,国内对醒脑静的研究主要侧重于醒脑静注射液对颅脑损伤患者的促醒作用。而本研究采用Feeney’s自由落体法制备大鼠TBI模型,通过检测其脑内超氧化物歧化酶(superoxide dismutase,SOD))、丙二醛((malondialdehyde,MDA))含量及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性、脑含水量及S-100B蛋白和神经特异性烯醇化酶(neuron-specific enolase,NSE)水平,对大鼠神经功能缺损进行评分,旨在探讨醒脑静对颅脑损伤的保护作用及其可能机制,为临床用药提供理论依据。
1 材料与方法
1.1 试剂与器材
主要试剂:MDA、SOD、GSH-Px测定试剂盒(南京建成生物工程研究所),血清S-100B蛋白试剂盒(第四军医大学生理学教研室),NSE试剂盒(瑞典Can Ag Diagnostics AB公司),醒脑静注射液(无锡济民可信山禾药业股份有限公司)。仪器:自制自由落体打击装置(击锤、撞杆、打击支架);牙科钻(宁波医疗器械厂);S658型号电热恒温水浴箱(温州永强医疗器械厂);电子天平(北京赛多利斯仪器系统有限公司);DDL-5型离心机(上海安亭科学仪器设备厂);光学显微镜(日本Olympus公司)。
1.2 实验动物及分组
成年健康清洁级雄性SD大鼠63只,体重(280~300)g,由天津医科大学实验动物中心提供,随机分为3组(n=21):假手术组、模型组、醒脑静组。每组又分3个亚组(n=7),每个亚组,7只用于血清 S-100B蛋白和NSE水平测定,7只用于神经功能评分及脑含水量测定,7只用于测定大鼠血清中SOD、NDA和GSH-Px含量。
1.3 大鼠TBI模型的建立
采用参照 Feeney’s自由落体模型设计[2]制作TBI模型。将大鼠用 10%的水合氯醛(0.35 g/kg)腹腔内注射麻醉后,俯卧位置于平台上,固定头部。消毒后,沿右侧颅顶旁正中切口,分离骨膜,用牙科钻在前囱后1.5 mm,中线旁2 mm处钻一直径约4 mm的骨窗,保持硬脑膜完整,将撞杆头端置于骨窗硬膜外,用20 g重的击锤从30 cm高处自由坠落冲击撞杆,撞击能量为0.006 J,造成颅脑损伤,制作大鼠创伤性脑损伤模型。假手术组仅行开颅术,不造成脑损伤。醒脑静组在大鼠颅脑损伤模型制好后10 min内经尾静脉注射醒脑静注射液 10 ml/(kg·d),模型组与假手术组则经尾静脉注射等量0.9%氯化钠溶液,三组均连续给药7 d。
1.4 神经功能缺损评分
三组大鼠于给药第7天进行神经功能缺损评分,评分量表包括3个方面,即运动试验(提尾时大鼠前肢屈曲、后肢屈曲、头部在30 s内偏离垂直轴>100°分别评为1分;将大鼠放于地板上,大鼠正常行走评0分,不能直线行走评1分,向轻瘫侧转圈评2分,向轻瘫侧倾倒评3分)、感觉试验(放置试验1分,本体感觉试验1分,平衡木试验根据轻重程度分为0-6分)、反射丧失和不正常运动(耳廓反射,角膜反射,惊恐反射,癫病、肌阵挛、肌张力障碍各占1分),最低为0分,最高为18分,其中0~6分为轻度损害、7~12分为中度损害、13~18分为重度损害。
1.5 脑组织含水量测定
将大鼠断头处死,以损伤灶为中心取出约6 mm3的脑组织,分别置于预先称好质量的容器内,用电子天平称重。然后放入110℃干燥箱烘烤48 h至恒重,采用同样方法称取烘干后脑组织质量,根据干湿质量法[3]计算脑组织含水率,计算公式:(湿质量-干质量)/湿质量×100%。
1.6 脑组织SOD、MDA和GSH-PX含量的测定
将大鼠用60 ml预冷的人工脑脊液(mACSF)快速心脏灌流后断头取脑,精确称重后制备成10%的脑匀浆,4℃ 3 000 r/min离心 10 min后,取上清液-70℃保存用于检测标本。SOD用黄嘌呤氧化酶法测定,MDA用硫代巴比妥酸法测定,GSH-Px活性用比色法测定,均严格按试剂盒操作程序进行。
1.7 血清 S100B蛋白和 NSE水平测定
将各组断头取血3 ml,血标本于3 000 r/min离心3 min后,取血清置-20℃冰箱保存,离心后取上清液0.5 ml,采用酶联免疫吸附实验 (ELISA)法检测血清中S-100B蛋白和NSE含量。
1.8 统计学处理
2 结果
2.1 颅脑损伤大鼠神经功能评分和脑含水量比较
与假手术组比较,醒脑静组与模型组有明显的神经缺损,脑组织含水量明显增加(P<0.01,表1);与模型组比较,醒脑静组神经缺损程度及脑含水量明显低于模型组(P<0.01)。实验结果说明颅脑损伤可造成大鼠神经功能缺损、增加脑含水量,引起脑水肿,醒脑静治疗7 d后可减轻大鼠神经功能缺损程度,降低脑含水量。
2.2 颅脑损伤大鼠血清SOD、NDA和GSH-Px比较
与假手术组比较,醒脑静组与模型组SOD、GSHPx含量明显降低,MDA含量明显增加(P<0.01);与模型组比较,血清中MDA升高水平明显低于模型组,SOD、GSH-Px降低程度明显低于模型组(P<0.05,P<0.01,表 2)。

Tab.1 Changes of neural function score and cerebral water content in rats after traumatic brain injury(¯x±s,n=7)

Tab.2 Levels of MDA,SODand GSH-Px in the serum of rats(¯x±s,n=7)
2.3 颅脑损伤大鼠脑血清S-100B和NSE比较
与假手术组比较,醒脑静组与模型组S-100B蛋白和NSE水平明显升高(P<0.01);与模型组比较,醒脑静组NSE蛋白水平明显降低(P<0.01,表3)。
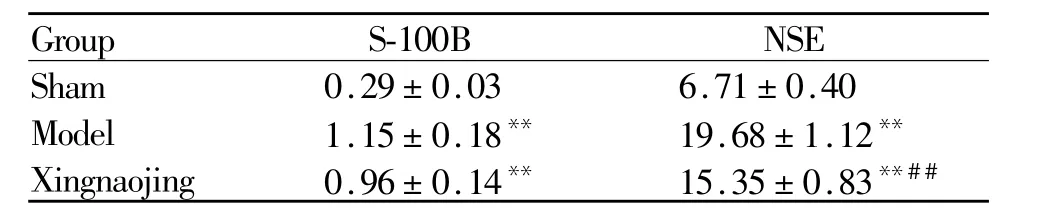
Tab.3 Contents of S-100B and NSE in the serum of rats(μg/L,¯x±s,n=7)
3 讨论
颅脑损伤后会产生大量自由基,自由基在脑外伤后的继发性脑损伤中扮演极其重要的作用,它主要产生于血管内皮细胞和脑细胞,损害核酸、蛋白质及脂质,引起血管源性脑水肿和细胞死亡。因此增强机体抗氧化能力,有助于预防继发性脑损伤、促进受损脑组织康复[4]。S-100B是一种脑特异性蛋白,主要存在于中枢神经系统,由星形胶质细胞合成和分泌[5]。主要功能包括:(1)在生理浓度下,S-100B具有神经营养作用,高浓度的S-100B具有神经毒性作用。(2)能够营养5-羟色胺神经元,同时又受到5-羟色胺负反馈的调节,从而调控神经细胞的能量代谢过程。(3)参与细胞内外钙离子水平的调节,维持内环境稳定。(4)增强三磷酸腺苷酶的活性。NSE属于糖酵解同工酶二聚体,在神经细胞的细胞质中浓度较高,颅脑损伤时血清中NSE含量会升高,目前研究认为NSE含量升高的主要原因是损伤导致神经元细胞膜功能与结构受损,NSE从神经元胞浆中释放出来,进入脑脊液和细胞间隙中,透过破损的血脑屏障NSE进入血液循环。因此,血清S-100B和NSE与脑损伤的严重程度密切相关[6],具有较高特异性和敏感性,对脑损伤的诊断及伤势的评估具有重要的临床价值。
醒脑静注射液是在安宫牛黄丸的基础上改制而成的水溶性注射液,主要由麝香、石菖蒲、郁金、藿香、冰片等成分组成,具有醒神止痉、活血化瘀、清热解毒的作用。有研究表明,醒脑静注射液具有降低毛细血管通透性、减轻脑水肿、清除自由基等作用,可以在分子水平上进行脑保护[7]。本研究结果显示醒脑静注射液对颅脑损伤具有保护作用。研究表明麝香的有效成分是麝香酮,它可以减轻脑缺血大鼠超微结构的损伤和降低神经功能缺损程度[8];石菖蒲提取液可以降低脑损伤大鼠的脑含水量,减轻脑水肿[9];石菖蒲、冰片合用可以抑制颅脑损伤后脑内细胞黏附分子-1的表达,减轻脑组织的炎症反应、外伤性脑水肿和神经细胞缺氧性损伤[10]。
本实验采用Feeney’s法制作大鼠TBI模型,具有损伤方法简便,条件易于控制,损伤程度较一致等特点[11]。通过测定醒脑静组与对照组脑组织含水量、自由基水平(SOD、NDA和 GSH-Px)及神经特异性烯醇化酶(NSE)、S-100B蛋白水平,观察大鼠神经缺损程度来判定醒脑静对颅脑损伤的疗效。结果表明醒脑静治疗7 d后可减轻大鼠神经功能缺损程度,减少脑组织含水量,增强SOD和GSH-Px活性,减轻氧自由基和脂质过氧化物对神经元的损伤。
综上所述,本研究结果显示醒脑静注射液对大鼠颅脑损伤具有保护作用,其作用机制可能与减轻颅脑损伤后脑水肿及抑制氧自由基反应、保护神经细胞有关,为临床用药提供了理论依据。
[1] Arango-Lasprilla JC,Ketchum JM,Gfu D,et al.Predictors of extended rehabilitation length of stay after traumatic brain injury[J].Arch Phys Med Rehabil,2010,91(10):1495-1504.
[2] Feeney DM,Boyeson MG,Linn RT,et al.Responses to cortical injury:1.Methodology and local effects of contustions in the rat[J].Brain Res,1981,211(1):67-77.
[3] Kouzounias K,Kimiskidis VK,Siozos T,et al.Topiramate promotes neurological recovery in a new model of traumatic brain injury in rats[J].Neurosci,2011,183:171-177.
[4] 季建平.超氧化物歧化酶微量快速测定法[J].南京铁道医学院学报,1991,10(3):197.
[5] 张祥根,姜正林,王国华,等.高压氧治疗创伤性脑损伤的效用及机制研究[J].中国应用生理学杂志,2012,28(1):42-46.
[6] 廖创新,王海军.甲基强的松龙对脑损伤大鼠血清神经组织蛋白 S100和神经元特异性烯醇化酶的影响[J].中华创伤杂志,2004,20(11):671-673.
[7] 刘卫平,易声禹,章 翔,等.大鼠急性颅脑损伤早期微血管改变的形态学研究[J].中华神经外科杂志,1996,12(1):46.
[8] 梁 辉,陈 虎,高 颖,等.麝香酮抗局灶性脑缺血损伤的实验研究 [J].中成药,2003,25(3):225-227.
[9] 方永奇,李 翎,邹衍衍,等.石菖蒲对缺血-再灌注脑损伤大鼠脑电图和脑水肿的影响 [J].中国中医急症,2003,12(1):55-56.
[10]蒋红兰,匡忠生,李 翎,等.石菖蒲冰片对神经细胞缺氧性损伤的保护作用 [J].广州中医药大学学报,2003,20(1):63-65.
[11]李建伟,杨东军,陈旭义,等.奥拉西坦对颅脑损伤大鼠的保护作用[J].中国应用生理学杂志,2013,29(4):298-300.
