熊果酸对糖尿病小鼠肾病的保护作用及机制研究*
2014-01-22齐敏友杨钧杰潘定一
齐敏友,杨钧杰,周 斌,潘定一,孙 娴
(浙江工业大学药学院,杭州310014)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见的微血管并发症,是导致糖尿病患者终末期肾病的首要原因。众多研究表明,氧化应激、血流动力学改变、纤维化和炎症因素以及激酶途径在糖尿病肾病的发生发展过程中起重要作用[1]。近年来氧化应激和炎症因素,尤其是炎症因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素 -6(interleukin-6,IL-6)在DN发病中的作用越来越受到学者的重视[2]。熊果酸(ursolic acid,UA)是一种五环三萜类化合物,已被证明具有抗肿瘤、抗炎、降血糖及免疫调节等作用[3,4]。Chen[5]等发现 UA能够通过抑制肾组织核因子-κB(nuclear factor kappa-B,NF-κB)活性和 P-选择素(P-selectin)的表达抗 DN,但UA是否可以通过抑制炎症因子TNF-α和IL-6而抗DN尚无报道。本实验通过四氧嘧啶建立糖尿病肾病小鼠模型,观察UA对肾组织中氧化应激指标和TNF-α、IL-6的作用,为进一步研究UA抗DN作用及机制提供实验依据。
1 材料与方法
1.1 药品与主要试剂
熊果酸(HPLC测定纯度98%),由湖南上禾生物科技提供;四氧嘧啶,由Sigma公司生产,上海贝基生物有限公司分装,批号:20080210;TNF-α、IL-6试剂盒,由武汉博士德生物工程有限公司提供;尿素氮、肌酐、丙二醛、超氧化物歧化酶试剂盒、考马斯亮兰测试盒,均由南京建成生物工程有限公司提供。
1.2 主要仪器设备
稳豪血糖仪和血糖试纸(美国强生公司);HM325型轮转式石蜡切片机(德国美康公司);离心机、紫外分光光度计(巩义市英峪予华仪器厂);104型电子天平(Made by Mettler-Toledo Group);WB22型恒温水浴箱(Made in German)。
1.3 实验动物
健康雄性昆明种小鼠,体重(20±2)g,由浙江医学科学院实验动物中心提供。合格证号:SCXK(浙)-2008-0033。
1.4 糖尿病小鼠肾病模型的建立
雄性昆明种小鼠,分笼饲养。禁食不禁水12 h后,一次性尾静脉注射四氧嘧啶(70 mg/kg)。72 h后,空腹尾静脉取血测血糖,血糖高于13.9 mmol/L者视为糖尿病小鼠模型,随机分为模型组和熊果酸组,每组10只,另取10只正常小鼠作为对照组。熊果酸以生理盐水混悬35 mg/kg灌胃,连续给药 8周。对照组和模型组用等体积生理盐水灌胃。
1.5 血糖、肌酐和尿素氮的测定
末次给药后空腹12 h,用血糖测定仪测定各组小鼠血糖。摘眼球取血,静置,4℃离心(3 500 r/min,10 min),取上清-20℃保存待测。血清肌酐(creatinine,Cr)、尿素氮(blood urine nitrogen,BUN)含量按照试剂盒说明测定。
1.6 脏器系数
处死小鼠,快速取出左侧肾脏,剔除周围结缔组织和脂肪,生理盐水洗净,滤纸吸干后称取肾脏重量,根据末次体重计算肾脏脏器系数(肾脏重/体重)。
1.7 肾组织 MDA含量、SOD活力及炎症因子TNF-α、IL-6的测定
取适量肾组织,冰浴条件下制10%匀浆液,4℃离心(3 000 r/min,10 min),取上清,-20℃保存。肾组织SOD活性和MDA含量按照试剂盒说明测定;ELISA法测定TNF-α、IL-6的水平。
1.8 组织学检测
取右肾,4%多聚甲醛固定,石蜡包埋切片,经HE染色后于光镜下观察其病理学改变。
1.9 统计学处理
2 结果
2.1 熊果酸对糖尿病小鼠一般体征、血糖和脏器系数的影响
对照组小鼠精神状态良好、反应灵敏、毛色光亮,尿量正常,体重逐渐增加。模型组小鼠精神萎靡、反应迟钝,并表现出明显的多饮、多尿症状,同时体重减轻,血糖较对照组显著上升(P<0.01,表1)、肾脏脏器系数明显增大(P<0.05)。UA组小鼠一般体征较对照组相近,血糖较模型组有明显下降(P<0.05),脏器系数亦明显减小(P<0.05),表明UA能够有效降低DN小鼠血糖,改善肾脏肥大。
Tab.1 Effects of ursolic acid on blood glucose and the ratio of kidney weight to body weight(,n=10)
UA:Ursolic acid*P<0.05,**P<0.01 vs control;#P<0.05 vs model
Group Glucose(mmol/L) Kidney weight/body weight(mg/g )Control 5.4±0.8 5.5±0.6 Model 19.8±1.2** 7.1±0.8*UA 13.3±1.1# 6.2±0.9#
2.2 熊果酸对小鼠Cr和BUN的影响
模型组小鼠Cr和BUN水平较对照组明显升高(P<0.05);UA组 Cr和 BUN水平均明显低于模型组(P<0.05,表2),表明 UA对 DN小鼠肾功能有明显改善作用。
Tab.2 Effects of ursolic acid on renal function in renal tissue(,n=10)
BUN:Blood urine nitrogen;Cr:Creatinine;UA:Ursolic acid*P<0.05 vs control;#P<0.05 vs model
Group Cr(μmol/L) BUN(mmol/L)Control 75.5±9.6 6.5±1.1 Model 90.1±9.8* 13.1±2.1*UA 81.2±8.9# 8.2±1.6#
2.3 熊果酸对糖尿病小鼠肾组织 SOD活力和MDA含量的影响
模型组小鼠肾组织中SOD活力明显低于对照组(P<0.05),而 MDA含量显著升高(P<0.01),提示机体抗氧化能力下降,肾组织中存在过度的氧自由基;UA组 SOD活性明显增加(P<0.05),同时MDA含量显著减少(P<0.01,表3),提示 UA能够提高肾组织的抗氧化能力,可能通过消除氧自由基从而保护肾组织。
Tab.3 Effects of ursolic acid on the activitity of SODand the level of MDA in renal tissue(,n=10)

Tab.3 Effects of ursolic acid on the activitity of SODand the level of MDA in renal tissue(,n=10)
SOD:Superoxide dismutase;MDA:Malondialdehyde;UA:Ursolic acid*P<0.05,**P<0.01 vs control; #P<0.05,##P<0.01 vs model
Group SOD(U/mg pro) MDA(nmol/mg pro )Control 109.8±13.1 4.3±0.3 Model 90.2±8.7* 7.1±0.4**UA 98.5±9.8# 5.1±0.2##
2.4 熊果酸对肾组织中炎症因子TNF-α和IL-6的影响
模型组两种炎症因子浓度较对照组均显著升高(P<0.01);给予 UA干预后能明显降低 TNF-α和IL-6水平(P<0.05,表 4)。提示 UA可通过抑制DN肾组织炎症因子的表达保护肾脏。
Tab.4 Effects of ursolic acid on the expression of TNF-αand IL-6 in renal tissue(,n=10)

Tab.4 Effects of ursolic acid on the expression of TNF-αand IL-6 in renal tissue(,n=10)
TNF-α:Tumor necrosis factor-α;IL-6:Interleukin-6;UA:ursolic acid**P<0.01 vs control;#P<0.05 vs model
Group TNF-α(ng/ml) IL-6(pg/ml )Control 1.21±0.23 124.8±10.1 Model 2.73±0.34** 164.2±12.8**UA 1.92±0.41# 139.5±11.7#
2.5 熊果酸对肾组织结构的影响
肾组织进行HE染色,光镜下观察。结果显示:对照组肾小管排列整齐,未出现肾小管-间质损伤,可见少量炎性细胞。模型组肾固有细胞萎缩,排列紊乱,肾小管-间质有显著损伤并可见大量炎性细胞浸润。UA组明显改善肾固有细胞状态,炎性细胞浸润减少(图 1)。
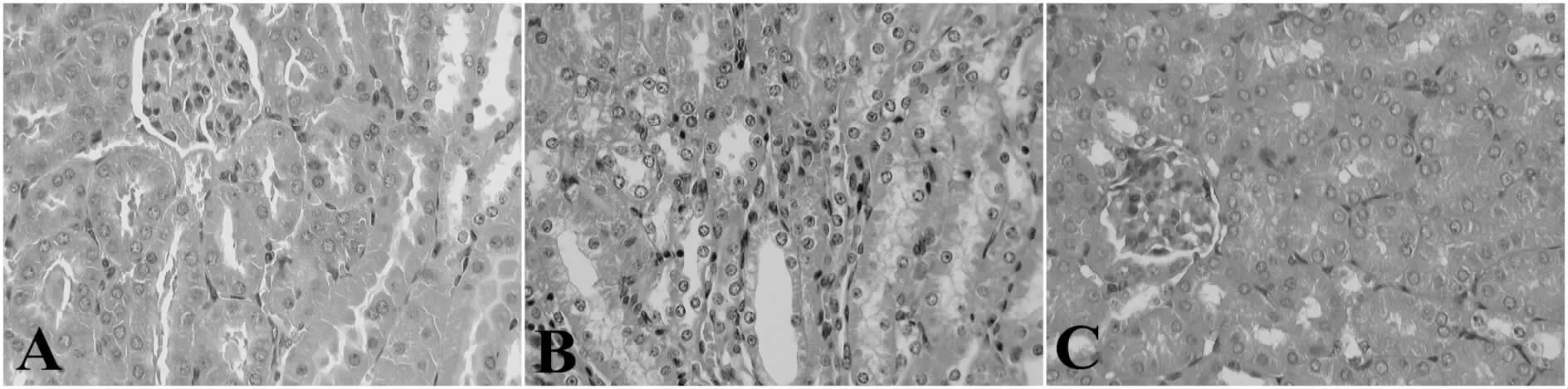
Fig.1 Pathological changes of mice renal tissue histopathology of testicular tissues in each group(HE ×200)
3 讨论
本次研究以四氧嘧啶诱导小鼠糖尿病肾病模型,小鼠空腹血糖显著升高,表明模型初步建立。肾功能及HE染色结果显示:造模小鼠血清肌酐和尿素氮水平明显上升,肾小球体积显著增大,肾小管排列紊乱,肾小管-间质有显著损伤,进一步表明DN模型建立成功。此外,实验结果显示模型组小鼠肾脏抗氧化能力减弱,炎症因子(TNF-α、IL-6)生成增加。干预药熊果酸是一种非水溶性有机化合物,用生理盐水+羧甲基纤维素钠溶解效果不理想,因此选择用生理盐水制成混悬液,超声混匀后灌胃。DN小鼠给予熊果酸干预后能够有效降低血糖,提高肾组织抗氧化能力,抑制炎症因子表达,改善肾功能,对肾脏起保护作用。
大量研究表明,高血糖介导的氧化应激在糖尿病肾病的发生发展过程中起重要作用。活性氧(reactive oxygen species,ROS)过度积聚是其重要表现之一,过多的ROS能够引起脂质过氧化,产生脂质过氧化物,如MDA、羟基和酮基等,进而使蛋白质和氨基酸氧化、交联导致肾损伤[6];此外,Mona[7]等研究发现ROS能够介导肾组织中性粒细胞炎性浸润,进而产生炎症级联反应,最终导致肾组织炎性损伤和纤维化。机体抗氧化能力降低是氧化应激的另一个重要表现,SOD是其中一种主要的抗氧化酶,主要通过清除超氧阴离子保护细胞免受损伤,SOD活力高低可间接反映机体清除自由基、保护细胞免受自由基损伤的能力。我们的研究结果显示,模型组小鼠肾组织中MDA含量较正常组增加65.1%,而 SOD活力降低17.9%,表明四氧嘧啶所致DN小鼠肾组织氧化应激水平增强。UA干预后,小鼠血糖较模型组明显下降,肾组织中MDA含量下降28.2%,SOD活力上升9.2%,表明熊果酸具有较好的降血糖和抗氧化能力,这与我们的前期研究及文献报道一致[8,5]。
近年来,有关DN炎性损伤假说日益完善:糖尿病状态下,高血糖、血流动力学紊乱和氧化应激水平上升均能介导炎性细胞浸润,如白细胞、巨噬细胞、T-淋巴细胞等,这些炎性细胞可以产生包括白细胞介素(interleukin-1,IL-1)、TNF-α、干扰素-γ(interferon-γ,INF-γ)等多种致炎因子,进而诱导正常肾脏细胞产生一系列的趋化因子;产生的趋化因子进一步诱导炎性细胞浸润,从而形成一个炎性循环,最终导致肾组织炎性损伤。TNF-α在肾损伤过程中发挥了重要作用,一方面它作为一个炎症信号放大器,介导IL-6等多种炎症因子和趋化因子超表达,加剧炎症反应;另一反面又能诱导纤维化因子表达增加,引起肾固有细胞肥大和纤维化[9]。IL-6是另一个在DN发展过程中起重要作用的炎性因子,其超表达可引起内皮通透性改变,诱导纤连蛋白表达增加,并与肾小球基底膜(glomerular basement membrane,GBM)增厚密切相关[10]。本次实验结果显示,模型组小鼠肾组织炎性基本结构损伤,细胞浸润明显,肾组织中TNF-α、IL-6含量较对照组明显增多,肾功能下降。UA干预能够有效减少炎性细胞浸润,减少TNF-α、IL-6生成,保护肾脏功能。提示UA可通过抑制炎症因子TNF-α、IL-6生成这一途径,减轻DN的炎性损伤。
综上所述,高水平的氧化应激和炎症因子TNF-α、IL-6的增多加剧DN过程,UA能有效减轻DN引起的肾脏损伤,其可能机制包括降血糖、增加机体抗氧化能力和抑制炎性因子TNF-α、IL-6的生成。由于目前对DN缺乏有效的治疗手段,因此研究UA保护DN小鼠肾脏的作用和机制,对开发中药治疗DN具有重要意义。
[1] Li J,Lim SS,Lee JY,et al.Purple corn anthocyanins dampened high-glucose-induced mesangial fibrosis and inflammation:possible renoprotective role in diabetic nephropathy[J].J Nutr Biochem,2012,23(4):320-331.
[2] 张 怡,黄国良.高糖诱导肾小球系膜细胞表达TNF-α的机制探讨[J].中国应用生理学杂志,2012,28(4):316-318.
[3] 张新华,朱 萱.熊果酸药理学的最新研究进展[J].中国中西医结合杂志,2011,31(9):1285-1289.
[4] Zang LL,Wu BN,Lin Y,et al.Research progress of ursolic acid’s anti-tumor actions[J].Chin J Integr Med,2014,20(1):72-79.
[5] Ling C,Lu JP,Xia L,et al.Ursolic acid provides kidney protection in diabetic rats[J].Curr Ther Res Clin Exp,2013,75:59-63.
[6] Wang JC,Zhao Y,Chen SJ,et al.AOPPs induce MCP-1 expression by increasing ROS-mediated activation of the NF-κB pathway in rat mesangial cells:inhibition by sesquiterpene lactones[J].Cell Physiol Biochem,2013,32(6):1867-1877.
[7] Sedeek M,Nasrallah R,Touyz RM,et al.NADPH oxidases,reactive oxygen species,and the kidney:friend and foe[J].J Am Soc Nephrol,2013,24(10):1512-1518.
[8] 杨钧杰,宫 燕,史 杰,等.熊果酸对实验性糖尿病小鼠心肌纤维化作用的研究[J].中国应用生理学杂志,2013,29(4):353-356.
[9] Rajesh M,Mukhopadhyay P,Bátkai S,et al.Cannabidiol attenuates cardiac dysfunction, oxidative stress,fibrosis,and inflammatory and cell death signaling pathways in diabetic cardiomyopathy[J].J Am Coll Cardiol,2010,56(25):2115-2125.
[10]Navarro-González JF,Mora-Fernández C,Muros de Fuentes M,et al.Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy[J].Nat Rev Nephrol,2011,7(6):327-340.
