石榴皮多酚分离纯化及对脂肪酸合成酶抑制作用的研究
2014-01-21杨舒慧唐鹏程焦士蓉
蒲 博,李 兵,杨舒慧,唐鹏程,焦士蓉,*
石榴皮多酚分离纯化及对脂肪酸合成酶抑制作用的研究
蒲 博1,李 兵1,杨舒慧2,唐鹏程1,焦士蓉1,*
(1.西华大学生物工程学院,四川 成都 610039;2.云南金雨庄生物科技有限责任公司,云南 昆明 650000)
以总多酚质量分数、吸附率、解吸率为指标,进行石榴皮总多酚的分离纯化研究,并通过反相高效液相色谱(reverse phase high performance liquid chromatography,RP-HPLC)法测定石榴皮多酚中的鞣花酸、安石榴苷、绿原酸、槲皮素和表儿茶素质量分数。同时研究石榴皮多酚纯化物对脂肪酸合成酶的抑制作用。结果表明:石榴皮多酚纯化的最佳条件为采用D101大孔树脂,石榴皮溶液进柱质量浓度为10 mg/mL,流速为2 BV/h,清洗用水5 BV,乙醇洗脱剂的体积分数为70%,用量为5.5 BV;纯化后石榴皮多酚质量分数为71.64%,较纯化前多酚质量分数49.31%有明显提高;纯化后石榴皮多酚中安石榴苷、鞣花酸、绿原酸、槲皮素和表儿茶素质量分数分别为46.91%、9.44%、0.53%、0.75%、0.32%。石榴皮多酚提取物对脂肪酸合成酶的半最大效应浓度(concentration for 50% of maximal effect,EC50)为0.72 mg/mL,说明石榴皮多酚对脂肪酸合成酶具有较好的抑制作用。
石榴皮多酚;脂肪酸合成酶;纯化;抑制
石榴皮(pomegranate peel)是石榴干燥后的果皮,性酸、味涩,具有止血、涩肠、杀虫的效用,是临床常用中药[1-4]。经反相高效液相色谱(reverse phase high performance liquid chromatography,RP-HPLC)分析,石榴皮中含安石榴苷、鞣花酸等多酚类物质,且含量较高[5-8]。研究表明安石榴苷和鞣花酸具有抑制癌细胞增殖、抗突变和抗氧化作用[9-14]。大孔吸附树脂具有吸附容量大、吸附速度快、选择性好、再生简便等优点,因而被广泛用于天然产物的分离纯化[15-20]。目前,普遍认为脂肪酸合成酶在能量代谢中发挥着重要作用。近年来的研究发现,脂肪酸合成酶(fatty acid synthetase,FAS)可能是治疗肥胖和癌症的双重靶点[21]。虽然有研究发现部分减肥、抗菌药也具有较强的FAS抑制活性,但都具有不稳定、毒性高等缺点[22],作为药物广泛应用还具有一定的局限性,因此开发高效、低毒、性能更稳定的FAS抑制剂成为当前该领域研究的热点[23]。
本实验比较了不同树脂以及不同方式对石榴皮多酚的分离纯化效果,并研究了纯化物对FAS的抑制作用。
1 材料与方法
1.1 材料与试剂
石榴皮 成都中药饮品有限公司;FAS 本实验室提取。
鞣花酸、槲皮素、绿原酸、表儿茶素、安石榴苷美国Sigma公司;D101型大孔树脂、DI40型大孔树脂成都科龙试剂厂;AB-8型大孔树脂、D160型大孔树脂、HPD722型大孔树脂 河北沧州宝恩化工有限公司。
1.2 仪器与设备
UV-2600型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;Heto Lyolab 3000冻干机 上海汇分电子科技有限公司;LC20高效液相色谱系统(配有SPDM20A二极管阵列检测器、CTO-20A柱温箱和SIL-20AC自动进样器) 日本岛津公司。
1.3 方法
1.3.1 石榴皮粗提物的制备
以水为提取溶剂,料液比为1∶30(m/V),提取温度为75 ℃,提取时间为140 s,对石榴皮多酚进行提取,提取液旋转蒸发浓缩后,冷冻干燥得石榴皮粗提取物。
1.3.2 大孔树脂的预处理
将大孔树脂(D101、DI40、AB-8、D160、HPD722)用无水乙醇浸泡24 h,将树脂溶胀后上柱冲洗,先用无水乙醇冲洗至流出液加适量水至无白色混浊,再用蒸馏水洗至无醇味。接着酸碱处理树脂,先后以体积分数均为5%的盐酸和氢氧化钠对其处理,采用5 BV/h的流速。等待3 h后以相同流速用蒸馏水洗至中性,蒸馏水浸泡后以作备用。
1.3.3 大孔树脂比较与选择
称取各树脂2 g,将其分别加入装有50 mL质量浓度为9 mg/mL的石榴皮初提取物冻干粉的三角瓶中,于25 ℃恒温振荡器上,以115 r/min的转速振荡20 h,让树脂饱和吸附。然后测定上清液中多酚的质量浓度(ρe),接着滤去三角瓶中溶液,蒸馏水洗涤2 次,然后加入无水乙醇相同条件处理3 h,测其解吸液中多酚的质量浓度(ρd)。分别按如下公式计算吸附率、吸附量、解吸率。
式中:ρ0为石榴皮提取物中多酚的质量浓度/(mg/mL);ρe为清液中多酚的质量浓度/(mg/mL);ρd为解吸液中多酚的质量浓度/(mg/mL);V0为石榴皮提取物溶液体积/mL;m为树脂质量/g。
1.3.4 大孔树脂对石榴皮多酚的静态吸附与解吸
方法与1.3.3节相同。
1.3.5 大孔树脂对石榴皮多酚的动态吸附与解吸
1.3.5.1 大孔树脂对石榴皮多酚的动态吸附性能
称取树脂2 g,采取湿法上柱,用质量浓度为10 mg/mL的石榴皮提取物溶液以2 BV/h的流速过柱。每半柱体积取流出液进行吸光度检测,测其多酚质量浓度,绘制大孔树脂对石榴皮多酚质量浓度的吸附曲线图。
1.3.5.2 树脂清洗用水量的确定
用水洗脱树脂中的多糖,对水洗脱剂每一柱用水测量一次多酚丢失率和多糖反应情况,以此来确定清洗水的用量。

多糖反应:检验方法为α-萘酚浓硫酸法,将待测水溶液取量1 mL,加入5%的萘酚数滴,振荡摇匀后,向里面再加入5~6 滴浓硫酸,使其分为两层,再隔2~3 min后两层液体的液面有紫红色的环状出现,这就说明其中有多糖,由此就可已确定出洗脱剂用量的合适度。
1.3.5.3 乙醇洗脱剂用量
以体积分数为70%的乙醇对吸附的树脂进行解吸,每隔半个柱体积收集一管解吸溶液,测其多酚质量浓度。然后以乙醇用量为横坐标,以解吸液中的多酚质量浓度为纵坐标,绘制解吸曲线图,以确定乙醇最佳洗脱量。
1.3.6 石榴皮多酚质量浓度的测定
多酚质量浓度采用福林-酚比色法测定[24]。在283 nm波长处测定其吸光度,以吸光度为纵坐标,石榴皮多酚质量浓度为横坐标,做标准曲线,得到标准曲线方程为y=102.4x-3.606(R2=0.999 8),式中:x为石榴皮多酚质量浓度/(mg/mL),y为吸光度。
1.3.7 色谱条件
采用反相高效液相色谱法,石榴皮多酚中绿原酸、表儿茶素、鞣花酸和槲皮素质量分数测定采用色谱柱Hypersil ODS2(250 mm×4.6 mm,5 μm),其流动相为乙腈-0.4%磷酸(17∶83,V/V),流速为1.0 mL/min,检测波长310 nm,柱温为30 ℃。安石榴苷测定采用色谱柱为Hypersil ODS2(250 mm×4.6 mm,5 μm);流动相为甲醇-2%冰醋酸(7∶93,V/V);体积流量为1.0 mL/min;检测波长为232 nm;柱温25 ℃,进样量均为20 μL。
1.3.8 脂肪酸合成酶活性的测定[25]
于含有1 mmol/L EDTA、pH值为7、浓度为0.1 mmol/L的磷酸钾缓冲液中进行,底物浓度为乙酰CoA 6 μmol/L,丙二酰CoA 12 μmol/L,NADPH 37.5 μmol/L,体积为2 mL,1 cm光径于37 ℃水浴恒温4~5 min,加入50 μL稀释后的高速离心上清液启动酶反应,于340 nm波长处连续监测吸光度变化。
动物FAS的活性单位(U)规定为每分钟氧化14 nmol NADPH的酶量,因此,每毫升高速离心上清液酶活力(E)用下式计算。

式中:V为测酶活体积数0.002 L;C为稀释倍数;106为mmol转换nmol系数;ΔA340nm为340 nm波长处的吸光度变化值;ε为NADPH氧化为NADP时在340 nm波长处的毫摩尔消光系数,此处为6.022 L/mmol。
1.3.9 石榴皮多酚对脂肪酸合成酶的抑制作用
取本实验室纯化的石榴皮提取物,配制成质量浓度为900 mg/L的溶液,分别吸取20、40、60、80、100、120、140 μL,然后再分别加蒸馏水130、110、90、70、50、30、10 μL,配制成150 μL溶液,再加入到反应体系中,测定酶活性大小,分析石榴皮提取物在不同质量浓度下对酶活力的影响。
2 结果与分析
2.1 大孔树脂比较与选择结果
由于各树脂之间存在孔径、极性等种别差异,所以吸附与解吸的效果不一样,由表1可知,D101树脂的吸附率最大,可以到达73.13%,而它的解吸率为81.33%,仅次于HPD722型树脂。与其他各型树脂相比它还有最大的静态吸附量,其静态吸附量为81.14 mg/g,因此选用D101树脂。
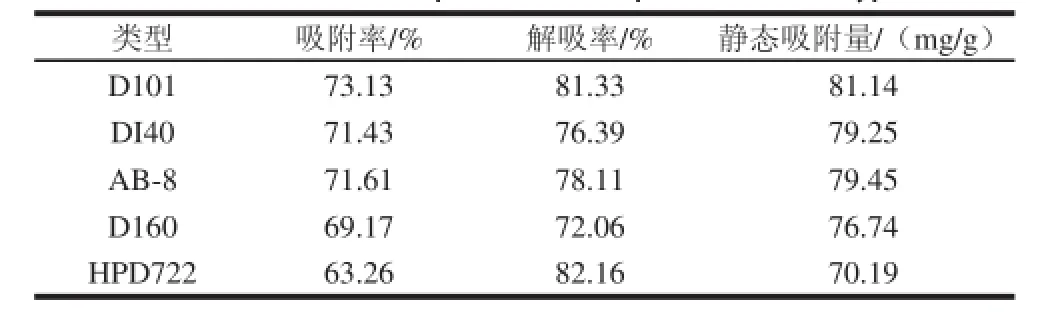
表1 各大孔树脂对石榴皮多酚的静态饱和吸附与解吸参数Table 1 Parameters of adsorption and desorption for various types of resin
2.2 大孔树脂对石榴皮多酚的静态吸附与解吸实验
2.2.1 石榴皮多酚质量浓度选择

图1 石榴皮多酚质量浓度选择Fig.1 Screening of optimal sample concentration
由图1可知,随石榴皮多酚浓度不断地加大,树脂的吸附率有下降的趋势,前面几个浓度吸附率差异不大,从第4个后的每一个点都有较大差异,鉴于节约用时的考虑,这里选择10 mg/mL的质量浓度为上柱质量浓度,该质量浓度条件下的吸附率为71.06%。
2.2.2 乙醇洗脱剂体积分数选择
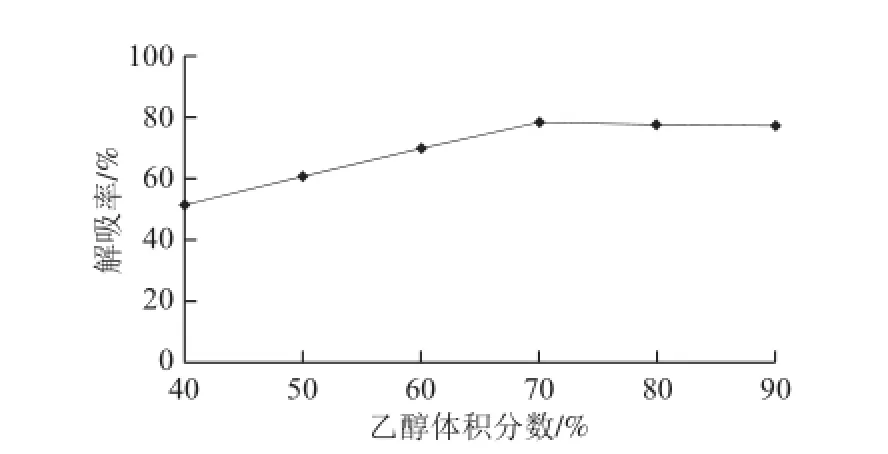
图2 乙醇洗脱剂体积分数选择Fig.2 Screening of optimal eluent concentration
由图2可知,乙醇洗脱剂体积分数变化对D101树脂吸附石榴皮多酚的影响较大,随乙醇体积分数加大,解吸率也有上升的趋势,当乙醇体积分数达到70%以后,解吸率趋于平稳,因此从经济的角度考虑选择体积分数为70%的乙醇比较适宜。
2.3 大孔树脂对石榴皮多酚的动态吸附与解吸实验结果
2.3.1 大孔树脂对石榴皮多酚动态吸附性能

图3 大孔树脂对石榴皮多酚的动态吸附Fig.3 Dynamic adsorption of polyphenols on macroporous resin D101
由图3可知,随进柱量的增大,流出液的多酚质量浓度也在增大,这表明进柱量越大,树脂的吸附效果越差,这是由于树脂的吸附接近平衡的缘故。在此条件下,进柱量大于4 BV时,流出液中多酚质量浓度停止增大,这证明树脂的吸附已经达到平衡。
2.3.2 树脂清洗用水量选择
石榴皮提取物中有一定的多糖存在,可以采取大孔树脂对它和石榴皮多酚的吸附差异来将两者分开,将石榴皮提取物溶液按一定的条件进柱后,等树脂充分吸附,用水清洗树脂,将多余的多糖除去,多糖反应与多酚丢失率见表2。

表2 多糖反应实验Table 2 Effect of water washing of the loaded column on polyphenol loss and polysaccharide removal
由表2可知,当洗脱水用量大于5 BV时,多糖呈阴性反应,这表明除去了大量的杂质,但随洗脱水量的加大,其中多酚的丢失率也不断在增大,所以综合考虑,最终决定选择用5 BV的清洗用水量。
2.3.3 乙醇洗脱剂用量确定

图4 乙醇洗脱剂用量的选择Fig.4 Screening of optimal eluent amount
由图4可知,当乙醇洗脱剂的用量为5.5 BV时,石榴皮多酚的解吸程度基本达到极限,此时乙醇解吸液中多酚质量浓度为0.5 mg/mL,大部分的多酚已经在洗脱剂用量为5 BV时解脱下来,考虑到效率和经济的因素,这里选择乙醇洗脱剂用量为5.5 BV。
2.4 石榴皮多酚质量分数测定结果
2.4.1 粗提物多酚质量分数的测定
将石榴皮多酚粗提取物配制成质量浓度为0.1 mg/mL的溶液,空白管为蒸馏水,在283 nm波长处测定其吸光度,代入回归方程,计算得到粗提物中多酚质量分数为为49.31%。
2.4.2 纯化物中多酚含量的测定
取经过D101型大孔树脂纯化处理后的石榴皮多酚冻干粉溶解稀释,将其配制成质量浓度为0.1 mg/mL的溶液,空白管为蒸馏水,将其在283 nm波长处测定吸光度,带入多酚回归方程,计算其结果。经测定,大孔树脂纯化后的石榴皮多酚质量分数可达(71.64±0.56)%(n=5,相对标准偏差=0.78%),较以前未纯化时49.31%的石榴皮多酚质量分数增加了22.33%,这说明此方法有一定的纯化效果,可以用于石榴皮多酚的纯化分离。
2.5 RP-HPLC法对石榴皮多酚质量分数测定结果

表3 未纯化与纯化后石榴皮提取物中不同多酚物质质量分数Table 3 Polyphenol composition of crude and purified extract from pomegranate peel
由表3可知,纯化后不同多酚物质质量分数较未纯化前均有所提高。
2.6 石榴皮多酚对脂肪酸合成酶的抑制作用

图5 不同石榴皮多酚质量浓度条件下FAS的活性Fig.5 Fatty acid synthase inhibitory activity of pomegranate peel polyphenols at different concentrations
由图5可知,纯化的石榴皮多酚提取物对酶活性的抑制率随石榴皮多酚质量浓度增加而增大,其半最大效应浓度(concentration for 50% of maximal effect,EC50)为0.72 mg/mL。
3 结 论
3.1 通过对D101、DI40、AB-8、D160、HPD722这5 种树脂的研究,得出了它们吸附性能的差异。在5 种树脂中,D101树脂有较强的吸附解吸效果,所以这里用D101树脂来分离纯化石榴皮多酚比较有效。
3.2 实验通过大孔树脂的动态和静态吸附与解吸研究,得到了石榴皮多酚纯化的最佳条件:采用D101大孔树脂,速率为2 BV/h,进柱质量浓度为10 mg/mL,清洗用水量为5 BV,乙醇洗脱剂体积分数为70%,使用量为5.5 BV。
3.3 对石榴皮提取物纯化品中多酚物质进行了RP-HPLC法测量,测得不同多酚物质质量分数分别为:鞣花酸9.44%、绿原酸0.53%、槲皮素0.75%、表儿茶素0.32%、安石榴苷46.91%;石榴皮提取液冻干粉中不同多酚物质质量分数分别为鞣花酸6.23%、槲皮素0.61%、绿原酸0.41%、表儿茶素0.30%、安石榴苷28.73%。表明石榴皮多酚物质质量分数比未纯化前有所提高。
3.4 石榴皮提取物对FAS酶活有抑制作用,随其质量浓度的增加,抑制效果越明显,其EC50为0.72 mg/mL。
[1] 国家药典委员会. 中华人民共和国药典(第一部)[M]. 北京: 化学工业出版社, 2005: 63.
[2] 杨丽平, 杨永红. 石榴皮的研究进展[J]. 云南中医中药杂志, 2004, 25(3): 45-47.
[3] 乔树华. 石榴皮抑菌活性的初步研究[D]. 北京: 中国农业科学院, 2009: 24-25.
[4] 何宇. 石榴皮提取物抑菌活性研究进展[J]. 安徽农业科学, 2012, 40(35): 17306-17307.
[5] 李海霞, 王钊, 刘延泽. 石榴科植物化学成分及药理活性研究进展[J].中草药, 2002, 33(8): 765-766.
[6] 宋薇薇, 焦士蓉, 周佳, 等. 石榴皮多酚的微波辅助提取及提取物抗氧化与抑菌作用研究[J]. 现代食品科技, 2008, 24(1): 23-27.
[7] 朱静, 陆晶晶, 袁其朋. 大孔吸附树脂对石榴皮多酚的分离纯化[J].食品科技, 2010, 35(1): 188-193.
[8] 张茜, 贾冬英, 姚开, 等. 大孔吸附树脂纯化石榴皮多酚[J]. 精细化工, 2007, 24(4): 345-349.
[9] KANATT S R, CHANDER R, SHARMA A. Antioxidant and antimicrobial activity of pomegranate peel extract improves the shelf life of chicken products[J]. International Journal of Food Science & Technology, 2010, 45(2): 216-222.
[10] PAN Zhongli, QU Wenjuan, MA Haile, et al. Continuous and pulsed ultrasound-assisted extractions of antioxidants from pomegranate peel[J]. Ultrasonics Sonochemistry, 2012, 19(2): 365-372.
[11] BACHOUAL R, TALMOUDI W, BOUSSETTA T, et al. An aqueous pomegranate peel extract inhibits neutrophil myeloperoxidase in vitro and attenuates lung inflammation in mice[J]. Food and Chemical Toxicology, 2011, 49(6): 1224-1228.
[12] MALI A B, KHEDKAR K, LRLE S S. Effect of gamma irradiation on total phenolic content and in vitro antioxidant activity of pomegranate (Punica granatum L.) peels[J]. Food and Nutrition Sciences, 2011, 2(5): 428-433.
[13] TABARAKI R, HEIDARIZADI E, BENVIDI A. Optimization of ultrasonic-assisted extraction of pomegranate (Punica granatum L.) peel antioxidants by response surface methodology[J]. Separation and Purification Technology, 2012, 98: 16-23.
[14] MASTRODI SALGADO J, BARONI FERREIRA T R, de OLIVEIRA BIAZOTTO F, et al. Increased antioxidant content in juice enriched with dried extract of pomegranate (Punica granatum) peel[J]. Plant Foods for Human Nutrition, 2012, 67(1): 39-43.
[15] 吴佳, 解成喜. 石榴皮总黄酮的提取工艺及抑制亚硝化反应[J]. 食品科学, 2011, 32(2): 111-114.
[16] MONSANTO M, ZONDERVAN E, TRIFUNOVIC O, et al. Integrated optimization of the adsorption of theaflavins from black tea on macroporous resins[J]. Computer Aided Chemical Engineering, 2012, 31: 725-729.
[17] MA Chunhui, LIU Tingting, YANG Lei, et al. Preparation of high purity biphenyl cyclooctene lignans from Schisandra extract by ion exchange resin catalytic transformation combined with macroporous resin separation[J]. Journal of Chromatography B, 2011, 879(30): 3444-3451.
[18] ZHAO Xuebing, FAN Ming, ZENG Jing, et al. Kinetics of lipase recovery from the aqueous phase of biodiesel production by macroporous resin adsorption and reuse of the adsorbed lipase for biodiesel preparation[J]. Enzyme and Microbial Technology, 2013, 52(4/5): 226-233.
[19] OU Shiyi, LUO Yanlin, XUE Feng, et al. Seperation and purification of ferulic acid in alkaline-hydrolysate from sugarcane bagasse by activated charcoal adsorption/anion macroporous resin exchange chromatography[J]. Journal of Food Engineering, 2007, 78(4): 1298-1304.
[20] 许英爱, 范国荣, 高申. 大孔吸附树脂分离纯化山楂叶总黄酮的研究[J]. 中药材, 2007, 30(2): 228-230.
[21] 余庆光, 吴文亦. 葡萄籽提取物中脂肪酸合成酶抑制剂的化学成分和活性测定[J]. 生命科学仪器, 2008(6): 20-27.
[22] 赵光, 李珺, 元华龙, 等. 天然产物中脂肪酸合酶抑制剂的筛选[J].中国民族民间医药, 2009(20): 2-3.
[23] 赵励彦, 王莉莉, 刘洪英, 等. 脂肪酸合成酶的纯化[J]. 军事医学科学院院刊, 2006, 30(6): 548-550.
[24] 焦士蓉, 王玲, 陈明夏. 石榴皮总多酚的超声波辅助提取及其抗氧化活性研究[J]. 西华大学学报: 自然科学版, 2009, 28(1): 60-62.
[25] WU Dan, MA Xiaofeng, TIAN Weixi. Pomegranate husk extract, punicalagin and ellagic acid inhibit fatty acid synthase and adipogenesis of 3T3-L1 adipocyte[J]. Journal of Functional Foods, 2013, 5(2): 633-641.
Purification of Polyphenols from Pomegranate Peel and Their Inhibitory Effect on Fatty Acid Synthase
PU Bo1, LI Bing1, YANG Shu-hui2, TANG Peng-cheng1, JIAO Shi-rong1,*
(1. School of Bioengineering, Xihua University, Chengdu 610039, China; 2. Yunnan Golden Rain’s Biotechnology Limited Liability Company, Kunming 650000, China)
The purification of polyphenols from the crude aqueous extract of pomegranate peel by macroporous adsorption resin was investigated by evaluating total polyphenol content, adsorption rate and desorption rate as functions of the adsorption and desorption conditions. Meanwhile, the contents of punicalagin, ellagic acid, chlorogenic acid, quercetin and epicatechin were determined by reverse phase high performance liquid chromatography (RP-HPLC). In addition, the inhibitory effect of purified polyphenols on fatty acid synthase was explored. The results showed that D101 macroporous resin was the suitable resin for the purification of polyphenols and the purification process involved the following steps: adjustment of the sample concentration to 10 mg/mL, sample loading at a flow rate of 2 BV/h, column washing with 5 BV of distilled water, and elution with 5.5 BV of 70% ethanol. The purified product contained 71.64%, significantly higher than that (49.31%) reported for the crude extract. The contents of punicalagin, ellagic acid, chlorogenic acid, quercetin and epicatechin in the purified polyphenols were 46.91%, 9.44%, 0.53%, 0.75% and 0.32%, respectively. Moreover, the polyphenols from pomegranate peel had a potent inhibitory effect on fatty acid synthase with an EC50(concentration for 50% of maximal effect) of 0.72 mg/mL.
pomegranate peel polyphenols; fatty acid synthase; purification; inhibition
Q949.761
A
1002-6630(2014)17-0099-05
10.7506/spkx1002-6630-201417020
2013-10-10
教育部春晖计划项目(12205543);四川省教育厅自然科学重点项目(09ZA158);西华大学人才引进基金项目(R0820501)
蒲博(1989—),男,硕士研究生,研究方向为食品科学。E-mail:375243027@qq.com
*通信作者:焦士蓉(1968—),女,教授,博士,研究方向为食品科学。E-mail:jsrong2004@163.com
