清洁型复合饲料添加剂对发酵床育肥前期猪生长、营养代谢及激素分泌的影响
2014-01-20闫俊书宦海琳周维仁徐小明冯国兴顾洪如
闫俊书,宦海琳,周维仁,杨 杰,徐小明,冯国兴,顾洪如
(江苏省农科院畜牧研究所,江苏南京210014)
目前,随着规模化猪场快速发展和粪污处理相对落后矛盾的逐渐凸显,畜粪对环境的污染日益严重。2006年,我国规模化养殖场(小区、专业户)的畜禽粪便产生量达2.43×108t,尿液产生量达1.63×108t,成为农业主要的污染源之一[1]。畜禽粪便的处理成为当前畜牧业发展中迫切需要解决的一个重大问题。发酵床养猪是一种基于环境保护理念的绿色养殖技术,其利用微生物与垫料构建生猪生长的发酵床基质,通过床体中功能菌的新陈代谢分解生猪排泄的粪尿,从而实现对周围环境零排放的一种生态养殖方法[2],实现了无污染、低排放的目的,缓解了养猪业对环境造成的压力。但由于饲料中抗生素大量使用带来了一系列问题,如导致猪体内菌群失调、抑制床体微生物的发酵、产生抗药性及药物残留等,使发酵床养殖模式的应用受到限制。饲料中添加的抗生素随排泄物进入到垫料中,对垫料中的微生物尤其是益生微生物造成了极大的损害[3],降低了垫料的使用效率[4]。因此,如何从源头上控制抗生素的使用,减少粪便中残留抗生素对发酵床微生物的影响成为关键性问题。本试验将无抗生素的清洁型复合饲料添加剂应用于发酵床养殖模式中,研究其对发酵床育肥前期猪生长性能、血液生化指标及激素水平的影响,旨在解决发酵床养殖中的抗生素污染问题,并为其在发酵床养猪中的广泛应用提供依据。
1 材料与方法
1.1 试验材料
本试验用清洁型复合饲料添加剂由植酸酶、复合酶、微生态制剂(芽孢杆菌、乳酸菌、酵母菌)组成,其中植酸酶和复合酶由广东溢多利生物科技股份有限公司生产,微生态制剂由安琪酵母股份有限公司生产。各组试验猪日粮参照NRC(1998)猪营养需要配制,基础日粮配方及营养水平见表1,对照组饲喂基础日粮,试验组用酶制剂及微生态制剂等量玉米构成试验饲粮,其中植酸酶添加量100g/t,复合酶添加量100g/t,微生态制剂中枯草芽孢杆菌500 g/t,酵母菌500g/t,乳酸菌3kg/t。
1.2 发酵床的制作
本试验圈舍发酵床采用地上床面设计,发酵床面厚度为60cm。发酵床垫料采用锯末、稻壳及稻草秸秆等作为主要成分,制作时将垫料准备好后接种菌种,调节水分和拌匀后,铺至发酵床发酵。发酵床的日常维护主要包括垫料的浅层翻扒,将粪便集中的区域人工分散,当垫料出现明显下降时补充同样比例的垫料。自然发酵7~10d即可用于猪生长期饲养试验。饲养过程中,除随时翻转部分板结区域外,每半个月翻转一次垫料床,定期补加垫料和菌种。
1.3 试验动物及分组
试验选取健康无病体重30kg 左右的苏钟猪120头,随机分为2组,分别为对照组(基础日粮)和试验组(清洁型日粮),每个处理组4个重复,每个重复15头。试验于江苏省农业科学院六合动物科学基地猪场进行,预饲7d,预试期间,初步掌握每头猪的采食规律,测定每头猪日采食量。每日早8∶00时加料,全期自由采食及饮水,按猪场常规程序进行免疫、驱虫、消毒和管理等。试验结束猪只全群称重,统计日采食量、日增重及饲料报酬。
1.4 测定指标与方法
1.4.1 生长性能 试验开始和试验结束时分别对试验猪进行空腹称重,每天观察猪群生长情况,记录饲料消耗情况,计算生长猪平均日增重、平均日采食量、料重比。
1.4.2 血液生化指标的测定 猪只称重同时进行前腔静脉采血约5mL,3 000r/min离心10min,分离血清,-20 ℃保存备用。采用试剂盒分析测定血清中总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、葡萄糖(GLU)、尿素氮(UN)、总胆固醇(TCHO)、高密度胆固醇、低密度胆固醇、甘油三酯(TG)含量、谷丙转氨酶(ALT)和谷草转氨酶(AST)活性,试剂盒购自南京建成生物科技有限公司。
1.4.3 内分泌指标的测定 血清中生长激素(GH)、胰岛素样生长因子(IGF-Ⅰ)、胰岛素(INS)、甲状腺素(T3、T4)的含量采用Elisa试剂盒测定。
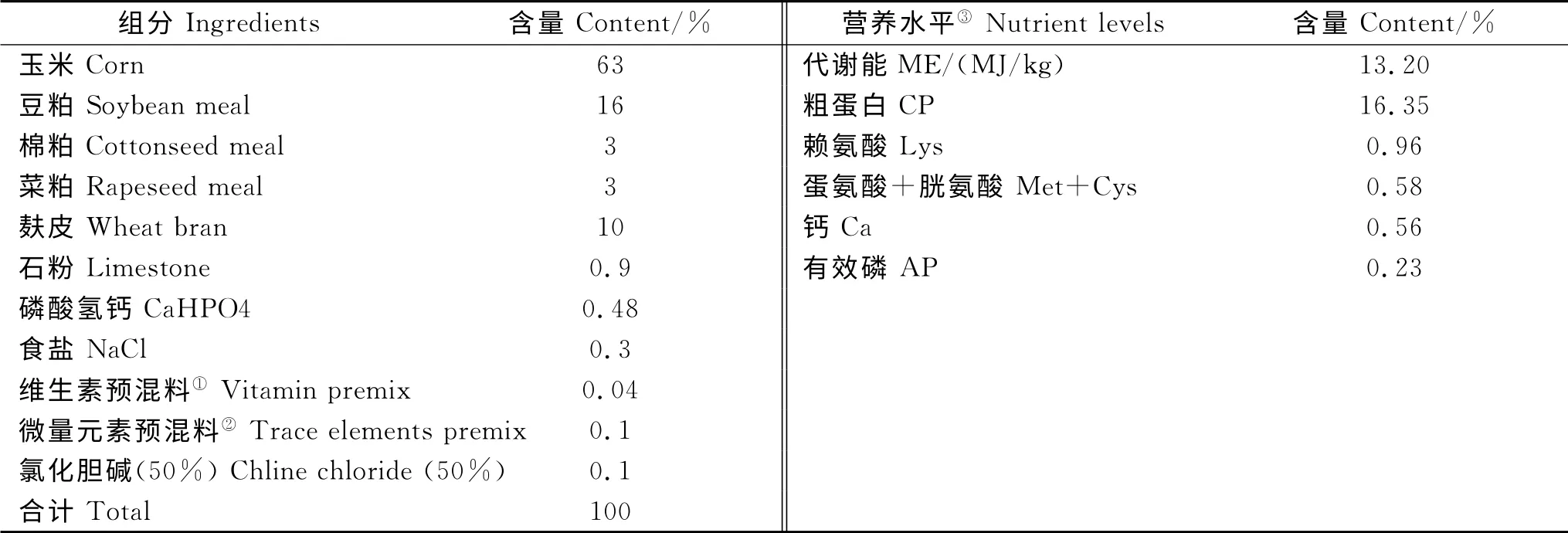
表1 饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of diets(air-dry basis)
1.5 数据统计
试验数据采用Excel 2007 进行初步整理,用SAS 9.2软件进行统计分析,采用单因子方差(Oneway ANOVA)分析进行差异显著性检验,并用邓肯氏(Duncan'S)法进行多重比较,结果以平均值±标准误(mean±SE)表示。
2 结果与分析
2.1 清洁型复合饲料添加剂对发酵床育肥前期猪生长性能的影响
由表2可知,在发酵床育肥前期猪日粮中应用清洁型复合饲料添加剂发现,清洁饲料组体重较对照组无显著差异,但清洁饲料组平均日增重较对照组提高了4.76%(P>0.05),同时料重比较对照组降低了1.72%(P>0.05)。
2.2 清洁型复合饲料添加剂对发酵床育肥前期猪蛋白质、脂肪代谢及酶活性的影响
清洁型复合饲料添加剂对发酵床育肥前期猪血清中蛋白质、脂肪代谢及酶活性的影响见表3,清洁型复合饲料添加剂组总蛋白及白蛋白较对照组均有提高,但差异不显著(P>0.05),表明清洁型复合饲料添加剂对发酵床育肥前期猪蛋白质代谢无显著影响;清洁复合饲料添加剂组甘油三酯含量较对照组降低了58.82%(P<0.01),而对葡萄糖、胆固醇、高密度胆固醇及低密度胆固醇的影响差异不显著(P>0.05);清洁型复合饲料添加剂对血清中酶活性的变化无显著性影响,但谷丙转氨酶及谷草转氨酶都有提高的趋势(P>0.05)。
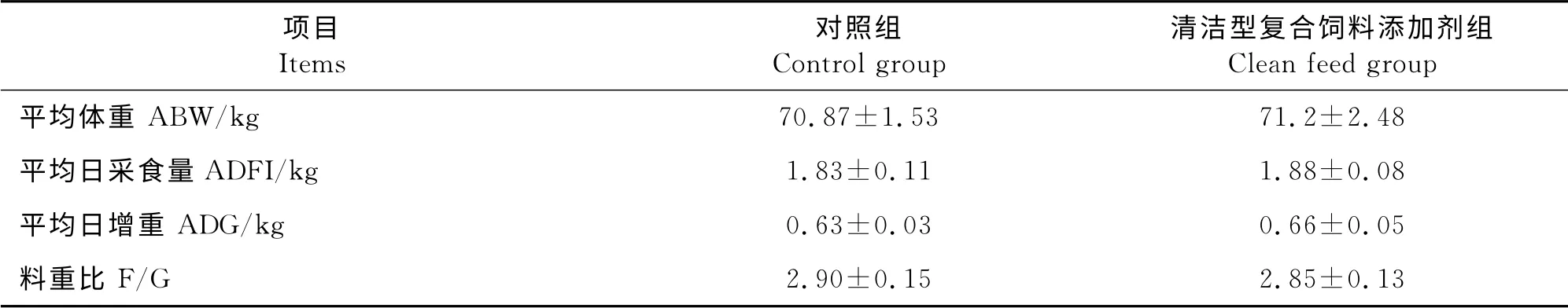
表2 清洁型复合饲料添加剂对发酵床育肥前期猪生长性能的影响Tabel 2 Effect of no antibiotic diets on growth performance of pre-fattening pigs in microbial fermentation bed system
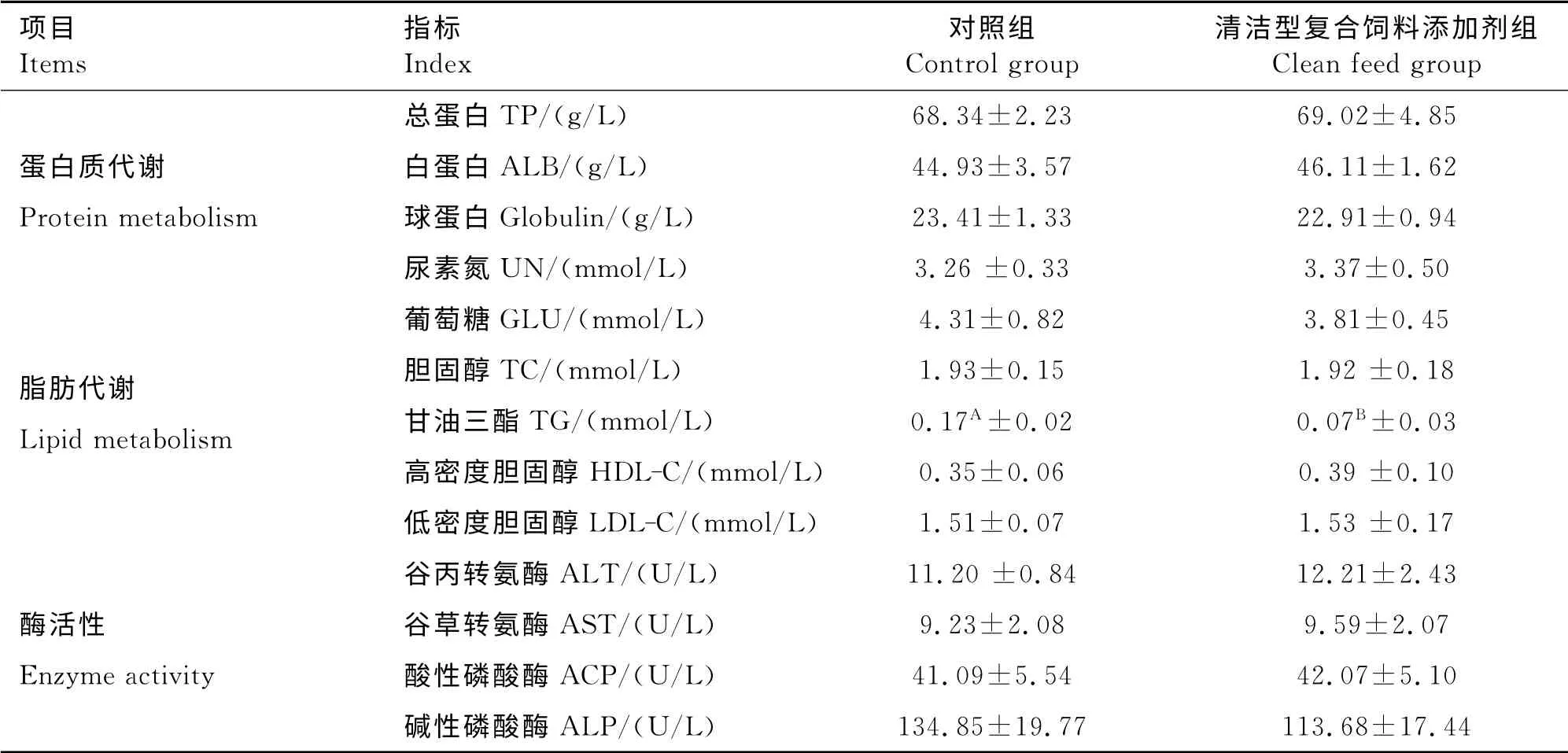
表3 清洁型复合饲料添加剂对发酵床育肥前期猪蛋白质、脂肪代谢及酶活性的影响Tabel 3 The effect of no antibiotic diets on protein and fat metabolism,enzyme activity of pre-fattening pigs in microbial fermentation bed system
2.3 清洁型复合饲料添加剂对发酵床育肥前期猪内分泌激素的影响
清洁型日粮对发酵床育肥前期猪内分泌激素的影响见表4。由表4可知,清洁日粮组血清中T3、T4含量均显著提高,其中T3 含量较对照组提高了18.12%(P<0.05),T4含量较对照组提高了18.84%(P<0.05),清洁日粮组IGF-Ⅰ、INS、GH 含量较对照组也有提高的趋势,但差异不显著(P>0.05)。
3 讨论
3.1 清洁型复合饲料添加剂对发酵床育肥前期猪生长性能的影响
近年来,饲用酶制剂及益生菌作为一种绿色、环保型饲料添加剂,在猪日粮中的应用效果已经得到肯定。饲用酶制剂能补充猪体内内源酶的不足,通过去除抗营养因子[5],提高营养物质的消化率[6],降低仔猪腹泻率[7],改善猪只肠道微生态平衡[8],从而提高饲料营养价值和猪的生产性能,提高饲料转化率,增进猪体健康,减少环境污染,提高经济效益。王向荣等[9]在28日龄断奶仔猪日粮中添加4种不同比例由半乳糖苷酶、木聚糖酶、β-葡聚糖酶、果胶酶、蛋白酶和淀粉酶组成的复合酶,结果显示,4 种复合酶均可提高仔猪的生产性能;但张民等[10]研究发现,复合酶对断奶仔猪全期日增重、料重比无显著影响;高玉红等[11]报道,复合酶可提高断奶仔猪日增重,料重比也有较大程度降低,但差异不显著。有益菌群能够促进营养成分的吸收利用和有效合成,促进猪的生长发育和增重。微生态制剂能够改善胃肠道的生态环境,产生有益物质,建立和维持肠道微生态平衡,促进猪对营养物质的消化吸收,提高饲料的转化和利用率,增强生猪的消化功能[12]。李焕友等[13]认为用微生态制剂取代肥育猪日粮中的抗生素类、抗菌药物类添加剂,能够大幅度提高试验猪的生长速度与饲料利用率,降低单位增重饲料成本;刘成江等[14]研究表明饲料中添加微生态制剂可使猪日增重提高8%~10% ,料重比降低5%~8% ,成活率达99% ,可提前10d左右出栏;Giang等[15]研究表明,复合微生态制剂(含乳酸杆菌;芽孢杆菌;酵母菌)可提高生长猪(28~52kg)的生长性能,饲料转化率和养分消化率。本试验将复合酶制剂及益生菌组成的清洁饲粮应用于发酵床育肥前期猪,结果表明,清洁饲粮对猪组体重无显著影响,但清洁饲粮组平均日增重较对照组提高了4.76%,同时料重比较对照组降低了1.72%,由此可见,在发酵床育肥前期猪应用清洁型日粮具有改善猪生长性能的趋势,可提高猪的平均日增重,降低料重比。
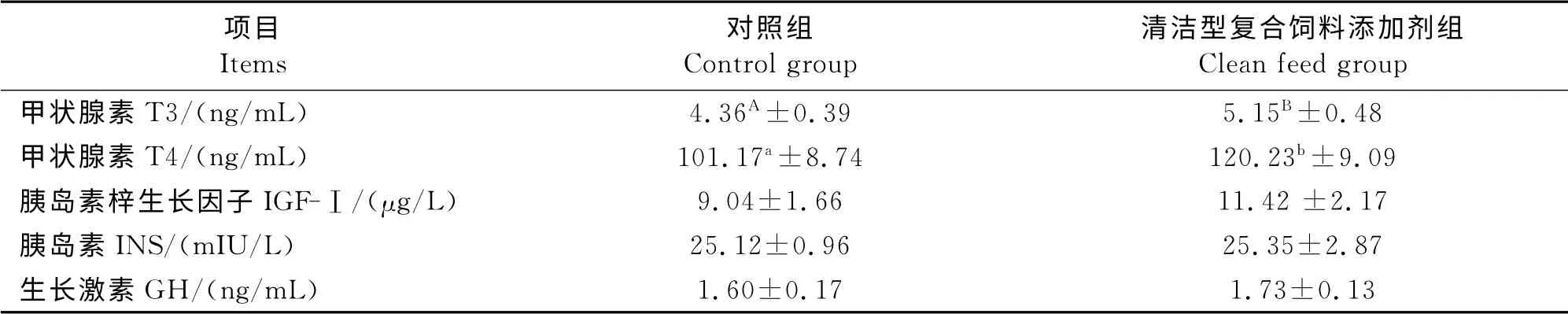
表4 清洁型复合饲料添加剂对发酵床育肥前期猪内分泌激素的影响Tabel 4 The effect of no antibiotic diets on endocrine hormones of pre-fattening pigs in microbial fermentation bed system
3.2 清洁型复合饲料添加剂对发酵床育肥前期猪血清中蛋白质、营养物质代谢及酶活性的影响
血液生化指标的改变是组织细胞通透性发生改变和机体新陈代谢机能发生改变的反映。血清蛋白指标是机体蛋白质合成代谢的一个重要标志,血清中总蛋白、白蛋白和球蛋白的含量反映了机体对蛋白质的吸收和代谢状况[16],血清中蛋白质含量的升高,有利于提高动物的代谢水平和免疫能力,促进蛋白质的合成和增加氮沉积[17]。血清中的尿素氮是蛋白质和氨基酸代谢的最终产物,其含量可以准确的反映动物体内蛋白质代谢和氨基酸之间的平衡状况。陈旭东等[18]在断奶仔猪日粮中添加芽孢杆菌能显著提高断奶仔猪血清总蛋白水平,提高幅度为10%~80%,并能显著降低尿素氮水平。Canibe等[19]研究表明,断奶仔猪饲喂乳酸菌,促使淀粉酶和蛋白合成酶活性显著增强,参与机体新陈代谢,从而促进动物生长和提高生产性能。本试验结果发现,清洁型日粮有提高血清总蛋白及白蛋白的趋势,表明清洁型日粮可能会促进机体蛋白质的合成,促进猪的生长,这与清洁型日粮可改善猪的生长性能结果一致。血清中血糖、胆固醇、甘油三酯的含量是反映机体脂肪代谢水平的几个重要指标[20],本试验研究发现,清洁日粮可显著降低发酵床育肥前期猪血清中甘油三酯的含量,表明清洁型日粮参与了机体的脂肪代谢,改善了育肥前期猪脂肪代谢水平。谷丙转氨酶和谷草转氨酶是动物体内两种重要的转氨酶,其主要作用在于催化氨基酸的α-氨基转移至α-酮酸的酮基位置,反映了蛋白质合成和分解代谢的状况[21-22],在非必需氨基酸的合成与蛋白质分解代谢中起重要的催化作用,其浓度的提高意味着体内氨基酸代谢的加强。本试验结果发现,清洁日粮组谷丙转氨酶及谷草转氨酶都有提高的趋势,表明清洁型日粮可能加快了机体内蛋白质分解代谢,从而使猪生产性能有提高的趋势。
3.3 清洁型复合饲料添加剂对发酵床育肥前期猪内分泌激素的影响
内分泌激素(生长激素、IGF-I、T3、T4 和胰岛素等)在机体代谢、生长调节上起重要作用。甲状腺激素是调节糖、脂肪、蛋白质代谢的重要激素,是维持动物生长和发育的必要激素,并与生长激素有协同作用,适量的甲状腺激素是生长激素发挥促生长作用的必需条件。
甲状腺素对脂类代谢同样产生重要影响,甲状腺激素既可刺激胆固醇的合成,又可促进外周组织利用并促进肝脏中的胆固醇进入血中加速利用[23]。本试验将清洁型日粮应用于发酵床育肥前期猪,结果发现,血清中T3、T4含量显著提高,表明在发酵床育肥前期猪日粮中添加清洁型日粮改变了猪的内分泌状态,机体的代谢水平提高,从而促进猪的生长。生长激素对动物体内的蛋白质代谢和脂肪代谢有显著调控作用。其主要通过影响机体的代谢过程和代谢活动来实现调节机体生长[24]。IGF-I在动物生长发育中起着重要调节作用,其作为下丘脑-垂体-肝脏构成的生长激素调控轴的“终端”,最能反映动物的营养和生长状况[25]。IGF-I能直接促进细胞生长,增强机体对氨基酸的摄取和利用,促进蛋白质和RNA 的合成,增强肌肉的生长,还可与其它细胞生长因子协同促进肌细胞、成骨细胞、脂肪细胞以及胶质细胞的增殖与分化,而且IGF-I水平与机体氮平衡呈很强的正相关[26],其在调节生长的过程中,容易受到机体营养水平的调控[27]。本试验结果,清洁日粮组IGF-Ⅰ、INS、GH 含量较对照组也有提高的趋势,由此可见,在发酵床育肥前期猪日粮中添加清洁型日粮改变了猪的内分泌状态,提高血清中的激素含量,表明清洁型日粮可能通过改变育肥前期猪的内分泌激素的水平而促进生长。
4 结论
在发酵床育肥前期猪日粮中应用无抗生素的清洁型复合饲料添加剂,可提高猪的生长性能,改善营养物质代谢水平,降低血清中甘油三酯的含量,并提高猪血清中T3、T4的含量,改善猪体内内分泌激素的水平,表明清洁型日粮可应用于发酵床养猪,并有效促进猪的生长。
[1]中华人民共和国环境保护部,中华人民共和国国家统计局,中华人民共和国农业部.全国第一次污染源普查公报[R/OL].[2010-02-10].http:www.gov.cn/jr2g/2010-02/10/content-1532174.htm.
[2]Morrison R S,Johnston L J,Hilbrands A M.The behaviour,wefare,growth performance and meat quality of pigs housed in a deep-litter large group housing system compared to a conventional confinement system[J].Applied Animal Behaviour Science,2007,103(1):12-24.
[3]敖梅英,陈延涛,熊顺强,等.4种市售抗生素对发酵床垫料中益生微生物生长的影响[J].中国微生态学杂,2011,23(7):623-628.
[4]何 鑫,任正平,陆冬梅,等.抗生素对苏淮猪发酵床养殖环境的影响[J].家畜生态学报,2009,30(4):44-47.
[5]Bedford M R.Matching enzymes to applieation[J].Feed Management,1993,44(5):14-18.
[6]冯定远,黄燕华,于旭华.饲料酶制剂理论与实践的新思路-新型高效饲料组合酶的原理和应用[J].中国饲料,2008(13):24-28.
[7]Van Beers-Schreurs H M G,Vellenga L,Wensing T,et a1.The pathogenesis of the post-weaning syndrome in weaned piglets,a review[J].VetQuartedy,1992,14:29-34.
[8]Bedford M R,Schulze H.Exogenous enzymes in pigs and poultry[J].Nutrition Research Reviews,1998,11:91-114.
[9]王向荣,蒋桂韬,张 旭,等.四种复合酶制剂对断奶仔猪生长性能及养分消化率的影响[J].家畜生态学报,2010,31(5):35-40.
[10]张 民,吕秋风,周莉芬,等.不同类型的复合酶制剂对仔猪生长性能和饲料养分利用率的影响[J].饲料工业,2010,31(4):12-15.
[11]高玉红,臧素敏,刘艳琴,等.复合酶对断奶仔猪生产性能和消化吸收能力的影响研究[J].饲料研究,2000(3):8-10.
[12]周庆民,安丽哪,李桂伟,等.微生态制剂在养猪业中的应用及研究现状[J].中国猪业,2010(9):38-39.
[13]李焕友,甄辑铭,田 萍,等.肥育猪饲料中微生态制剂应用效果研究[J].黑龙江畜牧兽医,2001(4):15-16.
[14]刘成江,殷友贵,郭 鹃.微生态保健渚新技术应用效果显著[J].当代畜禽养殖业,2012(5):43-47.
[15]Giang H H,Viet T Q,Ogle B,et al.Effects of supplementation of probiotics on the performance,nutrient digestibility and faecal microflora in growing-finishing pigs[J].Asian-Australasian Journal of Animal Sciences,2011,24(5):655-661.
[16]Coma J,Carrion D,Zimmeman D R.Use of plasma urea nitro-gen as a rapid response criterion to determine the lysine requirement of pigs[J].Journal of Animal Science,1995,73:472-481.
[17]Kanjanapruthipong J.Supplementation of milk replacers containing soy protein with threoninc,methionine,and lysine in the diets of calves[J].Joumal of Dairy Science,1998,81(11):2 912-2 915.
[18]陈旭东,胥传来,马秋刚,等.金霉素、果寡糖和芽孢杆菌对断奶仔猪生产性能和血清指标的影响[J].中国畜牧杂志,2005,4l(6):25-27.
[19]Canibe N,Mietfinen H,Jensen B B.Effect of adding Lactobacillus plantarum or a formic acid containing-product to fermented liquid feed on gastrointestinal ecology and growth performance of piglets[J].Livestock Science,2007,5(2):251-262.
[20]Tsimogiannis D I,Oreopoulou V.Free radical scavenging and antioxidant activity of 5,7,3V,4V-hydroxy-substituted flavonoids[J].Innovative Food Science and Emerging Technologics,2004,5:523-528.
[21]王建辉,贺建华,易 宣,等.杜仲提取物对猪生长性能及血液指标的影响[J].饲料研究,2007(2):1-4.
[22]孙占田,李忠荣,马秋刚,等.饲料肽对断奶仔猪生长及血液生化指标的影响[J].中国畜牧杂志,2007,43(9):31-32.
[23]Rosebrough B A,Russell S M,Poch M P.Richards Methimazole,thyroid hormone replacement,and lipogenic enzyme gene expression in broilers[J].Comparative Biochemistry and Physiology,2004,139:189-194.
[24]Kuhn E R,Geelissen S M E.The release of growth hormone(GH):Relation to the thyrotropic-and corticotropic axis in the chicken[J].Domestic Animal Endocrinology,2005,29:43-51.
[25]Holly J M P,Hughes S C.Measuring insulin-like growth factors:why,where and how[J].Journal of Endocrinology,1994,140:165-169.
[26]Inaba T,Saito H,Fukushima R,et a1.Effects of growth hormone and insulin-like growth factor I(IGF-I)treatments on the nitrogen metabolism and hepatic IGF-I messenger RNA expression in postoperative parenterally fed rats[J].Journal of Parenteral and Enteral Nutrition,1996,20:325-331.
[27]Anthony Guernec,Bernadette Chevalier,Michel J Duclos.Nutrient supply enhances both IGF-I and MSTN mRNA levels in chicken skeletal muscle[J].Domestic Animal Endocrinology,2004,26:143-154.
