日粮氧化魔芋葡甘露聚糖对齐口裂腹鱼生长、血脂和脂肪代谢酶活性的影响
2014-01-20邬应龙夏晓杰
周 成,邬应龙,夏晓杰,唐 淼,廖 杰
日粮氧化魔芋葡甘露聚糖对齐口裂腹鱼生长、血脂和脂肪代谢酶活性的影响
周 成,邬应龙*,夏晓杰,唐 淼,廖 杰
(四川农业大学食品学院,四川 雅安 625014)
目的:研究日粮氧化魔芋葡甘露聚糖(oxidized konjac glucomannan,OKGM)对齐口裂腹鱼生长、血脂以及脂肪代谢酶活性的影响。方法:选用初始体质量为(79.54±8.12)g的齐口裂腹鱼300 尾,随机分成5 组,每组3 个重复,每重复20 尾鱼,分别饲喂OKGM添加量为0(对照组D1)、4、8、16、32 g/kg,养殖60 d后,考察OKGM对齐口裂腹鱼生长性能、血脂水平及脂肪代谢酶活性的影响。结果:与对照组D1相比,日粮添加8~16 g/kg OKGM可显著提高鱼体增重率(P<0.05)、特定生长率(P<0.05),添加16 g/kg OKGM能够显著提高蛋白质效率(P<0.05),降低饵料系数(P<0.05),会显著降低肌肉水分含量(P<0.05),添加8 g/kg OKGM可显著降低肌肉和肝胰脏脂肪含量(P<0.05),添加4~16 g/kg OKGM能够显著提高鱼体肠脂比(P<0.05);在血脂方面,日粮中OKGM添加量对齐口裂腹鱼总胆固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白没有明显的剂量效应,添加4~8 g/kg OKGM能够显著降低血清中游离脂肪酸含量(P<0.05);在脂肪代谢酶方面,添加16 g/kg OKGM显著提高脂蛋白酯酶、肝脂酶和总脂酶活性(P<0.05),在肠道消化酶方面,添加8~32 g/kg OKGM能显著提高齐口裂腹鱼肠道脂肪酶活性(P<0.05)。结论:日粮中添加适量OKGM能改善齐口裂腹鱼生长性能,提高饲料利用率,降低肌肉脂肪含量,提高脂肪代谢酶和脂肪酶活性。建议齐口裂腹鱼饲料中OKGM添加量为4~16 g/kg。
氧化魔芋葡甘露聚糖;齐口裂腹鱼;生长;血脂;脂肪代谢酶
氧化魔芋葡甘露聚糖是魔芋葡甘聚糖(konjac glucomannan,KGM)经适当的氧化剂氧化后制得的,具有产品安全性高、污染少、高效率、低成本,适应工业化生产的特点,保留了KGM的生理功能,同时克服了KGM稳定性差等缺点,开拓了KGM的应用领域。KGM是一种来自植物魔芋的、由D-葡萄糖(G)和D-甘露糖(M)按1∶1.6或1∶1.69的物质的量比通过β-1, 4-吡喃糖苷键结合而成的复合多糖[1-2],KGM及其改性物质作为一种膳食纤维和功能性糖(益生元)在体内不会被消化吸收且不含热量,其功能性主要包括以下几个方面:促进动物的生长发育、提高饵料的利用率、增强动物的体液和细胞免疫功能、降低死亡率和调节肠道微生态环境等功能[3-4];同时还能有效的减少有害微生物的数量和肠道内有毒发酵产物,保护肝脏、清除有害物质,降低血清胆固醇、提高抗病力等作用[5]。KGM、甘露寡糖(mannose-oligosaccharides,MOS)在畜禽生物饲料中已有较多研究[6-7],但OKGM的研究多集中于在成膜性和流变性及胶凝性和稳定性的探讨[8-11],对氧化改性后产物的生理活性、免疫功能[12]以及对鱼类的生长性能、血脂水平和脂肪代谢相关酶等研究上还鲜见报道。
齐口裂腹鱼属鲤形目,鲤科,裂腹鱼亚科,裂腹鱼属,裂腹鱼亚属。俗称雅鱼, 齐口,细甲鱼,齐口细鳞鱼。主要分布于长江上游、金沙江、岷江、大渡河、酉水、青衣江和汉江的上游[13],是川西高原特有的冷水性鱼类之一,它是继虹鳟、黑龙江鲟科鱼类、青海湖裸鲤等冷水鱼之后又一条具有开发潜力的冷水鱼[14]。其肉质细嫩、味道鲜美,具有较高的营养价值和经济价值,是产区名贵的野生经济鱼类[15-16]。国内外研究人员对齐口裂腹鱼的研究主要表现在生物学特性、肌肉营养学、生理生化、种群遗传多态性和人工养殖等方面[17],目前,齐口裂腹鱼的人工繁殖技术已经基本成熟[14],并逐步开始了集约化养殖。
研究发现鱼类脂肪的大量沉积不仅会降低饲料转化率,造成不必要的浪费,而且严重的还可引发营养性脂肪肝,因此,研究鱼类脂肪代谢及脂肪代谢相关酶,对提高养殖效率,改善养殖鱼类的肉质和口味有重要的意义。本实验将以经H2O2氧化降解改性后的OKGM为实验材料,以齐口裂腹鱼为研究对象,通过喂养60 d,初步探讨OKGM对齐口裂腹鱼生长性能、血脂水平和脂肪代谢酶活性的影响,目的是进一步了解OKGM的生理活性,以期为进一步开发OKGM的应用价值,大规模养殖齐口裂腹鱼提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
齐口裂腹鱼,四川省雅安天泉雅鱼场购得,为2011年孵化的同一批鱼种,体质量(79.54±8.12)g/尾。选择体质健壮的实验鱼300 尾,暂养驯食14 d后开始实验;鱼粉、豆粕、玉米、麸皮、鱼用多维、矿物添加剂、磷酸二氢钙,四川农业大学动物营养研究所提供;菜油、面粉 雅安市农贸市场;OKGM四川农业大学食品学院功能性食品实验室自制,将KGM经H2O2氧化降解而得到[11]。
血清总胆固醇(total cholesterol,TC)试剂盒、甘油三酯(triglyceride,TG)试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)试剂盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)试剂盒、游离脂肪酸(free fat acid,FFA)试剂盒、总脂酶(total lipase,TL)试剂盒、考马斯亮蓝蛋白测定试剂盒 南京建成生物工程研究所;其他试剂均为国产分析纯。
1.2 仪器与设备
ST16R型冷冻离心机 美国Thermo公司;HHS-9S型恒温水浴锅 上海光地仪器设备有限公司;BWFJ7200型分光光度计 上海尤尼柯仪器有限公司;T124S型电子天平 北京赛多利斯仪器系统有限公司。
1.3 方法
1.3.1 动物分组
暂养14 d后,选择健康无伤病的齐口裂腹鱼随机分组,设1 个对照组(D1组),4 个OKGM处理组(D2、D3、D4、D5 组),每个处理组设3个平行组。每个处理组投放20 尾鱼,每个重复组投入1 个鱼缸(规格为0.70 m×0.50 m×0.50 m),共15 个鱼缸,按实验设计分别编号。每天以体质量2.5 g/100 g的量投喂饲料,定时、定质、定量投喂饲料,实验期间水温为 18~22 ℃,pH值为7.4~7.6。实验期间保持微流水,各试验池水体每天的交换量为30%。实验结束时禁食24 h,进行各种指标的测定。
1.3.2 实验饲料
以鱼粉、豆粕为蛋白源,以食用菜油为脂肪源,参照美国国家科学研究委员会(National Research Council,NRC,1994)鱼类营养需要和段彪等[18-19]的齐口裂腹鱼饲料配方设计,基础饲料配方及营养水平见表1,饲料原料均过40 目筛,按饲料配方表制得基础饲料;在基础饲料中分别添加0、4、8、16、32 g/kg OKGM,分别记为D1(对照组)、D2、D3、D4、D5组,添加相对应的面粉质量平衡OKGM添加的质量,使其总量相平衡,配成5 种等氮等能(蛋白质含量)饲料,实验饲料充分混合后加工成1 mm的硬颗粒饲料,干燥并密封保存于4 ℃条件下备用。

表1 基础饲料配方及营养组成Table 1 Formulation and nutrient composition of basal diet
注:1.每kg饲料含:VA 6 000 IU;VD 1 000 IU;VE 30 mg;VK30.46 mg;VB10.72 mg;VB25.76 mg;VB64.212 mg;尼克酸27.72 mg;泛酸27 mg;生物素0.16 mg;VC 55.8 mg;肌醇58.8 mg;氯化胆碱700 mg。2.每kg饲料含:Mn 10 mg,Zn 30 mg,Fe 60 mg,Cu 3 mg,I 1 mg,Se 0.2 mg。
1.3.3 鱼体生长指标测定
养殖实验结束后,鱼体饥饿24 h,以缸为单位称其质量,测量所有齐口裂腹鱼的体长、体高,称体质量,解剖后称量肝胰脏质量和肠系膜脂肪质量,各指标计算方法如下。

式中:m0实验开始时鱼体质量/g;mt实验结束时鱼体质量/g;F为饲料摄入量/g;P为饲料粗蛋白质含量/(g/100 g);t为养殖实验时间/d。
1.3.4 样品的采集和制备
养殖实验结束后,鱼体饥饿24 h,每池随机取鱼8 尾,从尾静脉取血,在室温下放置1 h,并置于冰箱(4 ℃)中过夜,3 500 r/min离心15 min制得血清,置于-20 ℃冰箱中备用;再迅速取出肝胰脏、前肠、肌肉(第1 根背鳍至最后1 根背鳍之间,侧线以上白肌),置于-20 ℃冰箱中保存。
每尾实验鱼取0.2 g前肠,加入9 倍体积4 ℃双蒸水,冰浴匀浆,3 000 r/min离心10 min,取上清液测定前肠脂肪酶活性;取0.2 g肝胰脏加入9 倍体积4 ℃生理盐水,用同上方法制备粗酶液,按照试剂盒说明书测定肝胰脏中脂蛋白脂酶、肝脂酶活性和其组织蛋白浓度。
1.3.5 鱼体组成的测定
鱼体粗蛋白质按照GB/T 5009.5—2003《食品中蛋白质的测定》凯氏定氮法测定;粗脂肪按照GB/T 5009.6—2003《食品中脂肪的测定》索氏抽提法测定;水分按照GB/T 5009.3—2003《食品中水分的测定》干燥法测定;粗灰分按照GB/T 5009.4—2003《食品中灰分的测定》马福炉灼烧法测定。
1.3.6 血脂含量和脂肪代谢酶活力的测定
血清TC、TG、HDL-C、LDL-C、FFA、前肠脂肪酶、肝脏脂蛋白脂酶(lipoprotein lipase,LPL)和肝脂酶(hepatic lipase,HL)活性均采用试剂盒测定。血清中的TC、TG测定分别采用胆固醇氧化酶-过氧化物酶-4-氨基安替比林和酚法(CHOD-PAP法)和甘油磷酸氧化酶-过氧化物酶-4-氨基安替比林和酚法(GPO-PAP法),LDL-C用聚乙烯硫酸沉淀法测定,记录546nm波长处的A值,与标准品相比计算LDL-C的含量;HDL-C含量用磷钨酸镁沉淀法测定,记录546 nm波长处的A值,与标准品相比计算LDL-C的含量,单位均用mmol/L表示;游离脂肪酸(free fatty acid,FFA)含量采用铜试剂法测定,记录440 nm波长处的A值,与标准品相比计算FFA的含量,单位用mmol/L表示;脂肪酶活性定义为在37 ℃条件下,每克组织蛋白在本反应体系中与底物反应1 min,每消耗1 μmol底物为一个活力单位;总脂酶活性定义:每毫克组织蛋白每小时在反应系统中所产生的1 μmol FFA为1 个酶活性单位,单位为U/mg;TL活性为LPL活力与 HL活力之和。
1.4 数据统计
结果用x±s表示,采用SPSS 19.0对数据进行单因素方差分析,Duncan’s多重比较,差异显著水平为P<0.05。
2 结果与分析
2.1 日粮OKGM对齐口裂腹鱼生长性能的影响
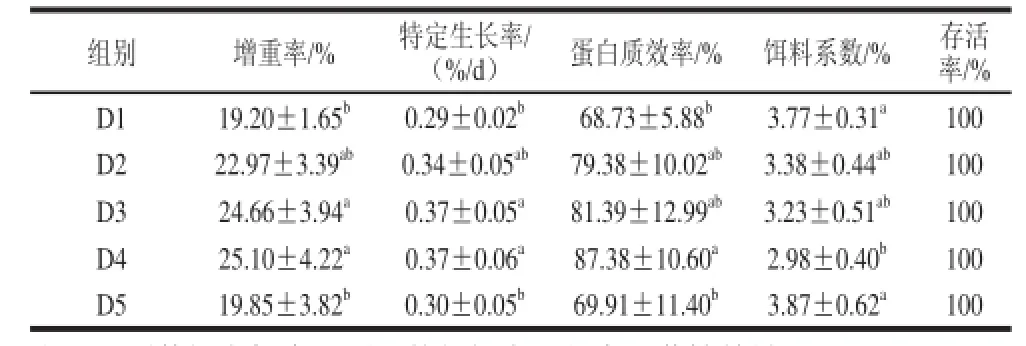
表2 日粮OKGM对齐口裂腹鱼生长性能的影响(x±s,n=20)Table 2 Effect of dietary OKGM on the growth performance of SPT (x±s, n=20)
由表2可知,经60 d养殖,随着日粮中OKGM添加量的升高,齐口裂腹鱼增重率、特定生长率、蛋白质效率先增高后降低,饵料系数先降低后增加。D3、D4组实验鱼增重率和特定生长率均显著高于对照组D1和D5组(P<0.05),均与D2组差异不显著(P>0.05);D4组蛋白质效率显著高于对照组D1、D5组(P<0.05),与D2、D3组差异不显著(P>0.05);实验鱼各组的存活率没有显著性差异(P>0.05)。综合生长性能各指标,说明日粮中添加4~16 g/kg OKGM对齐口裂腹鱼生长具有促进作用。
2.2 日粮OKGM对齐口裂腹鱼形体指标和内脏指数的影响

表3 日粮OKGM对齐口裂腹鱼形体指标和内脏指数的影响(x±s,n=20)Table 3 Effect of dietary OKGM on body and visceral indexes of SPT (x±s, n=20)
由表3可知,随着日粮OKGM添加量的增加,各实验组中的体长/体高、肥满度、肝体比与对照组D1均差异不显著(P>0.05);D2、D3、D4组肠脂比显著高于对照组D1(P<0.05),与D5组差异不显著(P>0.05),说明日粮中添加4~16 g/kg OKGM对齐口裂腹鱼肠系膜脂肪沉积显著增加。
2.3 日粮OKGM对齐口裂腹鱼肌肉基本成分和肝胰脏水分、脂肪的影响
由表4可知,D4组肌肉水分含量显著低于D1、D5组(P<0.05),与D2、D3组却是极显著差异(P<0.01);D3组实验鱼肌肉中粗蛋白质含量最高,与D1、D2、D4组差异不显著(P>0.05),说明添加日粮中适量的OKGM不影响齐口裂腹鱼蛋白质的含量;但显著高于D5组(P<0.05),D3组实验鱼肌肉中粗脂肪含量最低,均显著低于其他组(P<0.05),说明日粮中添加8 g/kg OKGM会降低齐口裂腹鱼肌肉粗脂肪含量,日粮OKGM水平对实验鱼肌肉中粗灰分含量无显著性差异(P>0.05)。
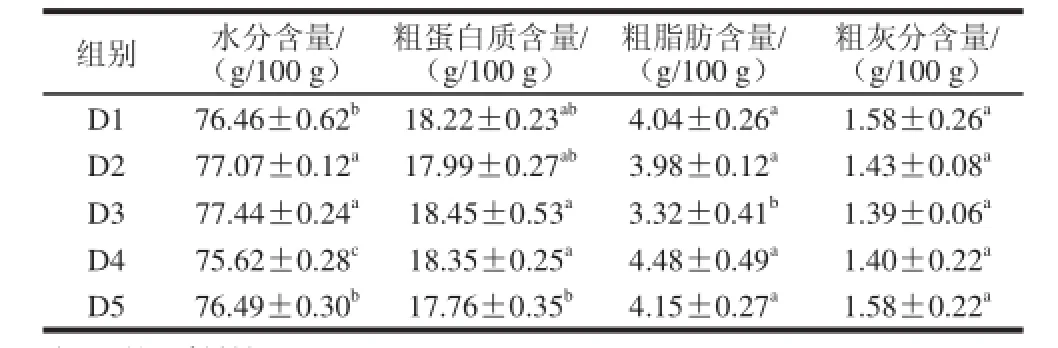
表4 日粮OKGM对齐口裂腹鱼的肌肉基本成分的影响(x±s,n=8)Table 4 Effect of dietary OKGM on muscle proximate composition of SPT (x±s, n=8)
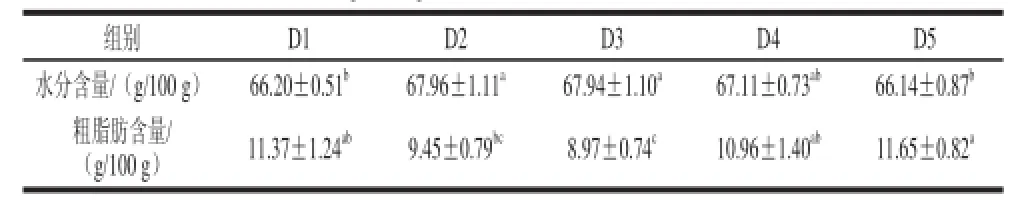
表5 日粮OKGM对齐口裂腹鱼肝胰脏水分和粗脂肪含量的影响(x±s,n=8)Table 5 Effect of dietary OKGM on moisture and crude fat contents in the hepatopancreas of SPT (x±s, n=8))
由表5可知,与对照组D1相比,D2、D3组肝胰脏水分含量显著增加(P<0.05),D4、D5组差异不显著(P>0.05);D3组肝胰脏粗脂肪含量比对照组D1显著降低(P<0.05),其他组与对照组D1差异不显著(P>0.05)。
2.4 日粮OKGM对齐口裂腹鱼血脂的影响

表6 日粮OKGM对齐口裂腹鱼血脂的影响(x±s,n=8)Table 6 Effect of dietary OKGM on blood lipid levels of SPT (x±s,, n=8))
由表6可知,与对照组D1相比,D2和D5组血清中TC的含量显著低于(P<0.05),D4组血清中TC的含量显著升高(P<0.05),D3组差异不显著(P>0.05);随着日粮中OKGM添加量的增加,血清中TG含量变化不是很大,与对照组D1相比,D4组血清中TG含量显著升高(P<0.05),其他组差异不显著(P>0.05);与对照组D1相比,D2组血清中HDL-C含量显著升高(P<0.0 5),与D 3、D 4、D 5组差异不显著(P>0.05),说明添加4 g/kg OKGM对齐口裂腹鱼的血清HDL-C有增加作用;D5组血清中LDL-C显著低于D1、D2组(P<0.05),与其他组差异不显著(P>0.05),说明添加32 g/kg OKGM对齐口裂腹鱼的血清LDL-C有降低作用;与对照组D1相比,D2、D3、D5组血清中FFA的含量显著降低(P<0.05),D4组差异不显著(P>0.05),说明添加4~8 g/kg OKGM对齐口裂腹鱼血清中FFA有降低作用。综上血脂各指标表明日粮中OKGM添加量对齐口裂腹鱼血脂水平没有明显的剂量效应。
2.5 日粮OKGM对齐口裂腹鱼脂肪代谢酶活性的影响

表7 日粮OKGM对齐口裂腹鱼脂肪代谢酶活性的影响(x±s,n=8)Table 7 Effect of dietary OKGM on lipid metabolism enzyme activities in SPTT (x±s, n=8)
由表7可知,在脂肪代谢酶方面,随着OKGM添加量的增加,LPL活性变化不大,与对照组D1相比,D4组LPL活性显著升高(P<0.05),其他组差异不显著(P>0.05);HL活性随着OKGM添加量的增加先升高后降低,D4组HL活性最高,但与对照组D1差异不显著(P>0.05);与对照组D1相比,D4组TL活性显著升高(P<0.05),其他组差异不显著(P>0.05)。
在肠道消化酶方面,随着OKGM添加量的增加,肠道脂肪酶活性均升高,与对照组相比,D3、D4、D5组肠道脂肪酶活性均显著升高(P<0.05),D2组差异不显著(P>0.05);说明日粮中添加8~32 g/kg OKGM能提高齐口裂腹鱼肠道脂肪酶活性,有助于其消化吸收。
3 讨 论
通过养殖齐口裂腹鱼60 d后,与对照组相比,日粮中添加8~16 g/kg OKGM增重率和特定生长率均显著提高(P<0.05),添加16 g/kg OKGM蛋白质效率显著提高(P<0.05),饵料系数显著降低(P<0.05)。因此,日粮中添加8~16 g/kg OKGM对齐口裂腹鱼生长具有促进作用。向枭等[20]研究了饲料中黄芪多糖(Astragalus polysaccharides,APS)的含量对齐口裂腹鱼的影响,结果表明:与对照组C相比,APS试验组的增重率、特定生长率、饲料蛋白效率有显著增高的趋势(P<0.05);张艳秋等[21]研究了饲料中添加多糖复合物糖萜素对白鲳生长性能的影响,结果表明:与对照组相比,添加125、250 mg/kg多糖复合物糖萜素增重率显著提高(P<0.05),饵料系数显著降低(P<0.05);这与本实验研究结果基本一致,说明日粮中添加4~16 g/kg OKGM对齐口裂腹鱼生长有促进作用。
血脂水平是反映体内脂肪代谢水平的重要生理指标,脂肪在鱼类细胞内主要以甘油三酯形式存在,甘油三酯是鱼类脂类代谢的主要物质[22]。实验结果表明:日粮中OKGM添加量对齐口裂腹鱼TC、TG、HDL-C和LDL-C没有明显的剂量效应,OKGM添加量为4~8 g/kg能降低齐口裂腹鱼血清中FFA含量;张艳秋等[21]研究了饲料中添加多糖复合物糖萜素对白鲳血清胆固醇的影响,结果表明:与对照组相比,试验组白鲳血清中胆固醇含量均差异不显著(P>0.05);邱燕等[23]研究了棉子糖对草鱼生长和血清生化指标的影响,结果表明:与对照组相比,实验组草鱼血清TG含量显著升高(P<0.05),HDL-C、LDL-C含量均显著降低(P<0.05),TC含量显著降低(P<0.05);可能的原因是多糖能够在有效增强机体的免疫机制,加快肝胆循环,使肝内生成的酮体和肝外组织所能利用的限度达到很好的一个平衡[24],从而降低了血脂在血液中的堆积。Enes等[25]研究了瓜尔胶对白鲷鱼脂代谢的影响,结果表明:与对照组相比,随着瓜尔胶添加量的增加白鲷鱼血清中TC、TG含量逐渐增加,但差异均不显著(P>0.05);这与上述实验结果不完全一致,可能是鱼的和多糖种类不同造成的。
在小鼠[26]和养殖鱼[27]的研究发现,肝脂酶和脂蛋白脂酶活性显著降低与脂肪肝发生密切相关。本实验中,与对照组D1相比,日粮OKGM添加量为16 g/kg能够显著提高LPL、HL、PL活性(P<0.05),这说明添加适宜OKGM能提高齐口裂腹鱼肝胰脏脂肪代谢酶活性,降低肝胰脏脂肪积累。前肠脂肪酶活性是评价前肠对脂肪消化能力的重要指标[28]。本实验中,日粮中添加8~32 g/kg OKGM均能显著提高齐口裂腹鱼肠道脂肪酶活性(P<0.05)。吴旋[29]研究了4 种中草药多糖对黄颡鱼消化组织脂肪酶活力的影响,结果表明:对照组相比,添加黄芪多糖均能不同程度地提高黄颡鱼消化组织内脂肪酶的活力;添加枸杞多糖可显著提高黄颗鱼消化组织内脂肪酶的活力;但酶活力与添加水平呈现负相关关系;灵芝多糖各实验组均能较高地提高黄颗鱼消化组织内脂肪酶的活力;这与上述研究结果基本一致。
日粮中添加适量的OKGM对齐口裂腹鱼生长性能、血脂水平和脂肪代谢酶活性有较好的影响,综上所述,齐口裂腹鱼饲料中OKGM推荐添加量为4~16 g/kg。OKGM可能作为一种新型免疫增强剂,添加到基础饲料中,为大规模养殖齐口裂腹鱼提供一定的理论依据;OKGM作为一种改性多糖,在保健食品的应用中极具潜力,但其生理活性研究相对较少,使用目的不明确,需要更多理论研究支撑其在保健食品中运用。
[1] KATO K, MATSUDA K. Studies on the chemical structure of konjac mannan[J]. A g r i c u l t u r a l a n d Biological Chemistry, 1969, 33: 1446-1453.
[2] ZOU X X, XIE M R. Advances in research konjac glucomannan[J]. Modern Chemical Industry, 1995, 15(12): 15-17.
[3] 刘红梅. 魔芋葡甘聚糖对肥胖及糖尿病小鼠的治疗作用[J]. 营养学报, 2002, 24(4): 437-438.
[4] 宾石玉, 周安国, 程培安. 寡糖对动物免疫功能的作用[J]. 中国兽医学报, 2006, 26(3): 344-346.
[5] 董澄. 寡糖的生物学功能及其在畜牧业中的应用[J]. 饲料博览, 2008(5): 16-18.
[6] 唐胜球, 董小英, 邹晓庭, 等. 畜禽生物饲料添加剂魔芋葡甘聚糖的研究与应用[J]. 饲料工业, 2005, 26(2): 37-39.
[7] 路璐. 一种通过在饲料中添加葡甘露聚糖来消除肉鸡和雏鸭黄曲霉毒素中毒症的生物学方法[J]. 中国家禽, 2005, 27(5): 28-32.
[8] 李斌, 谢笔钧. 魔芋葡甘聚糖的H2O2氧化改性及其流变性能研究[J].湖北化工, 2002, 19(1): 9-11.
[9] 庞杰, 李斌, 谢笔钧, 等. 氧化魔芋葡甘聚糖的结构研究[J]. 结构化学, 2004, 23(8): 912-917.
[10] 董红兵, 李斌, 谢笔钧. 氧化魔芋葡甘聚糖/Ca(OH)2杂化膜的制备与性能[J]. 化学与生物工程, 2005(9): 22-24.
[11] 吴波, 陈运中, 徐凯, 等. 魔芋葡甘聚糖的氧化改性及其性质研究[J].粮油深加工及食品, 2008(5): 15-16.
[12] 赵勤, 邬应龙. 氧化魔芋葡甘露聚糖对小鼠免疫功能影响的研究[J].营养学报, 2011, 33(5): 492-496; 501.
[13] 杨义, 李山友, 周小宁, 等. 裂腹鱼的生物学及养殖[J]. 水利渔业, 2003, 23(4): 22-23.
[14] 若木, 王鸿泰, 殷启云, 等. 齐口裂腹鱼人工繁殖的研究[J]. 淡水渔业, 2001, 31(6): 3-5.
[15] 温安祥, 曾静康, 何涛. 齐口裂腹鱼肌肉的营养成分分析[J]. 水利渔业, 2003, 23(1): 13-15.
[16] 宋昭彬. 齐口裂腹鱼和岩原鲤野生种群遗传多样性研究[D]. 成都:四川大学, 2005.
[17] 谢佳燕. 我国齐口裂腹鱼的研究现状[J]. 安徽农业科学, 2010, 38 (25): 13721-13722; 13726.
[18] 段彪, 向枭, 周兴华, 等. 齐口裂腹鱼饲料中适宜脂肪需要量的研究[J].动物营养学报, 2007, 19(3): 232-236.
[19] 何雷. 齐口裂腹鱼幼鱼对蛋白质、脂肪和糖适宜需要量的研究[D].雅安: 四川农业大学, 2008.
[20] 向枭, 陈建, 周兴华, 等. 黄芪多糖对齐口裂腹鱼生长、体组成和免疫指标的影响[J]. 水生生物学报, 2011, 35(2): 291-299.
[21] 张艳秋, 詹勇, 黄磊. 多糖复合物糖萜素对淡水白鲳生长和肉质指标作用的初级报告[J]. 饲料工业, 2005, 26(4): 57-59.
[22] 何福林, 向建国, 李常健, 等. 水温对虹鳟血液学指标影响的初步研究[J]. 水生生物学报, 2007, 31(3): 363-369.
[23] 邱燕, 叶元土, 蔡春芳, 等. 棉子糖对草鱼生长性能和血清生化指标的影响[J]. 动物营养学报, 2010, 22(2): 393-400.
[24] MICHAEL MILLER M D. Raising an isolated low HDL-C level: why, how, and when?[J]. Cleveland Clinic Journal of Medicine, 2003, 70(6): 553-560.
[25] ENES P, POUSAO F P, SALMERÓN C, et al. Effect of guar gum on glucose and lipid metabolism in white sea bream Diplodus sargus[J]. Fish Physiology and Biochemistry, 2013, 39(2): 159-169.
[26] REUE K, DOOLITTLE M H. Naturally occurring mutations in mice affecting lipid transport and metabolism[J]. Journal of Lipid Research, 1996, 37:1387-1405.
[27] 杨鸿昆, 黄凯, 阮栋俭. 养殖鱼类脂肪肝及防治研究进展[J]. 水利渔业, 2007, 27(1): 4-6.
[28] 朱瑞俊, 李小勤, 谢骏, 等. 饲料中添加氯化胆碱对草鱼成鱼生长、脂肪沉积和脂肪代谢酶活性的影响[J]. 中国水产科学, 2010, 17(3): 527-534.
[29] 吴旋. 四种中草药多糖对黄颡鱼生长、体成分及部分生理生化指标的影响[D]. 天津: 天津农学院, 2011.
Effect of Dietary Oxidized Konjac Glucomannan on Growth Performance, Blood Lipid and Lipid Metabolism Enzymes Activities in Schizothorax prenanti Tchang
ZHOU Cheng, WU Ying-long*, XIA Xiao-jie, TANG Miao, LIAO Jie
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
Objective: To study the effect of dietary oxidized konjac glucomannan (OKGM) on growth performance, blood lipid and lipid metabolism enzyme activities in Schizothorax prenanti Tchang (SPT). Methods: Three hundred SPT with initial body weigh of (79.54 ± 8.12) g were randomly divided into 5 groups with 3 replicates of 20 fish in each group. The feed for control group (D1) was free of OKGM, and that for treatment groups contained 4, 8, 16 and 32 g/kg OKGM, respectively. The experiment lasted for 60 days. Results: Compared with the control group, body weight gain rate and specific growth rate were significantly improved by adding 8 g/kg and 16 g/kg OKGM in the SPT diet (P < 0.05). Addition of 16 g/kg OKGM in the SPT diet could significantly increase protein efficiency ratio, and reduce feed conversion ratio and muscle moisture (P < 0.05). Meanwhile, addition of 8 g/kg OKGM resulted in a significant reduction in the fat content in muscle and hepatopancreas (P < 0.05). In addition, addition of 4–16 g/kg OKGM in the SPT diet significantly enhanced intraperitoneal fat ratio (P < 0.05). Moreover, addition of OKGM in the SPT diet affected the contents of total cholesterol, triglyceride, high-density lipoprotein cholesterol and low-density lipoprotein cholesterol in serum without any dose-response relationship. OKGM addition at a dose of 4–8 g/kg in the SPT diet could significantly decrease the content of free fatty acids. Furthermore, the activities of lipoprotein lipase, hepatic lipase and total lipase were significantly increased by adding 16 g/kg OKGM (P < 0.05). On the other hand, the activity of intestinal lipase was significantly improved due to addition of OKGM at a dose of 8–32 g/kg (P < 0.05). Conclusion: Feed containing appropriate amounts of OKGM can improve the growth performance of SPT, increase thefeed conversion ratio, decrease muscle fat content, and improve the activities of lipid metabolism enzymes and lipase. Meanwhile, OKGM at a dose of 4–16 g/kg is the optimal concentration in SPT feed.
oxidized konjac glucomannan; Schizothorax prenanti Tchang; growth; blood lipid; lipid metabolism enzyme activity
TS254.1
A
1002-6630(2014)09-0250-06
10.7506/spkx1002-6630-201409049
2013-08-11
四川农业大学“211”工程双支计划项目(2013)
周成(1986—),男,硕士研究生,研究方向为功能性食品。E-mail:806888397@qq.com
*通信作者:邬应龙(1963—),男,教授,博士,研究方向为功能性食品。E-mail:wuyinglong99@163.com
