响应面法优化受精蛋蛋清制备抗氧化肽酶解工艺
2014-01-20王俊杰涂勇刚罗序英李建科陈彰毅
王俊杰,赵 燕,*,涂勇刚,罗序英,李建科,陈彰毅
响应面法优化受精蛋蛋清制备抗氧化肽酶解工艺
王俊杰1,赵 燕1,*,涂勇刚2,罗序英1,李建科1,陈彰毅1
(1.南昌大学 食品科学与技术国家重点实验室,生物质转化教育部工程研究中心,江西 南昌 330047;2.江西农业大学食品科学与工程学院,江西 南昌 330045)
以酶解产物的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH)自由基清除 率为指标,在单因素试验的基础上,选择酶解温度、pH值、底物质量浓度、加酶量4 个因素,通过Box-Behnken试验设计和响应面分析法优化酶解受精蛋蛋清制备抗氧化肽的最佳工艺条件。结果表明:在酶解温度46 ℃、pH 9.1、底物质量浓度4.28 g/100 mL、加酶量21 000 U/g条件下,所得酶解产物的DPPH自由基清除率活性最强,达到84.97%。碱性蛋白酶酶解得到的产物具有较强的抗氧化活性,优化工艺条件与理论预测拟合度高。
受精蛋;抗氧化肽;酶解;响应面
人体新陈代谢过程中会产生一些活性氧和其他自由基产物,这些物质的过量积累会对DNA、蛋白质、膜脂质和碳水化合物等生物大分子产生氧化性损伤[1-3]。据报道,这些物质在一些疾病(癌症、冠心病、糖尿病、风湿性关节炎、老年痴呆)的发生过程中起着重要作用[4-7]。在食品加工中脂肪氧化导致食品变质,同时可能生成一些具有 潜在毒性的反应产物[8]。虽然市场上有一些合成抗氧化剂如叔丁基对羟基茴香醚、二叔丁基对甲酚、叔丁基对二苯酚等,由于这些物质不规范使用或滥用都具有很大的安全隐患[9],因此在日常的使用中都有严格的控制,所以目前迫切需要开发具有天然安全、无毒副作用的抗氧化剂。
从动植物蛋白分离制备生物活性肽是研究热点,生物活性肽一般由3~20 个氨基酸残基组成,并且其活性与氨基酸种类和序列有关[10],这些生物活性肽自身具有营养功能,且具有分子质量小、热稳定、易吸收的特点。禽蛋含有丰富的蛋白质,易吸收,并且其氨基酸组成与人体需要的必需氨基酸比例类似[11]。目前国内外均是采用酶解的方式从禽蛋蛋白中分离制备抗氧化活性肽,如Tanzadehpanah等[12]用胃蛋白酶酶解鸵鸟蛋蛋清获得LTEQESGVPVMK,Chen Chen等[13]用采用木瓜蛋白酶酶酶解鸡蛋蛋清,获得两个抗氧化肽YLGAK(551.54 D)和GGLEPINFQ (974.55 D),Davalos等[14]用胃蛋白酶酶解蛋清获得4 个抗氧化肽YAEERYPIL、SALAM、YQIGL、YRGGLEPINF。受精蛋是一种在特定的条件下能够孵化的禽蛋,孵化过程中蛋内的水分、蛋白质、脂肪、无机盐等营养物质在酶的作用下进行一系列的代谢和转化[15],这些物质的变化为制备新型抗氧化肽提供基础,此外本课题组前期测定了经孵化后的受精蛋蛋清的抗氧化活性,发现经孵化后的受精蛋蛋清抗氧化活性有明显提高[16]。本实验研究酶解受精蛋蛋清制备抗氧化肽的工艺条件,为下一步制备抗氧化肽提供基础数据。
1 材料与方法
1.1 材料、试剂与仪器
三黄鸡受精蛋 江西农业大学动物科学技术学院。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl1-(2,4,6-trinitrophenyl)hydrazyl,DPPH) 美国Sigma公司;硫酸亚铁、邻菲罗啉、邻二氮菲、乙醇 国药集团(上海)化学试剂有限公司;碱性蛋白酶(10万 U/g)上海蓝季科技发展有限公司。
752N紫外-可见分光光度计 上海精密科学仪器有限公司;AR1140电子天平 奥豪斯仪器(上海)有限公司;TDL-5-A离心机 上海安亭科学仪器厂;DKB-501A超级恒温水槽 上海森信实验仪器有限公司;电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;科裕KFU微电脑全自动孵化机 山东省德州 市科裕孵化设备有限公司。
1.2 方法
1.2.1 受精蛋的孵化条件
孵化温度38.2 ℃,相对湿度为60%。
1.2.2 样品的制备
取孵化6 d的受精蛋蛋清→高速匀浆后冷冻干燥→碱性蛋白酶酶解→灭酶(95 ℃、10 min)→5 000 r/min 离心15 min→收集上清液即为抗氧化肽。
1.2.3 单因素试验
以酶解液的DPPH自由基清除能力为指标,分别 考察底物质量浓度、加酶量、pH值、酶解温度和酶解时间对酶解受精蛋蛋清制备抗氧化肽工艺的影响。
1.2.3.1 底物质量浓度对酶解工艺的影响
分别按照底物质量浓度为1、2、3、4、5、6 g/100 mL配制一定体积的溶液,加酶量为16 000 U/g,调pH 8.0,均在50 ℃水浴下酶解3 h,测定酶解液DPPH自由基清除能力,每个样品测3 次平行。
1.2.3.2 加酶量对酶解工艺的影响
根据1.2.3.1节确定的最佳底物质量浓度配制一定体积的溶液,加酶量分别为8 000、12 000、16 000、20 000、24 000、28 000 U/g, 调pH 8.0,均在50 ℃水浴下酶解3 h,测定酶解液DPPH自由基清除能力,每个样品测3 次平行。
1.2.3.3 pH值对酶解工艺的影响
按照已确定的最佳底物质量浓度和加酶量配制一定体积的溶液,分别调溶液pH值至7、8、9、10、11、12,均在50 ℃水浴下酶解3 h,测定酶解液DPPH自由基清除能力,每个样品测3 次平行。
1.2.3.4 酶解温度对酶解工艺的影响
按照已确定的最佳底物质量浓度、加酶量和pH值配制一定体积的溶液,分别在40、45、50、55、60、65 ℃水浴下酶解3 h,测定酶解液DPPH自由基清除能力,每个样品测3 次平行。
1.2.3.5 酶解时间对酶解工艺的影响
按照已确定的最佳底物质量浓度、加酶量、pH值配制一定体积的溶液,在1.2.3.4节确定的最佳酶解温度下,分别酶解0.5、1、2、3、4、5 h,测定酶解液DPPH自由基清除能力,每个样品测3 次平行。
1.2.4 酶解工艺优化
根据单因素试验结果,在最佳的酶解时间4 h下,选取酶解温度、pH值、底物质量浓度、加酶量为自变量,酶解液的DPPH自由基清除率为响应值,采用Box-Behnken原理,进行四因素三水平试验设计。
1.2.5 DPPH自由基清除能力测定
[17]方法,取4 mL新鲜配制的0.15 mmol/L的DPPH乙醇溶液于试管中,加1 mL水解液,振荡混合均匀,暗处反应20 min,于517 nm波长处测定吸光度,用相同体积的蒸馏水代替样品做空白对照,每个浓度测3次平行。

式中:A2为4 mL DPPH+1 mL样品溶液的吸光度;A1为4 mL乙醇+1 mL样品溶液的吸光度;A0为4 mL乙醇+1 mL水的吸光度。
2 结果与分析
2.1 酶解制备抗氧化肽单因素试验
2.1.1 底物质量浓度对受精蛋蛋清抗氧化肽清除DPPH自由基的影响
底物质量浓度对酶解产物的DPPH自由基清除能力的影响如图1所示,在一定的范围内,随着底物质量浓度的增大,酶解物的DPPH自由基清除能力逐渐增强,再增大底物质量浓度,酶解产物清除率不增反降。这可能是由于底物质量浓度的增加,酶与底物之间的接触面积增大,使酶解效率增高,但当底物质量浓度过高时,导致溶液的黏度增高,影响了酶与底物的作用,使酶解效率降低。
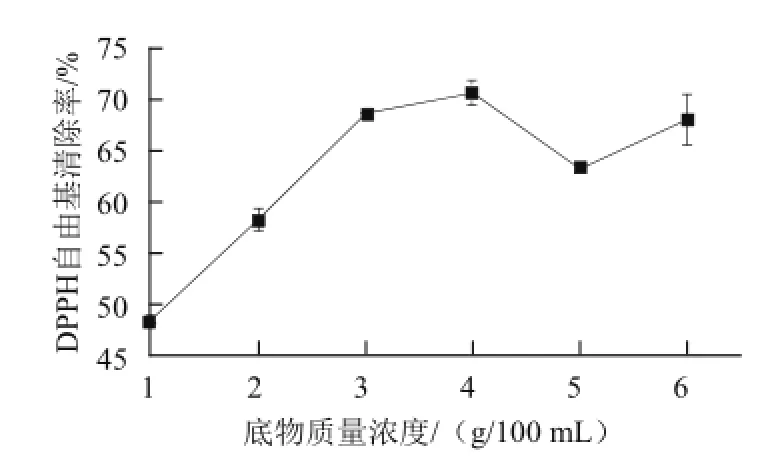
图1 不同底物质量浓度的酶解产物对DPPH自由基清除率的影响Fig.1 Effect of substrate concentration on DPPH radical scavenging activity of hydrolysates
2.1.2 加酶量对受精蛋蛋清抗氧化肽清除DPPH自由基的影响
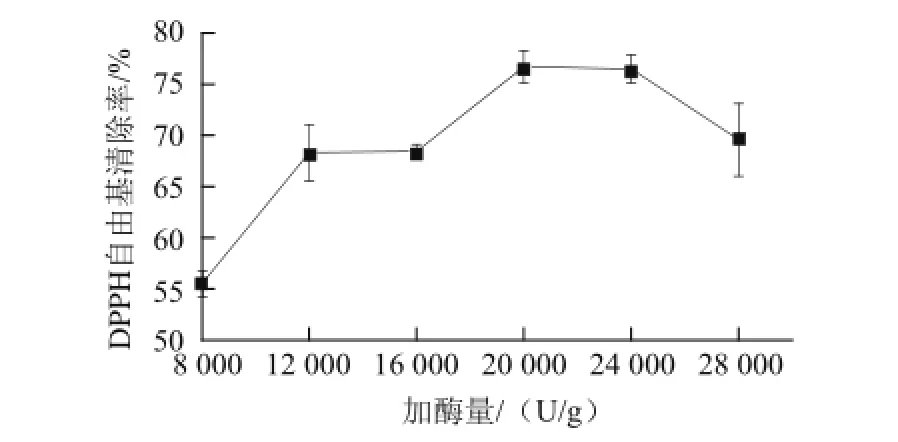
图2 不同加酶量的酶解产物对DPPH自由基清除率的影响Fig.2 Effect of enzyme amount on DPPH radical scavenging activity of hydrolysates
加酶量对酶解产物的DPPH自由基清除能力的影响结果如图2所示,当加酶量从8 000~12 000 U/g,酶解液的DPPH自由基清除率迅速升高,当加酶量达到20 000、24 000 U/g时,酶解液的DPPH自由基清除率达到最高。这可能是因为在底物充足的情况下,随着加酶量的增加,酶解反应增强,当酶量达到饱和后,一些活性肽可能会随着酶解反应的进行再次被酶解,使其清除率下降。从经济角度考虑,选择加酶量为20 000 U/g。
2.1.3 酶解pH值对受精蛋蛋清抗氧化肽清除DPPH自由基的影响
pH值对酶解产物的DPPH自由基清除能力的影响结果如图3所示,当pH值为9时,酶解产物的抗氧化活性最高,随着pH值的升高,酶解产物的DPPH自由基清除率呈下降趋势,这可能是由于在强碱条件下,抑制了酶活力,导致酶解效率下降。所以,选择pH 9最佳。

图3 不同酶解pH值的酶解产物对DPPH自由基清除率的影响Fig.3 Effect of pH on DPPH radical scavenging activity of hydrolysates
2.1.4 酶解温度对受精蛋蛋清抗氧化肽清除DPPH自由基的影响

图4 不同酶解温度的酶解产物对DPPH自由基清除率的影响Fig.4 Effect of hydrolysis temperature on DPPH radical scavenging activity of hydrolysates
酶解温度对酶解产物的DPPH自由基清除能力的影响结果如图4所示,40~45 ℃随着温度升高,DPPH自由基清除率随着升高,并在45 ℃达到最大值。当酶解温度高于45 ℃后,酶解产物的DPPH自由基清除率逐渐下降,这可能是由于当酶解温度小于酶的最适温度时,随着温度升高可以提高酶的活性,且有利于底物折叠结构的展开[18];当温度继续升高,超过了酶的最适宜温度后,酶的活性受到抑制,甚至酶失活,使酶解效率降低。因而,选择45 ℃为最佳酶解温度。
2.1.5 酶解时间对受精蛋蛋清抗氧化肽清除DPPH自由基的影响
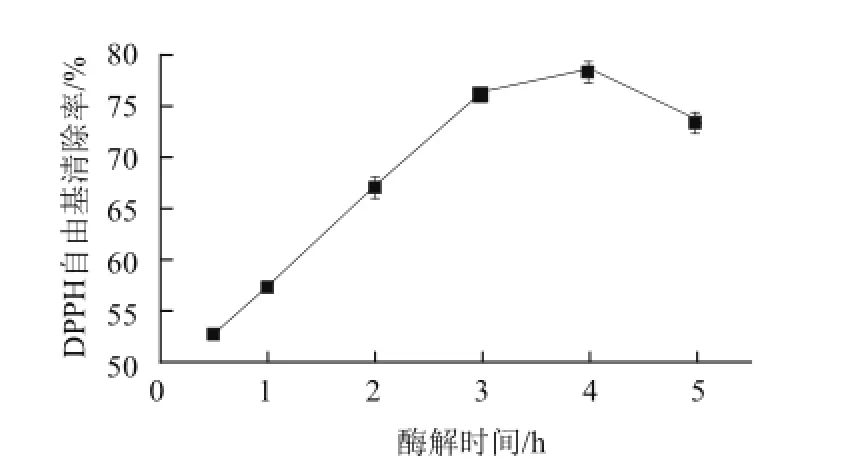
图5 不同酶解时间的酶解产物对DPPH自由基清除率的影响Fig.5 Effect of hydro lysis time on DPPH radical scavenging activity of hydrolysates
酶解时间对酶解产物的DPPH自由基清除能力的影响如图5所示,随着酶解时间的延长,酶解产物的DPPH自由基的清除能力呈增强的趋势,酶解4 h,酶解产物的DPPH自由基清除能力最强。这可能是因为在酶解反应的初始阶段,酶与底物的浓度较大,酶与底物的充分接触使酶解反应迅速,随着反应的进行,底物逐渐被消耗,酶的特异性催化位点减少[19],使反应减慢,继续延长酶解时间,使底物被过度酶解,导致酶解产物的DPPH自由基清除能力下降。
2.2 酶解制备抗氧化肽响应面优化工艺
2.2.1 响应面优化工艺结果

表1 制备抗氧化肽响应面试验设计及结果Table 1 Experimental design and results of response surface methodology for the preparation of antioxidant peptide
采用Design-Export 8.0.6进行响应面优化酶解工艺设计,获得抗氧化肽制备的四因素三水平试验结果如表1所示。对试验数据进行多元回归拟合,回归模型系数及显著性见表2,得到回归回归方程为Y=86.69+3.07A+1.13B+2.59C+1.89D-0.30AB-0.90AC+0.30AD+1.60BC-2.11BD-0.55CD-6.84A2-2.45B2-4.02C2-1.58D2。其中模型一次项A、C、D极显著,B显著;模型交互项BD显著,模型二次项A2、B2、C2极显著,D2显著。说明试验因素对DPPH自由基清除率的影响不是简单的线性关系。各因素对受精蛋蛋清酶解产物的DPPH自由基清除率大小的影响依次为A>C>D>B。
从表2回归模型方差分析可知,模型(P<0.000 1)极显著,失拟项(P=0.637 3)不显著,表明模型与实际拟合程度较好,其中 R2=0.933 3,说明预测值与实测值之间具有较高的相关性;,说明该模型能解释86.66%的响应值的变化,所以用该模型能够较好的优化酶解工艺。
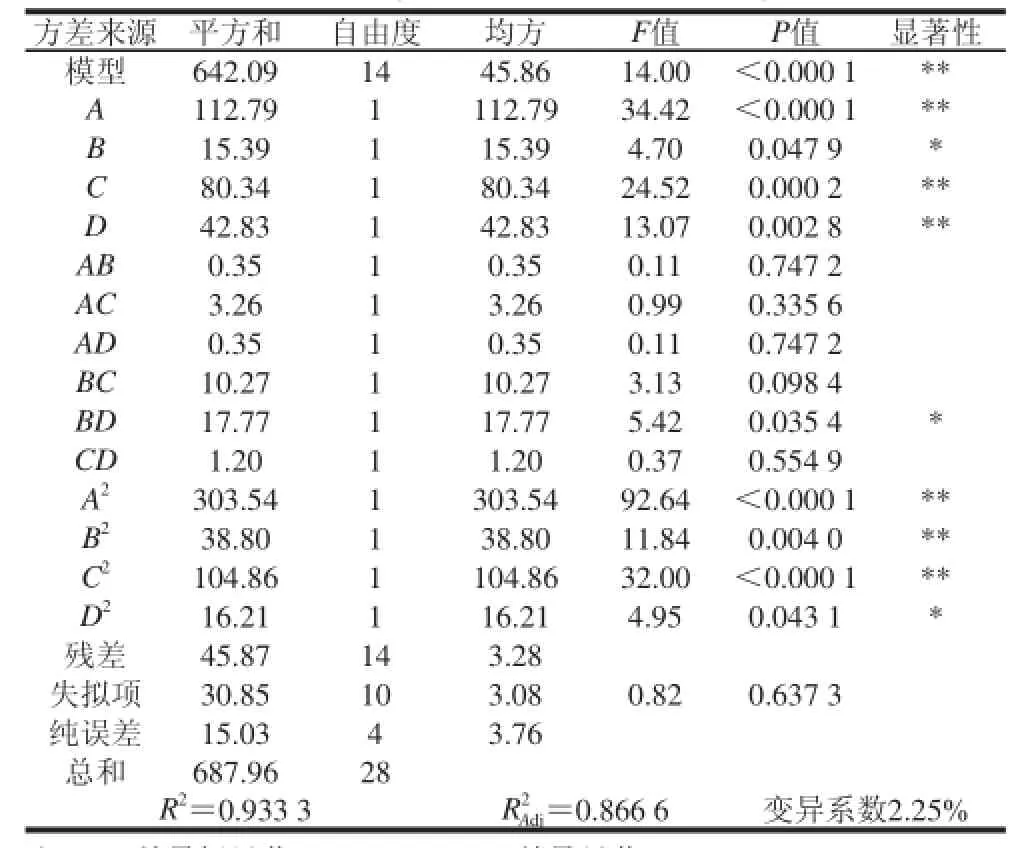
表2 回归模型的方差分析Table 2 Variance analysis for the established regression model
2.2.2 响应面分析及因素间交互作用
模型的响应曲面图和等高线如图6所示,由等高线的线型可直观反映出因素间的交互影响,圆形表示两因素交互影响不显著,椭圆形表示因素间交互影响显著[20]。本实验结果表明,AD、BC、BD的交互作用对酶解产物的DPPH自由基清除率有显著影响。图6a表明底物质量浓度4 g/100 mL、pH 9.0条件下,加酶量与温度之间交互作用显著,当酶解温度在40~50 ℃,酶解产物的DPPH自由基的清除率随着加酶量的增加先增强后减弱,当加酶量较高时,DPPH自由基的清除率变化不明显。当加酶量在18 000~22 000 U/g,酶解产物的DPPH自由基清除率随温度的升高先增强后减弱。当加酶量处于较高水平,温度处于中间水平时,酶解产物的DPPH自由基清除率较高。当加酶量一定时,温度增高,DPPH自由基清除率降低,这可能是由于温度过高,破坏了酶的结构,使活性降低,导致DPPH自由基清除率降低。图6b表明,当加酶量20 000 U/g,酶解温度45 ℃时,底物质量浓度与pH值之间交互作用对酶解产物的DPPH自由基清除率有显著影响。当底物质量浓度一定时,酶解物的DPPH自由基清除率随着pH值的升高呈先增强后减弱的趋势,当pH值一定时,酶解产物的DPPH自由基清除率随着底物质量浓度的升高呈先增强后减弱的趋势。当底物质量浓度和pH值均处于中间水平时,酶解产物的DPPH自由基清除率达到最高。图6c表明,在底物质量浓度4 g/100 mL、45 ℃条件下,加酶量和pH值之间交互影响显著。当pH值处于较低水平时,酶解物的DPPH自由基清除率随加酶量的增加而增强,但当pH值处于较高水平时,酶解产物的DPPH自由基清除率随加酶量的增加先增强后减弱。当加酶量一定时,酶解产物的DPPH清除率随pH值的升高先增强后减弱。
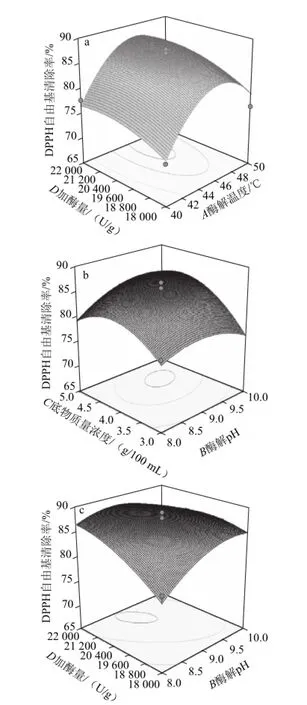
图6 加酶量、温度、pH值、底物质量浓度交互影响DPPH自由基清除率的响应曲面和等高线图Fig.6 Response surface and contour plots for the interactive effects of enzyme amount, hydrolysis temperature, pH and substrate concentration on DPPH radical scavenging activity of hydrolysates
2.2.3 模型验证实验
由Design-Export 8.0.6对模型分析,得到模型自变量最佳值为酶解温度46.07 ℃、pH 9.09、底物质量浓度4.28 g/100 mL、加酶量21 015.51 U/g,在此优化条件下酶解产物的DPPH自由基清除率达到87.92%。根据实际条件最终选择酶解温度46 ℃、pH 9.1、底物质量浓度4.28 g/100 mL、加酶量21 000 U/g,实际测得的酶解产物的DPPH自由基清除率达到84.97%。理论值87.92%与实际值相对偏差为3.47%,说明模型拟合得到的优化结果较为准确。
3 结 论
采用碱性蛋白酶酶解受精蛋蛋清,以酶解产物的DPPH自由基清除率为指标,采用Design-Export 8.0.6优化得到酶解受精蛋蛋清制备抗氧化肽的最佳工艺条件,酶解温度46 ℃、pH 9.1、底物质量浓度4.28 g/100 mL、加酶量21 000 U/g。酶解4 h后得到的样品对DPPH自由基的清除率达到84.97%。验证实验结果表明,该模型较为可靠,具有较好的预测能力。
参考文献:
[1] DAVALOS A, MIGUEL M, BARTOLOME B, et al. Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis[J]. Journal of Food Protection, 2004, 67(9): 1939-1944.
[2] WISEMAN H, HALLIWELL B. Damage to DNA by reactive oxygen and nitrogen species: role in infl ammatory disease and progression to cancer[J]. Biochemical Journal, 1996, 313: 17-29.
[3] LAI C S, PIETTE L H. Hydroxyl radical production involved in lipid peroxidation of rat liver microsomes[J]. Biochemical and Biophysical Research Communications, 1977, 78(1): 51-59.
[4] MAMELONA J, SAINT-LOUIS R, PELLETIER É. Nutritional composition and antioxidant properties of protein hydrolysates prepared from echinoderm byproducts[J]. International Journal of Food Science and Technology, 2010, 45(1): 147-154.
[5] MOSKOVITZ J, YIM M B, CHOCK P B. Free radicals and disease[J]. Archives of Biochemistry and Biophysics, 2002, 397(2): 354-359.
[6] PRYOR W A. Free radical biology: xenobiotics, cancer, and aging[J]. Annals of the New York Academy of Sciences, 1982, 393(1): 1-22.
[7] HARMAN D. Free radical theory of aging[J]. Mutation Research/ DNAging, 1992, 275(3): 257-266.
[8] MAILLARD M N, SOUM M H, BOIVIN P, et al. Antioxidant activity of barley and malt: relationship with phenolic content[J]. LWT - Food Science and Technology, 1996, 29(3): 238-244.
[9] WANG Bin, LI Li, CHI Changfeng, et al. Purification and characterisation of a novel antioxidant peptide derived from blue mussel (Mytilus edulis) protein hydrolysate[J]. Food Chemistry, 2013, 138(2/3): 1713-1719.
[10] KIM S Y, JE J Y, KIM S K. Purification and characterization of antioxidant peptide from hoki (Johnius belengerii) frame protein by gastrointestinal digestion[J]. The Journal of Nutritional Biochemistry, 2007, 18(1): 31-38.
[11] MANN J, TRUSWELL A S. Essentials of human nutrition[M]. Oxford: Oxford University Press, 2012.
[12] TANZADEHPANAH H, ASOODEH A, CHAMANI J. An antioxidant peptide derived from ostrich (Struthio camelus) egg white protein hydrolysates[J]. Food Research International, 2012, 49(1): 105-111.
[13] CHEN Chen, CHI Yujie, ZHAO Mingyang, et al. Purification and identification of antioxidant peptides from egg white protein hydrolysate[J]. Amino Acids, 2012, 43(1): 457-466.
[14] DAVALOS A, MIGUEL M, BARTOLOME B, et al. Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis[J]. Journal of Food Protection, 2004, 67(9): 1939-1944.
[15] 李利东, 袁建兴, 宓晓黎, 等. 不同孵化期的鸡胚蛋营养和功效成分研究[J]. 食品科学, 2004, 25(11): 264-267.
[16] 王俊杰, 赵燕, 涂勇刚, 等. 受精蛋孵化期间理化性质及水溶性蛋白(肽)抗氧化活性[J]. 食品工业科技, 2013, 34(21): 78-82.
[17] CHEN Yi, XIE Mingyong, NIE Shaoping, et al. Purification, composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of ganoderma atrum[J]. Food Chemistry, 2008, 107(1): 231-241.
[18] 左继红. 微波辅助蛋白酶水解反应工艺和反应器的研究[D]. 无锡:江南大学, 2008.
[19] MULLALLY M M, O’CALLAGHAN D M, FITZGERALD R J, et al. Zymogen activation in pancreatic endoproteolytic preparations and influence on some whey protein hydrolysate characteristics[J]. Journal of Food Science, 1995, 60(2): 227-233.
[20] 刘进杰, 张玉香, 冯志彬, 等. 超声波提取莲花粉多糖工艺[J]. 食品科学, 2011, 32(18): 44-48.
Optimization of Enzymatic Preparation of Antioxidant Peptides from Fertilized Egg White by Response Surface Methodology
WANG Jun-jie1, ZHAO Yan1,*, TU Yong-gang2, LUO Xu-ying1, LI Jian-ke1, CHEN Zhang-yi1
(1. State Key Laboratory of Food Science and Technology, Engineering Research Center of Biomass Conversion, Ministry of Education, Nanchang University, Nanchang 330047, China; 2. College of Food Science and Engineering, Jiangxi Agricultural University, Nanchang 330045, China)
This paper reports on the optimization of preparation conditions for antioxidant peptides by hydrolyzing fertilized egg white with alkaline protease. One-factor-at-a-time method was used to explore the effect of hydrolysis temperature, pH, substrate concentration and enz yme amount on the 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging activity of hydrolysates. Subsequently, the response surface analysis based on Box-Behnken design was employed to optimize the hydrolysis conditions. The results showed that hydrolysates showing the highest DPPH scavenging rate of 84.97% were produced from hydrolysis of fertilized egg white at a substrate concentration of 4.28 g/100 mL at 46 ℃ and pH 9.1 with an enzyme amount of 21 000 U/g. In conclusion, peptides with high antioxidant activity can b e prepared by hydrolyzing fertilized eggs with alkaline protease and the optimized conditions al low accurate theoretical prediction.
fertilized egg; antioxidant peptide; enzymatic hydrolysis; response surface methodology
TS253.1
A
1002-6630(2014)09-0187-05
10.7506/spkx1002-6630-201409037
2013-06-26
南昌大学食品科学与技术国家重点实验室自由探索课题(SKLF-TS-201112);江西省自然科学基金项目(20132BAB214008)
王俊杰(1987—),男,硕士研究生,研究方向为食品生物技术。E-mail:hnwjj87@163.com
*通信作者:赵燕(1980—),女,副研究员,博士,研究方向为农产品加工与生物质转化。E-mail:zhaoyan@ncu.edu.cn
