分泌型卷曲相关蛋白抑制实验性小鼠肝纤维化的研究
2014-01-19毕婉蓉邢海林杨长青吴艳红金彩霞
毕婉蓉 邢海林 杨长青 吴艳红 金彩霞
分泌型卷曲相关蛋白抑制实验性小鼠肝纤维化的研究
毕婉蓉1邢海林2杨长青3吴艳红1金彩霞4
目的探讨分泌型卷曲相关蛋白(secreted frizzled related protein,SFRP)对实验性小鼠肝纤维化(Hepatic fibrosis,HF)的抑制作用。方法建立小鼠CCl4诱导HF模型,随机分为正常对照组、HF模型组与SFRP2 shRNA处理组。小鼠肝细胞中获得总RNA,经RT-PCR转化cDNA,构建pcDNA1.0/SFRP2载体HF肝细胞并克隆获得pSilencer-U6neo/SFRP2 shRNA稳定转染肝细胞。采用Westernblot、免疫荧光显微镜及激光共聚焦定位分析观察SFRP2 shRNA抑制HF作用。结果免疫双荧光显示SFRP2 shRNA抑制HF小鼠肝细胞FSP-1 mRNA、Smad2 mRNA、Wnt3A mRNA的表达;经RT-PCR及Western blot分析支持SFRP2 shRNA抑制HF小鼠肝细胞上皮-间质转换(Epithelial-mesenchymal transitions,EMT)的发生(P<0.05);流式细胞仪分析表明SFRP2 shRNA有缓解HF小鼠肝细胞凋亡的作用。结论我们研究证实SFRP在实验性小鼠肝上皮细胞中可能通过下调内源的某些自分泌信号抑制因子,抑制EMT程序,从而缓解HF。
肝纤维化;分泌型卷曲相关蛋白;上皮-间质转换
分泌型卷曲相关蛋白(secreted frizzled related protein, SFRP)家族成员陆续在非洲爪蟾或其他个体如小鼠,人和鸡等物种中被发现和分离出来,分别命名为SFRP1-5[1],也被定义为凋亡相关基因(secreted apoptosis-related proteins,SARPs)[2],1997年首次克隆获得人的SARP1、SARP2、SARP3基因[3]。我国目前对上皮-间质转换(Epithelial-mesenchymal transitions,EMT)诱导慢性肝病纤维化(Hepatic fibrosis,HF)发病机制进行了较多研究,但是否SFRP参与EMT,以及与HF是否相关,国内外尚无报道,这将对于我们了解HF的发生机制和开拓诊治思路具有重要意义。
资料与方法
一、一般资料
SPF级健康SD雄性小鼠50只,体质(90±10)g。购自及饲养于同济大学动物实验中心。动物合格证号:SCXK(粤)2004A084。动物房室温20~22℃,光照周期12 h。实验前小鼠适应环境1 W,自由饮水,无不良反应,进食、饮水和活动正常者纳入实验。
二、肝纤维化诊断标准
1.肝活检病理学检查
病理学检查是诊断HF的金标准。肝组织切片采用Massion染色,每张切片随机选取4个视野,用图象分析系统测量胶原面积并自动计算与总面积的百分比,取平均数作为判定HF程度的客观指标。由资深病理科医师阅片,按下列方法进行HF分级。
2.肝纤维化分级判定标准
1级为正常肝组织,无纤维化;2级为某些门静脉区域有纤维延伸;3级为门静脉周围纤维化,并有短的纤维间隔伸入肝小叶,少数出现由门静脉延伸至邻近门静脉的纤维间隔,肝小叶结构欠完整;4级为大多数门静脉区域纤维间隔延伸至邻近门静脉和肝的终末小静脉,肝小叶结构变形,但是没有出现假小叶;5级弥漫性的假小叶形成[4]。
三、试验试剂与仪器设备
CCl4(四氯化碳分析纯)(武汉化学试剂公司);D.Hank′s液(Gibco公司,美国);链蛋白酶E,DNA酶I,Triton X-100,0.05%/5.3 mM胰蛋白酶/EDTA消化液,无Ca2+/Mg2+PBS,Nycodenze干粉,DMSO,MTT,FBS,血清替代物(Knock Out Serum Replacement,KOSR),二甲基亚砜,NP-40,NonidetTM P-40,2 mM Glutamax,20 mM HEPES,SDS,110 mM β-巯基乙醇,Trypsin-EDTA;胎牛血清,明胶(灏洋公司,天津);鼠抗α-SMA单克隆抗体,SABC试剂盒,DAB试剂盒(博士德公司,武汉);紫外分光光度计(岛津UV-2100,日本);光学显微镜、倒置显微镜及荧光显微镜(CH-2,日本);MULTISKAN MK3酶标仪,组织切片机(Thermo公司,德国);硝酸纤维素膜电转移系统,蛋白垂直电泳转膜系统(BioRad公司,美国);Tanon Gis-2010凝胶成像系统(Bio-Rad Doc Gel 2000,美国);Image J图像分析软件(NCBI,美国)。
四、试验方法
1.动物模型建立
将纳入50只实验小鼠随机分为正常对照组10只、HF模型组与SFRP2 shRNA处理组各20只。参照经典[5]的CCl4小鼠肝纤维化模型制备方法:除正常对照组外各受试小鼠腹
2.免疫荧光染色方法
组织标本经4%多聚甲醛室温固定、4℃过夜;冰冻切片机切10 μm厚组织标本;膜通透处理:用5%~10%的山羊/驴血清及5%BSA封闭、兔抗E-cad Ab(Sigma公司,稀释度1∶2 000)和小鼠抗-SMA Ab混合一抗孵育、生物素化的羊抗兔IgG(博士德生物工程公司,武汉,稀释度1∶200)二抗孵育;用LSCM(Bio-Rad MRC-1024,FITC的激发波长为488 nm)观察拍照;用于图象采集的显微镜物镜为Plan-Neofluar 40×油浸镜,数值孔径(NA)为1.3,图象存为512×512相素类型。
3.RT-PCR检测
取大约300 mg肝组织,加入3 mL TRIzol(Invitrogen)提取总RNA,在紫外分光仪下测定RNA含量,根据RNA在A260/280 nm≥1.8及10 g/L琼脂糖凝胶电泳28/18S RNA条带比值≥1.5鉴定RNA纯度和完整性.取2 μg总RNA为模板,参照TaKaRa公司的RNAPCR Kit(AMV)Ver 3.0试剂盒说明书进行RT-PCR。取PCR扩增产物10 μL在15 g/L琼脂糖凝胶(含0.5 g/L溴化乙锭)电泳,用美国Pharmacia Master Image紫外凝胶成像系统进行扫描并用ChmioDox软件分析图像,PCR产物量以吸光度×面积表示,与GAPDH比值表示目的基因的相对含量。进行基因表达水平的半定量分析。
五、稳定表达SFRP2 shRNA的肝细胞的建立
肝细胞中获得总RNA,经RT-PCR转化cDNA,构建pcDNA1.0/SFRP2载体HF肝细胞并克隆获得pSilencer-U6neo/SFRP2 shRNA稳定转染肝细胞,观察SFRP2 shRNA抑制HF作用。
六、统计学分析
全部调查结果及实验数据输入Excel数据库,应用SPSS 17.0软件,计量资料以x±s表示,均数比较两组间采用t检验、多组间比较采用方差分析;计数资料组间频率比较用Fisher双侧确切检验;频率变化趋势用χ2检验。P<0.05为有统计学差异。
结果
一、SFRP2 shRNA抑制HF小鼠肝细胞FSP-1 mRNA、Smad2 mRNA、Wnt3A mRNA的免疫双荧光表达
FSP-1 mRNA在正常肝脏细胞免疫荧光检测(棕色)低表达,其探针在HF肝上皮细胞强信号表达,SFRP2 shRNA感染的杂交小鼠特异性探针显示FSP-1 mRNA弱信号表达。Smad2 mRNA在HF肝细胞大量积聚,特异探针杂交后,在正常肝细胞未能检测,在SFRP2 shRNA感染的杂交小鼠仅发现低水平表达。免疫荧光双标记显示,核pSmad2(深褐色)是伴随着细胞质FSP-1蛋白的表达,而在SFRP2 shRNA感染的杂交小鼠无复染表达(红色),见图1。
二、SFRP2 shRNA抑制HF小鼠肝细胞EMT的免疫荧光表达、Massion染色、RT-PCR及Western blot分析
α-SMA在正常肝脏细胞免疫荧光检测呈低表达状态,其细胞膜(绿色),DAPI染色的细胞核(蓝色),在HF肝上皮细胞强信号表达,而在SFRP2 shRNA感染的杂交小鼠特异性探针显示α-SMA弱信号表达。E-cad在HF肝细胞少量表达,在SFRP2 shRNA感染的杂交小鼠发现高水平表达。Massion染色见SFRP2 shRNA感染的杂交小鼠特异性探针较HF组α-SMA积聚减少。RT-PCR及Western blot分析显示与HF组比较,SFRP2 shRNA感染组α-SMA表达明显减弱(P<0.05),见图2。
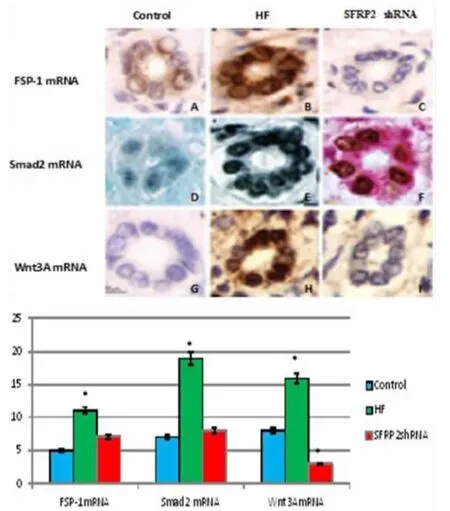
图1 SFRP2 shRNA抑制HF小鼠肝细胞FSP-1 mRNA、Smad2 mRNA、Wnt3A mRNA的免疫双荧光表达及半定量分析[正常对照组(A、D、G);HF组(B、E、H);SFRP2 shRNA感染组(C、F、I);肝细胞FSP-1 mRNA表达(A、B、C);肝细胞Smad2 mRNA表达(D、E、F);肝细胞Wnt3A mRNA表达(G、H、I);比例尺100 μm,*P<0.05]
三、SFRP2 shRNA对HF小鼠肝细胞凋亡的影响
流式细胞仪分析表明,HF组小鼠肝细胞的凋亡率为12.3%,而转染SFRP2 shRNA的小鼠肝细胞的凋亡率为1.1%。揭示SFRP2 shRNA有改善HF小鼠凋亡情况,缓解HF的趋势。
讨论
SFRPs家族根据序列同源性分为3个亚群[6],第1亚群:SFRP1(Frza、Frp、SARP2),SFRP2(SDF5、SARP1),SFRP5(SARP3);第2亚群:SFRP3(Fz、Frzb、Frtiz)和SFRP4;第3亚群:Sizzled、Sizzled2和Crescent。
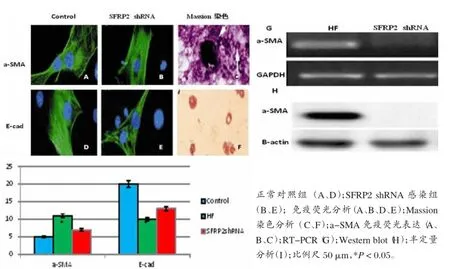
图2 SFRP2 shRNA抑制HF小鼠肝细胞EMT的免疫双荧光表达、RT-PCR、Western blot及半定量分析
SFRP2可能通过结构上有同源性的CRD与Wnt信号的特异性受体Fz竞争性结合,发挥调控Wnt信号通路的作用。当SFRP2启动子发生甲基化进而诱导SFRP2基因沉默,将导致Wnt信号异常表达[7]。本课题组前期实验已经证明了Wnt信号传导机制参与了肝细胞EMT的诱导过程,是HF发生EMT时的主要诱因之一。由于EMT在HF的发展过程中扮演重要角色,阻断甚至逆转EMT可为HF的治疗提供新的思路,通过SFRP2抑制Wnt信号通路,可能成为抗HF的新方法。本课题通过免疫双荧光、RT-PCR及Western blot等方法证明SFRP2可逆转肝脏EMT,从而抑制HF,分析显示SFRP2 shRNA抑制HF小鼠肝上皮细胞标志(FSP-1、α-SMA),增加肝间质细胞标志(E-cad)表达,即逆转EMT,从而减轻HF程度。我们的研究表明SFRP2可以逆转EMT,从而减轻HF程度,其抑制HF机制可能是:①本实验证明SFRP2有抑制Wnt3A通路作用,Wnt3A是Wnt信号通路中CWSP的重要递质,具有激活Wnt信号通路作用。SFRP2可能通过与Wnt3A蛋白相互作用阻止其连接到Fz配体上或与Fz一起形成无功能的复合体,SFRP2还可能通过CRD或NTR和Wnt3A结合,抑制Wnt信号。②有研究[8]显示SFRPs之间有相互作用,形成二聚体,也可能促进Wnt信号。通过本实验可以排除Wnt3A的积极作用。③还有研究[9]显示SFRP2(SARP1)可能通过下调β-cat-TCF/LEF的下游靶基因(LEF1,cyclin D1,MMP-7),抑制Wnt信号,而MMP-7是Smad2通路的重要激活因子,本实验发现SFRP2有抑制Smad2通路作用,支持了以上观点。④本实验流式细胞仪分析表明SFRP2 shRNA有缓解HF小鼠肝细胞凋亡的作用。SFRP可能通过活化NF-κB以及抑制JNK信号发挥其抗凋亡的作用,促进纤维连接蛋白-整合素受体复合体的形成,从而活化黏附斑激酶(FAK)及其下游信号途径PI-3K-Akt抑制细胞凋亡[10]。
本课题组对有关Wnt拮抗剂SERP2及其与HF关系的研究有了新的思路。探讨SFRP2对HF肝细胞凋亡、增殖及分化的调节作用,及对HF肝细胞功能的影响和机制的研究,并对SFRP2参与调控HF过程中EMT的Wnt信号途径进行验证。希望能够初步明确SFRP在HF肝细胞表达的作用及相关机制,为HF的形成和防治提供新的思路。
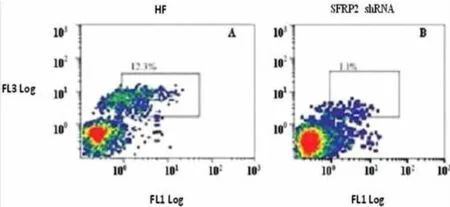
图3 流式细胞仪分析SFRP2 shRNA对HF小鼠肝细胞凋亡的影响(A:HF组;B:SFRP2 shRNA感染组)
1Ehrlund A,Mejhert N,Lorente-Cebrián S,et al.Characterization of the Wnt inhibitors secreted frizzled-related proteins(SFRPs)in human adipose tissue.J Clin Endocrinol Metab,2013,98(3):503-508.
2Kim BK,Yoon SK.Ann Dermatol.Expression of sfrp2 is increased in catagen of hair follicles and inhibits keratinocyte proliferation. Ann Demetol,2014,26(1):79-87.
3Mastri M,Shah Z,Hsieh K,et al.Secreted Frizzled-related protein 2 as a target in antifibrotic therapeutic intervention.Am J Physiol Cell Physiol,2014,306(6):531-539.
4Zeisberg M,Yang C,Martino M,et al.Fibroblasts derive from hepatocytes in liver fibrosis via epithelial to mesenchymal transition.J Biol Chem,2007,282(32):23337-23347.
5Firrincieli D,Boissan M,Chignard N.Epithelial-mesenchymal transition in the liver.Gastroenterol Clin Biol 2010;34(10):523-528.
6Fontenot E,Rossi E,Mumper R,et al.A novel monoclonal antibody to secreted frizzled-related protein 2 inhibits tumor growth.Mol Cancer Ther,2013,12(5):685-695.
7Li X,Lu P,Li B,et al.Effects of iodine-125 seeds on the methylation of SFRP2 and P16 in colorectal cancer.Exp Ther Med,2013,6 (5):1225-1228.
8Saito T,Mitomi H,Imamhasan A,et al.Downregulation of sFRP-2 by epigenetic silencing activates the β-catenin/Wnt signaling pathway in esophageal basaloid squamous cell carcinoma.Virchows Arch,2014,464(2):135-143.
9Xavier CP,Melikova M,Chuman Y,et al.Secreted Frizzled-related protein potentiation versus inhibition of Wnt3a/β-catenin signaling. Cell Signal,2014,26(1):94-101.
10缪成贵,杨剑婷,何华奇,等.白头翁皂苷调控RA模型大鼠FLS SFRP2表达.中国中药杂志,2013,38(12):1977-1981.
(本文编辑:白岚)
10.3961/j.issn.1672-2159.2014.04.021
1 200092同济大学附属同济医院分院消化科;2 200065同济大学附属同济医院普外科;3 200065同济大学附属同济医院消化科;4 200092同济大学医学院干细胞研究中心
杨长青,E-mail:cqyang@tongji.edu.cn腔注射CCl4(四氯化碳分析纯,由武汉化学试剂公司生产)和橄榄油按照2:3比例配成的40%的CCl4油剂(2 mL/kg),每周2次,共12周,复制HF模型。实验期间所有小鼠食用标准饲料。用5 ng/mL SFRP2构建载体并克隆转染肝细胞获得SFRP2 shRNA处理组。
2014-05-28)
