RS4型抗性淀粉对齐口裂腹鱼生长、脂肪代谢及相关基因表达的影响
2014-01-18向世琼邬应龙
向世琼,邬应龙*
(四川农业大学食品学院,四川 雅安 625014)
RS4型抗性淀粉对齐口裂腹鱼生长、脂肪代谢及相关基因表达的影响
向世琼,邬应龙*
(四川农业大学食品学院,四川 雅安 625014)
目的:研究RS4型抗性淀粉对齐口裂腹鱼生长性能、脂肪代谢以及相关基 因表达量的影响。方法:将体质量75 g左右的齐口裂腹鱼随机分为RS4型抗性淀粉添加量为0%(对照组)、3. 5%、7%、14%、28% 5组。饲喂60 d,测定生长性能指标、血脂水平,并采用实时荧光定量聚合酶链式反应技术检测各组肌肉及肝脏中过氧化物酶增殖体激活受体α(peroxisome proliferators activated receptor s-alpha,PPARα)、脂肪酸结合蛋白(fatty acid-binding prot ein,FABP)mRNA表达水平。结果:添加RS4型抗性淀粉剂量为7%和14%时与对照组相比能显著增加齐口裂腹鱼的体质量、摄食率、特定生长率(P<0.05),添加剂量为28%时能够显著增加摄食率,但是对体质量和特定生长率没有显著的影响。添加剂量 到达14%及以上时与对照组相比能够显著降低血脂水平及肌肉中心型脂肪酸结合蛋白(heart-fatty acid-binding protein,H-FABP mRNA)表达水平,且H-FABP与肌内脂肪呈正相关性。添加剂量达7%及以上时能够显著升高肌肉和肝脏中PPARα mRNA表达水平,降低肝脏中FABP mRNA表达水平。结论:适当的添加RS4型抗性淀粉能够促进齐口裂腹鱼的生长、并且调节脂质代谢相关基因的表达,降低了肠系脂肪及肌内脂肪沉积。
抗性淀粉;齐口裂腹鱼;实时荧光定量聚合酶链式反应;过氧化物酶增殖体激活受体α;脂肪酸结合蛋白
齐口裂腹鱼(Schizothorax prenanti Tchang)是我国川西北高原特有冷水性鱼类,属鲤形目, 鲤科,裂腹鱼亚科,裂腹鱼属。其肉质细嫩、味道鲜美,赖氨酸含量极为丰富,可作为赖氨酸的天然强化食品,在我国西部及东北地区的冷水养殖中具有很大的发展潜力和广阔的市场养殖前景[1]。
欧洲抗性淀粉研究协会1993年将抗性淀粉定义为:不被健康人体小肠所吸收的淀粉及其降解产物的总称。根据抗性淀粉产生抗性的原理不同一般将其分为4种,RS4型为其中一种,即通过物理或化学变性后,淀粉分子结构的改变及化学官能团的引入而产生的抗酶解淀粉,如柠檬酸淀粉酯。研究表明,RS4型抗性淀粉作为一种新型的可溶性膳食纤维,能够调节血糖和脂质代谢[2-3]。谭青松[4]研究表明在鱼饵料添加适量的纤维素能够刺激肠道的运动,改善肠道对营养物质的吸收。Shimotoyodome等[5]研究表明RS4型抗性淀粉能够增加肝脏脂肪酸氧化能力及相关基因的表达。它还能增加肠道短链脂肪酸的含量,预防结肠癌等肠道疾病的发生[6-8]。RS4型抗性淀粉对于哺乳动物的调节血糖和脂质代谢的功能在国内外都研究的比较深入,但是其对鱼类的生长、脂质代谢调节作用的研究甚少。本实验主要研究不同剂量RS4型抗性淀粉对齐口裂腹鱼的生长性能的影响,并通过实时荧光定量聚合酶链式反应技术(real time fluorescence quantitative polymerase chain reaction,RT-PCR)检测齐口裂腹鱼脂质代谢相关基因氧化物酶体增殖物激活受体(peroxisome proliferators activated receptors-alpha,PPARα)、脂肪酸结合蛋白(fatty acid-binding protein,FABP)mRNA表达水平,探讨RS4型抗性淀粉对齐口裂腹鱼脂质代谢调节机制,以拓宽抗性淀粉应用范围。
1 材料与方法
1.1 材料与试剂
RS4型抗性淀粉实验室自制[9]。
总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)试剂盒 南京建成生物工程研究所;TRNzol 天根生化科技公司;反转录试剂盒、SYBR®Premix Ex TaqTM日本TaKaRa公司;琼脂糖 西班牙 Spain公司;荧光定量八连板 宝生物工程(大连)有限公司。
1.2 仪器与设备
PTC-150普通PCR仪、ABI7500实时荧光定量PCR仪、HM-I型水平电泳槽、LG9905-060电泳仪 美国Bio-Rad公司;UVP White/Ultraviolet凝胶成像系统 美国UVP公司;微量移液器、Centrifuge 5810R高速低温离心机 德国Eppendorf公司。
1.3 实验动物及管理
1.3.1 实验用鱼
齐口裂腹鱼(Schizothorax prenanti Tchang)为雅安天全县雅鱼场2012年孵化的同一批鱼种。体质量(75.47±5.12)g/尾,体长(16.09±0.73)cm。选择体质健壮的鱼种240尾,用20 mg/L的KMnO4消毒15 min。
1.3.2 饲料及分组
饲料配方参照NRC[10]鱼类营养需要和段彪等[11]的齐口裂腹鱼饲料配方设计基础饲料配方,见表1。

表1 实验饲料的干基组成及营养水平Table 1 Composition and nutrient levels of the experimental diets (on dry basis)
在基础饲料中分别添加0%(对照组)、3.5%、7%、14%、28% RS4型抗性淀粉(等量减少小麦淀粉用量),共5个剂量组,每个剂量组4个重复,每个重复12尾鱼。各种饲料原料均过40目筛,充分混合后加工成1 mm的硬颗粒饲料,烘干并保存于冰箱中,破碎后投喂。
1.3.3 饲养管理
实验鱼饲养于20个玻璃缸中(2.0 m×1.5 m× 1.2 m),水深0.6 m。用基础饲料驯化14 d,待鱼摄食正常后开始实验,日投喂3次,投饵率为体质量2%~2.5%,并根据水温、摄食情况进行调整,各组保持一致的投饲量。养殖实验期间水温16~20℃,溶解氧>5.0 mg/L、NH3-N含量<0.3 mg/L,昼夜充气。
1.4 方法
1.4.1 样品采集
实验结束时,对实验鱼饥饿24 h,尾静脉采血,每尾鱼的血样分别放置在4 ℃静置12 h后,4 ℃、3 000 r/min离心15 min,取其上清液(即血清),-80 ℃保存备用。解剖后迅速取出肝脏及肌肉,放入液氮中,-80 ℃保存备用。
1.4.2 指标计算
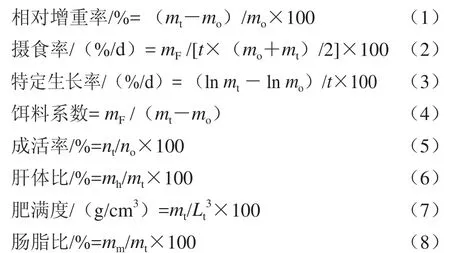
式中:mo为实验开始时鱼体质量/g;mt为实验结束时鱼体质量/g;mh为实验结束时鱼肝脏质量/g;mm为实验结束时鱼肠系膜脂肪质量/g;no为实验开始时鱼的尾数;nt为实验结 束时鱼的尾数;mF为饲料摄入质量/g;t为养殖实验时间/d;Lt为实验结束时鱼的体长/cm。
1.4.3 肌内脂肪含量(intramuscular fat,IMF)测定
取齐口裂腹鱼肌肉组织(n=12),参照GB/T 5009.6—2003《食品中脂肪的测定》采用索氏化学抽提法测定肌肉脂肪含量。
1.4.4 血清脂质含量的测定
按照说明书的方法测定血清中TC、TG、HDL-C、LDL-C含量。极低密度脂蛋白胆固醇(very low density lipoprotein cholesterol,VLDL-C)含量按公式(9)计算。
VLDL-C含量=TC含量-HDL-C含量-LDL-C含量 (9)
1.4.5 引物设计与合成
用Primer Premier 5.0软件根据GenBank中齐口裂腹鱼β-actin基因序列(JQ013000)、PPARα基因序列(KF316324)、FABP基因序列(GU205786)设计特异性引物,引物序列见表2。
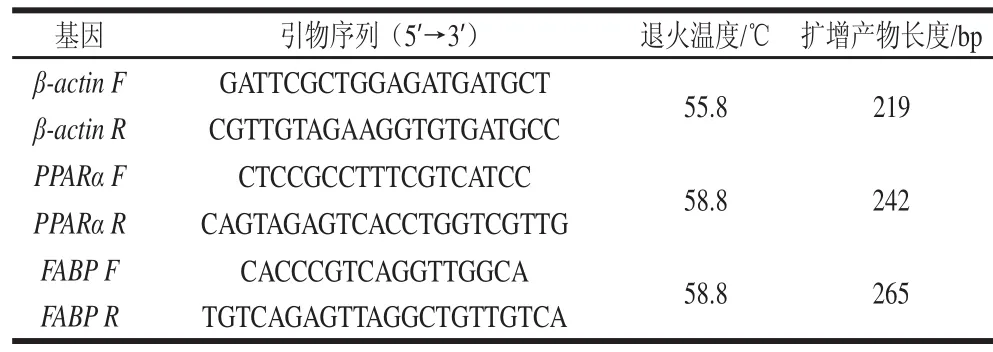
表2 引物序列及退火温度Table 2 Primer sequences and anneal temperatures
1.4.6 总RNA提取和cDNA制备
参照TRNzol总RNA提取试剂盒(TIANGEN)说明书方法提取RNA,用10g/L的琼脂糖凝胶电泳鉴定提取RNA的完整性,通过OD260nm/OD280nm检测样本纯度。
cDNA由逆转录试剂盒法制备,放置于-20 ℃备用。
1.4.7 RT-PCR基因检测
采用SYBRGreen I 荧光染料法,10 μL反应体系,含5 μL SYBR®Premix Ex TaqTM(2×)、上下游引物各0.25 μL、1 μL cDNA、3.5 μL 焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水。RT-PCR步骤:95 ℃、3 min;95 ℃、10 s,各基因相应退火温度条件下退火30 s、39个循环;95 ℃、10 s;扩增完毕后,迅速降温到65 ℃进行溶解曲线分析,然后以0.5 ℃/s的速率从65 ℃递增到95 ℃,连续测定样品荧光强度以获取溶解曲线。
1.4.8 相对表达量的分析
以β-actin基因作为内参基因,选择一校准样本,比较待测样本相对校准样本的表达差异,利用2-ΔΔCt法进行相对定量分析[12]。

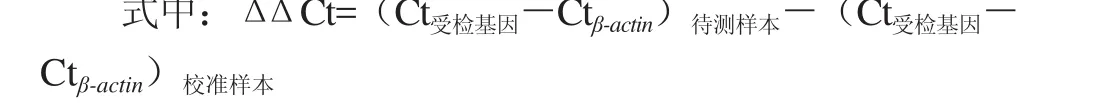
结果是通过参照基因表达水平校正的待测样本中的目标基因相对于校准样本的相对表达量,用参照基因校准目标基因表达来弥补样本组织量的差异。
1.5 统计学分析
2 结果与分析
2.1 RS4型抗性淀粉对齐口裂腹鱼生长及饲料利用率的影响
表3 不同水平的RS4型抗性淀粉对齐口裂腹鱼生长及饲料利用率的影响)Table 3 Effect of RS4 starch at various levels on growth and feed utilization rate of Schizothorax prenanti Tcha

表3 不同水平的RS4型抗性淀粉对齐口裂腹鱼生长及饲料利用率的影响)Table 3 Effect of RS4 starch at various levels on growth and feed utilization rate of Schizothorax prenanti Tcha
注:同行数据肩标不同小写字母表示差异显著(P<0.05)。下同。
项目对照组3.5%RS4剂量组7%RS4剂量组14%RS4剂量组 28%RS4剂量组初体质量/g 75.67±5.2375.25±4.4575.74±5.6876.14±3.6576.52±4.63相对增重率/% 0.27±0.01b0.21±0.02b0.31±0.01a0.31±0.01a0.25±0.02b饵料系数3.51±0.05b3.52±0.02b2.99±0.11c3.10±0.04c3.66±0.05a摄食率/(%/d)1.05±0.08b1.13±0.06b1.47±0.04a1.48±0.03a1.45±0.03a特定生长率/(%/d)0.30±0.02b0.32±0.03b0.46±0.03a0.44±0.04a0.34±0.02b成活率/%100100100100100
由表3可见,RS4型抗性淀粉添加量为7%和14%与其他组相比能显著增加齐口裂腹鱼的体质量(P<0.05),添加量为3.5%和28%对鱼的体质量没有显著的影响;7%RS4剂量组、14%RS4剂量组与对照组相比能显著降低饵料系数(P<0.05),3.5%RS4剂量组与对照组相比无显著的影响,但是28%RS4剂量组与对照组相比显著的增加了饵料系数(P<0.05);当抗性淀粉添加量达到7%及以上时,能显著的增加齐口裂腹鱼的摄食率(P<0.05);7%RS4剂量、14%RS4剂量组与其他组相比能显著提高鱼的特定生长率(P<0.05),3.5%RS4剂量组、28%RS4剂量组与对照组相比对鱼的特定生长率无显著影响。
2.2 RS4型抗性淀粉对齐口裂腹鱼形体指标和内脏指数的影响由表4可知,RS4型抗性淀粉添加量为14%时能够显著降低齐口裂腹鱼的肥满度(P<0.05),其他组对肥满度没有显著影响;添加3.5%的抗性淀粉对齐口裂腹鱼的肠脂比没有显著影响,但随着添加剂量的增加,抗性淀粉组的肠脂比显著降低;添加抗性淀粉对齐口裂腹鱼的肝体比没有显著影响。
表4 不同水平的RS4型抗性淀粉对齐口裂腹鱼形体指标和内脏指数的影响()Table 4 Effect of RS4 starch at various different levels on body parameters and visceral indices of Schizothorax prenanti Tcha

表4 不同水平的RS4型抗性淀粉对齐口裂腹鱼形体指标和内脏指数的影响()Table 4 Effect of RS4 starch at various different levels on body parameters and visceral indices of Schizothorax prenanti Tcha
项目对照组3.5%RS4剂量组7%RS4剂量组14%RS4剂量组 28%RS4剂量组肥满度/(g/cm3)1.61±0.17a1.48±0.09ab1.49±0.17ab1.46±0.06b1.51±0.14ab肠脂比/%1.23±0.31a0.82±0.29ab0.74±0.32b0.71±0.08b0.74±0.15b肝体比/%1.46±0.311.45±0.6131.46±0.251.47±0.461.46±0.05
2.3 RS4型抗性淀粉对齐口裂腹鱼血脂水平的影响
表5 不同水平的RS4型抗性淀粉对齐口裂腹鱼血脂水平的影响Table 5 Effect of RS4 starch at various levels on serum lipid levels of Schizothorax prenanti Tchan

表5 不同水平的RS4型抗性淀粉对齐口裂腹鱼血脂水平的影响Table 5 Effect of RS4 starch at various levels on serum lipid levels of Schizothorax prenanti Tchan
VLDL-C含量/(mmol/L)对照组7.77±0.54a3.39±0.99a3.05±0.28b1.53±0.25a2.96±0.04a3.5%RS4剂量组6.85±0.24ab2.62±0.45ab3.64±0.19ab0.80±0.1b2.13±0.28ab7%RS4剂量组7.10±1.71ab2.68±0.53ab3.56±0.34ab1.23±0.39a2.56±0.11a14%RS4剂量组5.93±0.32b1.90±0.20b3.95±0.67a0.53±0.06b1.46±0.35b28%RS4剂量组5.35±1.01b2.11±0.08b2.93±0.20b0.57±0.16b1.34±0.07b组别TC含量/(mmol/L)TG含量/(mmol/L)HDL-C含量/(mmol/L)LDL-C含量/(mmol/L)
由表5可见,当RS4型抗性淀粉添加量低于7%时对TC、TG、VLDL-C含量无显著影响,但当剂量达到14%及以上时,能够显著降低血清TC、TG、VLDL-C含量(P<0.05);14%RS4剂量组与对照组相比能显著增加HDL-C含量(P<0.05),其他组与对照组相比无显著差异;3.5%RS4、14%RS4、28%RS4剂量组与对照组相比能够显著降低LDL-C含量(P<0.05),7%RS4剂量组与对照组相比无显著影响。
2.4 RS4型抗性淀粉对齐口裂腹鱼IMF的影响

图1 RS4型淀粉对齐口裂腹鱼IMF含量的影响Fig.1 Effect of RS4 starch at various levels on intramuscular fat content
由图1可见,RS4型抗性淀粉添加量小于7%时对齐口裂腹鱼IMF含量没有显著影响,但当剂量达到14%时能够显著降低IMF含量(P<0.05),随着剂量的增高影响越显著。
2.5 RS4型抗性淀粉对齐口裂腹鱼肌肉和肝脏中PPARα及FABP mRNA表达水平的影响
2.5.1 肌肉中PPARα m RNA的表达

图2 肌肉中PARα mRNA表达水平比较Fig.2 PPARα gene expression level in muscle
由图2可见,RS4型抗性淀粉组肌肉中PPARα mRNA表达水平均显著高于对照组(P<0.05),其中RS4组显著高于其他组(P<0.05)。
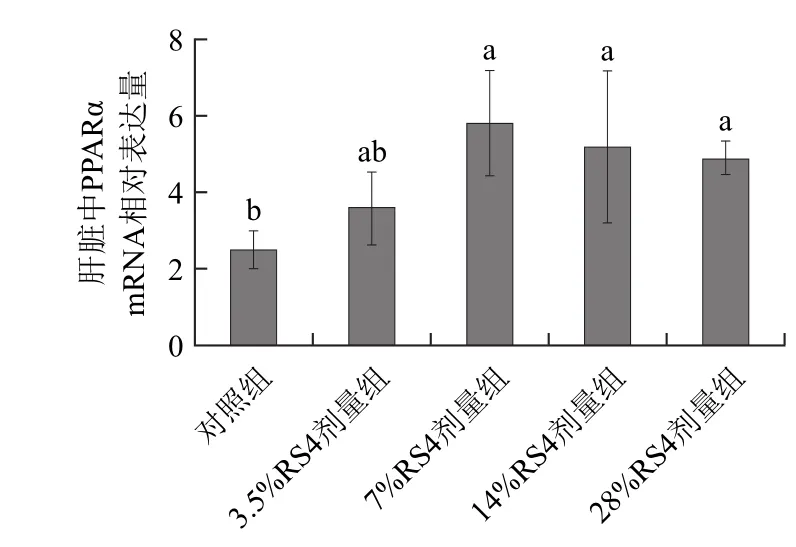
图3 肝脏中PPARα mRNA表达水平比较Fig.3 PPARα gene expression level in liver
2.5.2 肝脏中PPARα mRNA的表达由图3可见,齐口裂腹鱼肝脏中PPARα mRNA表达水平趋势与肌肉中相似,RS4型抗性淀粉组肝脏中PPARα mRNA表达水平均显著高于对照组(P <0.05),与肌肉不同的是14%RS4组与其他抗性淀粉剂量组之间没有显著性差异(P>0.05)。
2.5.3 肌肉中H-FABP mRNA的表达
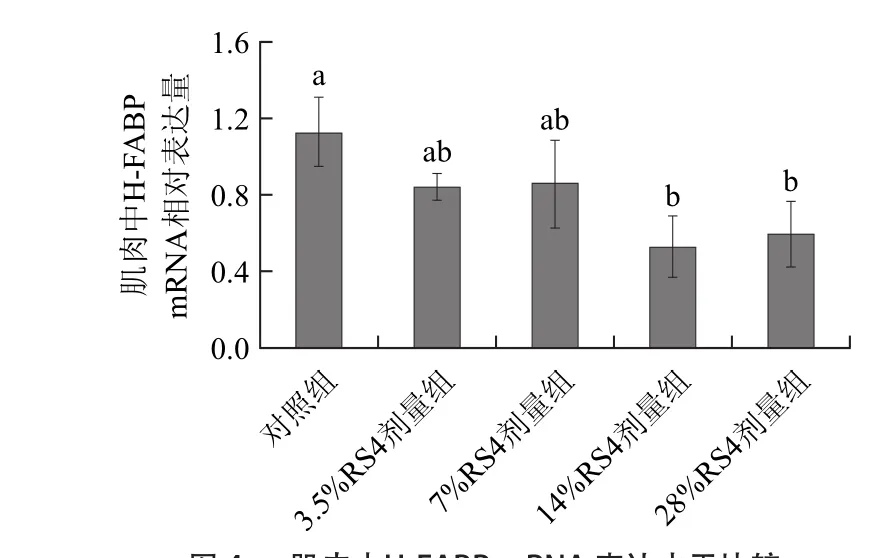
图4 肌肉中H-FABP mRNA 表达水平比较Fig.4 H-FABP gene expression level in muscle
由图4可知,当RS4型抗性淀粉添加剂量达到14%及以上时能够显著降低心型脂肪酸结合蛋白(heart fatty acid-binding protein,H-FABP)mRNA表达水平(P<0.05),添加剂量为3.5%、7%对H-FABP mRNA表达水平没有显著影响(P>0.05)。
2.5.4 肝脏中FABP mRNA的表达

图5 肝脏中FABP mRNA表达水平比较Fig.5 FABP gene expression level in liver
由图5可知,抗性淀粉的剂量为3.5%时对肝脏FABP mRNA表达量与对照组相比无显著影响(P>0.05);当剂量达到7%时能够显著降低肝脏中FABP mRNA表达量(P<0.05),并且随着剂量的增高,影响越显著,降低的趋势与肌肉中的结果一样。
3 讨 论
本实验结果表明,RS4型抗性淀粉能够促进齐口裂腹鱼的体质量增加,并且能够显著提高鱼的摄食率和特定生长率,这可能是由于饲料中含有适量的纤维素刺激肠道的运动加剧,提高了齐口裂腹鱼的摄食并改善了肠道对营养物质的吸收,这与谭青松[4]的研究结果一致,齐口裂腹鱼属于杂食性鱼类,对碳水化合物的利用高于肉食性鱼类。但是当剂量达到28%时饵料系数显著增加,特定生长率与对照组相比却没有影响,表明饲料中过高的抗性淀粉影响了齐口裂腹鱼对营养物质的吸收利用,也就降低饲料的利用率。
本实验中,抗性淀粉添加剂量7%以上能够显著的升高肌肉和肝脏中PPARα mRNA表达水平,与王欣[13]的研究结果一致,PPARα是调节脂肪酸氧化分解代谢的最重要的一种核转录因子,可以调节若干线粒体脂肪酸催化酶的表达,通过诱导肌肉和肝脏特异性的肉毒碱棕榈酰转运酶表达而调控脂肪酸向线粒体的转运[14-15],促进TG的循环,维持体内脂质稳态从而降低了血清中TC、TG的含量,同时本实验齐口裂腹鱼的肠系膜脂肪沉积减少, IMF含量也降低。PPARα会阻碍ApoE基因的表达,使脂蛋白脂酶(lipoprotein lipase,LPL)的活性增强,促进LPL基因表达,导致血中富含TG的脂蛋白,如乳糜微粒和VLDL-C分解代谢加剧,血中TG水平降低,进而引起富含TG的LDL-C水平降低。肝脏中FABP可以调节胆固醇的吸收和代谢,且能影响膜双分子层中胆固醇的移动。新近研究证实L-FABP主要由PPARα来调控。PPARα与L-FABP基因启动子区的过氧化物酶体增殖物反应元件结合,调节其转录[16]。在脂肪代谢中,L-FABP增高,使TC、TG积聚,导致脂质代谢紊乱。本实验结果中,RS添加剂量7%及以上时肝脏中FABP mRNA表达水平下降,在FABP与PPARα的共同调控作用下血清中TC、TG、LDL-C含量也随之下降,与Liu等[17]报道结果一致。但Enes[18]的研究结果瓜儿胶(与RS4一样是属于可溶性非淀粉多糖)不影响白海鲷的血清胆固醇和甘油三酯水平。Kim等[19]也报道了小鼠摄食高RS水平的玉米淀粉,可以降低其肝脏中总脂和胆固醇水平,表明RS的降血脂作用可能是通过干扰肠道胆固醇和胆汁酸的吸收而对其造成影响。本实验研究结果表明当RS剂量达到7%以上时能够降低齐口裂腹鱼血清中TC、TG、LDL-C、VLDL-C水平,并且从基因表达水平上初步解释了可能原因是上调了PPARα mRNA的表达、同时肝脏FABP mRNA表达水平下降,促进了脂肪酸的氧化分解代谢。
H-FABP的mRNA水平与影响肉质性状的肌内脂肪IMF含量有关,可作为 肉质的候选基因[20-22]。本实验结果显示,当RS4型抗性淀粉剂量达到14%及以上时能够显著降低齐口裂腹鱼肌肉中H-FABP mRNA表达水平,与IMF含量变化趋势一致,本研究结果与报道的肌肉中IMF含量与H-FABP呈显著正相关的结果一致[23]。结果表明,添加适当剂量的RS4型抗性淀粉不仅能够调节哺乳动物的脂质代谢,同样能够调节齐口裂腹鱼的脂质代谢,鱼的特定生长率及摄食率显著提高,肠系膜脂肪和肌内脂肪却减少,表明更多的脂肪不是用于储存而是用作能量消耗,使一部分本应供能的蛋白质用于生长,从而提高了齐口裂腹鱼的生长性能,降低了鱼体脂肪沉积。
[1] 李瑞文, 林亚秋, 郑玉才, 等. 齐口裂腹鱼PGC-1α基因编码区的克隆及其在肌肉组织中的表达[J]. 生物技术通讯, 2013, 24(1): 72-75.
[2] SAJILATA M G, SINGHAL R S, KULKARNI P R. Resistant starch: a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2006, 5: 1-17.
[3] LEE K Y, YOO S H, LEE H G. The effect of chemically-modified resistant starch, RS type-4, on body weight and blood lipid profiles of high fat diet-induced obese mice[J]. Starch- Stärke, 2012, 64(1): 78-85.
[4] 谭青松. 饲料中不同来源淀粉对异育银鲫和长吻鮠生长和代谢的影响[D]. 武汉: 中国科学院研究生院, 2005.
[5] SHIMOTOYODOME A, SUZUKI J, FUKUOKA D, et al. RS4-type resistant starch prevents high-fat diet-induced obesity via increased hepatic fatty acid oxidation and decreased postprandial GIP in C57BL/6J mice[J]. American Journal of Physiology, 2010, 298: 652-662.
[6] SUZUKI T, YOSHIDA S, HARA H. Physiological concentrations of short-chain fatty acids immediately suppress colonic epithelial permeability[J]. British Journal of Nutrition, 2008, 100(2): 297-305.
[7] RICHARD K L, HU Ying. Effects of resistant starch on genotoxininduced apoptosis, colonic epithelium, and luminal contents in rats [J]. Carcinogenesis, 2003, 24(8): 1347-1352.
[8] RICHARD K L, HU Ying. A synbiotic combination of resistant starch and Bifidobacterium lactis facilitates apoptotic deletion of carcinogendamaged cells in rat colon[J].The Journal of Nutrition, 2005, 135(5): 996-1001.
[9] 王步枢, 邬应龙. 柠檬酸甘薯淀粉酯制备工艺优化及性质研究[J].食品科学, 2012, 33(24): 86-91.
[10] NRC (National Research Council). Nutrient requirement of fish[M]. Washington, DC: National Academy Press, 1993.
[11] 段彪, 向枭, 周兴华, 等. 齐口裂腹鱼饲料中适宜脂肪需要量的研究[J].动物营养学报, 2007(3): 232-236.
[12] PFAFFL M W. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Research, 2001, 29(9): 41-45.
[13] 王欣. RS4型甘薯抗性淀粉对高脂饮食小鼠炎症因子及PPARα mRNA表达的影响[D]. 雅安: 四川农业大学, 2013: 21-32.
[14] MICHUNG Y. PPARα in obesity: sex difference and estrogen involvement[J]. PPAR Research, 2010, 10: 1155-1171.
[15] MANDARD S, MÜLLAR M, KERSTEN S. Peroxisome proliferatoractivated receptors-alpha target genes[J]. Cellular and Molecular Life Sciences, 2004, 61: 393-416.
[16] ATSHAVES B P, MARTIN G G, HOSTETLER H A, et al. Liver fatty acid-binding protein and obesity[J]. The Journal of Nutritional Biochemistry, 2010, 21(11): 1015-1032.
[17] LIU X, OGAWA H, KISHIDA T, et al. Hypolipidaemic effect of maize starch with different amylose content in ovariectomized rats depends on intake amount of resistant starch[J]. British Journal of Nutrition, 2009, 101(3): 328-339.
[18] ENES P, POUSAO-FERREIRA C, SALMERON, et al. Effect of guar gum on glucose and lipid metabolism in white sea bream Diplodus sargus[J]. Fish Physiology and Biochemistr y, 2013, 39(2): 159-169.
[19] KIM W K, CHUNG M K, KANG N E, et al. Effect of resistant starch from corn or rice on glucose control, colonic events, and blood lipid concentrations in streptozotocin-induced diabetic rats[J]. The Journal of Nutritional Biochemistry, 2003, 14(3): 166-172.
[20] MICHAL J J, ZHANG Z W, GASKINS C T, et al. The bovine fatty acid binding protein 4 gene is significantly associated with marbing and subcutaneous fat depth in Wayu×Limousin F2 crosser[J]. Animal Genetics, 2006, 37(4): 400-402.
[21] YE M H,CHEN J L, ZHAO G P, et al. Associations of A-FABP and H-FABP markers with the content of intramuscular fat in Beijing-you chicken[J]. Animal Biotechnology, 2010, 21(1): 14-24.
[22] LEE S H, CHOI Y M, CHOE J H, et al. Association between polymorphisms o f the heart fatty acid binding protein gene and intemuscular fat content, fatty acid composition, and meat quality in Berkshire breed[J]. Meat Science, 2010, 86(3): 794-800.
[23] 林亚秋, 李瑞文, 郑玉才, 等. 齐口裂腹鱼和鲤鱼H-FABP基因的克隆及其表达谱[J]. 中国生物化学与分子生物学报, 2012, 27(6): 554-560.
Effect of RS4-Type Resistant Starch on Growth Performance, Lipid Metabolism and Related Gene Expression in Schizothorax prenanti Tchang
XIANG Shi-qiong, WU Ying-long*
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
Obje ctive: To explore the effect of RS4-type resistant starch on growth performance, lipid metabolism and related gene expression in Schizothorax prenanti Tchang. Methods: Schizothorax prenanti Tchang weighed about 75 g were randomly div ided into five groups which were fed RS 4-type resistant starch at doses of 0 (control), 3.5%, 7%, 14% an d 28%, respectively. After 60 days of administration, the growth performance and serum lipid levels were measured; meanwhile, peroxisome proliferators activated receptors-alpha (PPARα) and fatty acid-binding protein (FABP mRNA) expression levels in muscle and liver were determined by RT-PCR. Results: The body weight, feed intake and specific growth ratio of Schizothorax prenanti Tchang were significantly higher in the 7% and the 14% resistant starch groups than in the control group (P < 0.05). Feed intake was significantly increased at the dose of 28%, but neither body weight nor specific growth ratio was significantly affected. The 14% resistant starch group showed significant reduced levels of blood lipids and heartfatty acid-binding protein (H-FABP) mRNA expression when compared to the control group, and a positive correlation existed between H-FABP mRNA expression and intramuscular fat (IMF) content. When the dose was as high as 7% or above, we observed a signifi cant increase in PPARα mRNA expression levels in muscle and liver but a significant decrease in FABP mRNA expression level in liver. Conclusion: Dietary supplementation with the appropriate amount of RS4-type resistant starch can promote the growth of Schizothorax prenanti Tchang, regulate lipid metabolism-related genes, and reduce the accumulation of mesenteric fat and intramuscular fat.
RS4-type resistant starch; Schizothorax prenanti Tchang; real time fluorescence quantitative polymerase chain reaction (RT-PCR); peroxisome proliferators activated receptors-alpha (PPARα); fatty acid-binding protein (FABP)
TS254.1
A
1002-6630(2014)07-0223-06
10.7506/spkx1002-6630-201407044
2013-07-18
四川省科技支撑计划项目(2009NZ0077-007);四川农业大学“211”工程双支计划项目(2010)
向世琼(1989—),女,硕士研究生,研究方向为功能性食品。E-mail:xiangshiqiong@163.com
*通信作者:邬应龙(1963—),男,教授,博士,研究方向为功能性食品。E-mail:wuyinglong99@163.com
