固相萃取-超高效液相色谱法快速检测辣椒面中刚果红
2014-01-17钟慈平王正虹胡黎黎顾万江唐小琴
钟慈平,魏 炜,王正虹,邱 宏,胡黎黎,顾万江,甘 源,唐小琴,李 林*
(1.西南大学食品科学学院,重庆 400716;2.重庆市疾病预防控制中心,重庆 400042;3.西南大学校医院,重庆 400716)
固相萃取-超高效液相色谱法快速检测辣椒面中刚果红
钟慈平1,魏 炜1,王正虹2,邱 宏2,胡黎黎2,顾万江2,甘 源2,唐小琴2,李 林3,*
(1.西南大学食品科学学院,重庆 400716;2.重庆市疾病预防控制中心,重庆 400042;3.西南大学校医院,重庆 400716)
目的:建立测定辣椒面中刚果红染料含量的超高效液相色谱方法。方法:采用氨水-乙醇(30:70,V/V)提取剂,超声加热辅助提取3 次,合并提取液、浓缩后过HLB固相萃取小柱,以5 mL 1%甲酸-甲醇溶液淋洗、5 mL 10%氨水-甲醇溶液洗脱,收集洗脱液、氮吹浓缩后定容测定。使用BEH C18色谱柱(50 mm×2.1 mm,1.7 μm);流动相:A为乙腈,B为10 mmol/L乙酸铵溶液,梯度洗脱;流速0.4 mL/min;检测波长498 nm;柱温40 ℃。结果:回收率为72%~96%,方法检出限为0.029 0 mg/kg,相对标准偏差为2.16%~5.97%(n=6),线性方程相关系数达到0.999 9。结论:本方法简便、快速、准确、灵敏,适用辣椒面中刚果红染料含量的测定。
超高压液相色谱;辣椒面;刚果红;含量测定
刚果红又名直接大红4B,由联苯胺双重氮化、与1-氨基萘-4-磺酸偶合而成,属于典型的直接偶氮染料。分子式为C32H22N6Na2O6S2,相对分子质量为696.67。棕红色粉末,溶于水呈黄红色,溶于乙醇呈橙色,几乎不溶于乙醚[1-2]。刚果红一般用作医学临床诊断、生物染色剂及化学指示剂等[3-4]。研究发现其具有一定致癌性,欧盟等国家严格禁止其在食品中使用[5-8]。近年来食品安全事件频发,尤其是非法添加物甚至是有毒物质不断被检出。染料由于着色力强、坚牢度大且价格低廉而被一些不法商家大量使用,“苏丹红事件”以及国内的“火锅罗丹明事件”等层出不穷。GB 2760—2011《食品添加剂使用标准》中明确规定食品中禁止添加工业染料[9],由于苏丹红、罗丹明B、碱性橙这几类染料的检测方法已比较成熟,商贩可能开始转移使用其他红色类染料,其中,刚果红价格便宜、着色效果优秀、使用比较广泛,因此有必要建立一种灵敏、准确、快速的检测食品中非法添加刚果红染料的方法。
关于纺织物和印染废水中刚果红的检测已有研究[10-13],但基于食品基质的研究鲜有报道。目前,食品中工业染料的检测方法主要是液相色谱法[14-16]和液相色谱-质谱联用法[17-19],其中普通高效液相色谱法研究较多,但耗时较长、精确度不高;而超高效液相色谱具有快速高效、高分离度等特点,目前逐渐用于食品药品等分析检测中[20]。由于食品基质复杂,样品的净化富集必不可少,一般采用固相萃取、液-液萃取、凝胶净化等方法[21-22]。本研究采用氨化乙醇作为提取剂,超声加热辅助提取,以HLB固相萃取小柱对样品进行净化,建立了对染料具有较大吸附的辣椒面中刚果红超高效液相色谱检测的方法。
1 材料与方法
1.1 材料与试剂
辣椒面购自某市大型超市、批发市场、农贸市场等;刚果红(纯度95%) 中国上海试剂三厂;甲醇、乙腈(色谱纯) 德国Merck公司;氨水、无水乙醇、乙酸铵、甲酸(均为分析纯) 重庆川东化工有限公司。
1.2 仪器与设备
AcquityTMUPLC液相色谱仪(配有AcquityTM型TUV检测器)、Acquity UPLC BEH C18柱、Oasis HLB萃取柱(6 mL/2 00 mg)、Sep-pak NH2氨基柱(3 mL/500 mg)、MCX萃取柱(6 mL/200 mg)、WAX萃取柱(6 mL/200 mg) 美国Waters公司;AR1140电子天平 北京赛多利斯仪器公司;KQ-500E超声波清洗器 江苏昆山超声仪器公司;Milli-Q超纯水设备 美国Millipore公司;Multifugc X1R高速离心机 安徽科大创新股份公司;TU-1950紫外-可见分光光度计 北京普析通用仪器有限责任公司;N-EVAP-45氮吹仪 美国Organomation Associates公司;HWS28型恒温水浴锅 上海一恒科技公司;Cleanert PA聚酰胺萃取柱(100~200目,1 g/6 mL) 天津博纳艾杰尔科技有限公司;PSA萃取柱(1 000 mg/6 mL) 杭州富裕科技服务公司。
1.3 方法
1.3.1 色谱条件
色谱柱:Acquity UPL CBEHC18柱(50 mm×2.1 mm,1.7 μm);流动相:A为乙腈,B为10 mmol/L乙酸铵溶液,梯度洗脱;流速0.4 mL/min;柱温40 ℃;检测波长498 nm;进样量5.0 μL。以保留时间结合光谱扫描图定性,采用外标法定量。
1.3.2 标准曲线的绘制
准确称取刚果红标准品0.100 0 g,用50%乙腈溶液溶解并定容至100 mL容量瓶中,配成1 000 μg/mL的标准品储备液备用。采用逐级稀释方法,用空白基质提取液和体积分数10%的乙腈溶液将标准品储备液配制成质量浓度为0.2、0.5、1、2、4 μg/mL的标准品系列。
1.3.3 超声提取
称取2.000 0 g左右辣椒面于50 mL离心管中,加入20 mL石油醚除脂2 次,挥干石油醚后加入氨化乙醇提取液25 mL,振荡提取15 min,65 ℃条件下超声处理20~30 min,以4 000 r/min离心8 min,收集上清液于100 mL烧杯中,残渣继续以15 mL提取液重复提取2 次,合并上清液。80 ℃水浴蒸发至10 mL以下(不得挥干),用50%乙腈溶液(含1%甲酸)溶解并转移至比色管中定容。
1.3.4 样品净化
取1.0 mL样品提取液,过HLB固相萃取柱(事先以6 mL甲醇、6 mL纯水活化,6 mL pH 4的柠檬酸平衡),以5 mL pH 4的柠檬酸淋洗1 次、5 mL 1%甲酸-甲醇溶液淋洗、水洗至中性,以5 mL 10%氨水-甲醇溶液洗脱,收集洗脱液,45 ℃条件下氮气吹至近干,用50%乙腈溶液稀释定容至10 mL,过0.22 μm滤膜后采用超高效液相色谱测定。
2 结果与分析
2.1 色谱条件的选择
2.1.1 检测波长的选择
对刚果红标准物质(10 μg/mL)进行紫外-可见扫描(图1),发现刚果红在236 nm和498 nm波长附近具有较大吸收峰,由于在236 nm附近有较强的杂质干扰,故可选择498 nm作为定量检测波长。
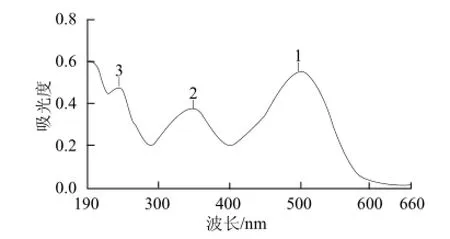
图1 刚果红的光谱扫描图Fig.1 Absorption spectrum of Congo red
2.1.2 柱温和流动相的选择
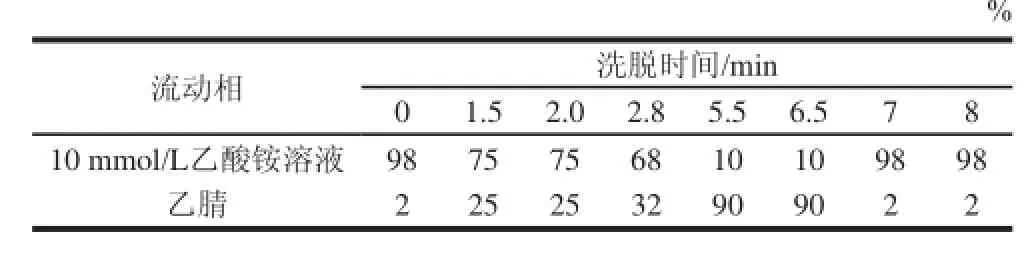
表1 流动相洗脱程序Table1 Gradient elution program
比较了不同流动相的分离效果,当甲醇-乙酸铵作为流动相时,分离度没有乙腈-乙酸铵好,且存在基线干扰,因此选择乙腈-乙酸铵作为流动相。由于超高压液相色谱仪出峰比较快且干扰物出峰时间比较接近,需采用梯度洗脱的方式进行分离,经优化的梯度洗脱条件如表1所示。将混标溶液(刚果红与赤藓红、诱惑红、胭脂红、红2G、日落黄、柠檬黄、直接红Ⅱ)按照表1的梯度条件在40 ℃柱温条件下进样分析,发现目标物与干扰物质全部在4 min内出峰,各峰之间分离度高且峰形良好(图2),在目标物出峰位置没有干扰峰,表明色谱条件能满足分析要求。
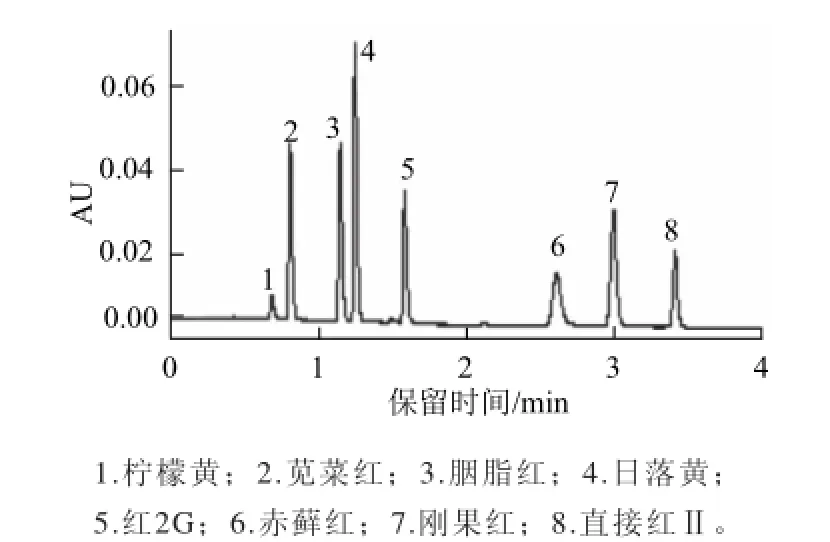
图2 8种合成色素和直接红染料超高效液相色谱图(4 μg/mL)Fig.2 UPLC chromatogram of mixed standard solution of eight synthetic colorants and Direct Red dye (4 μg/mL)
2.2 提取条件的选择
2.2.1 提取剂的选择
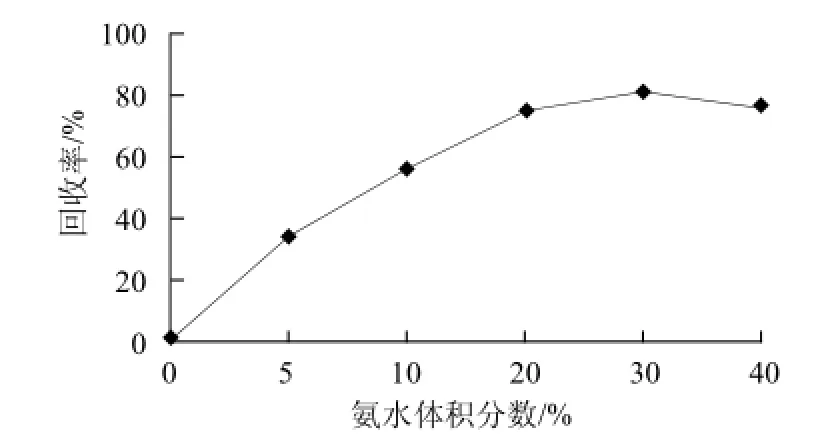
图3 氨水体积分数对辣椒面中刚果红提取回收率的影响Fig.3 Effect of ammonia concentration (by volume) on the recovery of Congo red from chili powder
以不含刚果红染料辣椒面作为基质,加入标准物质,比较甲醇、无水乙醇、乙腈、丙酮、50%甲醇溶液、50%乙腈溶液、正己烷-乙腈(1:1)等提取剂的超声提取效果,提取浓缩液于15 000 r/min高速离心后过滤膜,进行检测。结果表明,提取回收率都很低,不能满足实验要求。参考 文献[23-25],选择氨化甲醇、氨化乙醇和氨化乙腈(氨水体积分数均为20%)作为提取剂,发现回收率均有所提高,其中氨化乙醇的回收率最高。因此考察了不同体积分数的乙醇氨水提取2次的回收率(图3)。
由图3可知,随着氨化乙醇中氨水体积分数的增加,回收率呈上升趋势。当氨水体积分数达到30%~40%时,回收率达到最大且趋于稳定。但进一步提高氨水体积分数,刚果红回收率有所下降。考虑提取试剂成本和对环境的污染等因素,最终采用30%氨水的乙醇作为提取剂。
2.2.2 超声温度的选择
采用氨水体积分数为30%的氨化乙醇对加标辣椒面超声提取2次,比较了常温(25~30℃)和65℃条件下的回收率。结果发现超声温度提高至65℃时,回收率达到90.62%,明显高于同条件下常温超声提取的效果(图4)。
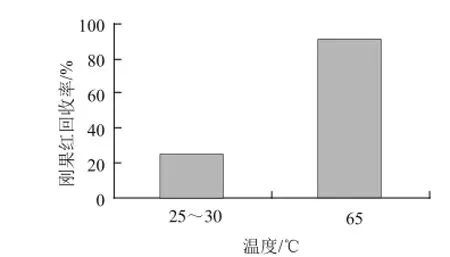
图4 超声温度对辣椒面中刚果红回收率的影响Fig.4 Effects of extraction temperature on the recovery of Congo red from chili powder
2.2.3 超声提取次数的选择
在65℃条件下,氨水体积分数为30%的氨化乙醇作为提取剂,考察不同超声次数对辣椒面中刚果红染料的提取效果。
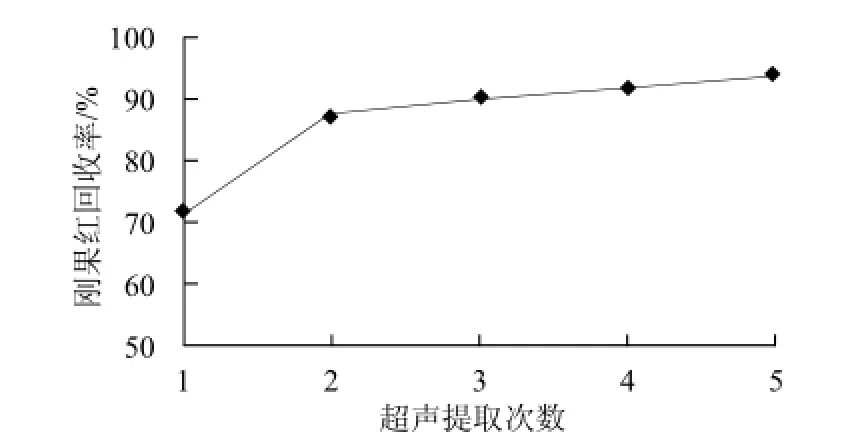
图5 超声提取次数对辣椒面中提取刚果红回收率的影响Fig.5 Effect of number of extraction cycles on the recovery of Congo red from chili powder
由图5可知,随着提取次数的增加,刚果红回收率呈上升趋势,提取3~5次时,回收率达到90%以上且提高幅度较小,趋于稳定。因此,可选择3次超声提取辣椒面中的刚果红。
2.3 净化条件的选择
由于食品样品基质比较复杂,提取液高速离心后直接进样分析,杂峰较多,基质成分干扰很大且很容易堵塞液相分离柱。因此参考文献[26-28]并结合实验室条件分别选取了Agela聚酰胺柱、HLB柱、WAX柱、MCX柱、Sep-pak NH2氨基柱、PSA柱作为萃取柱,考察净化效果。实验发现,酸性条件下刚果红在HLB柱、Sep-pak NH2氨基柱和PSA柱上吸附很好,碱性条件下可顺利洗脱,回收率都达到96%以上。但HLB柱对杂质的洗脱能力最强,因此可选择HLB小柱对样品进行萃取。
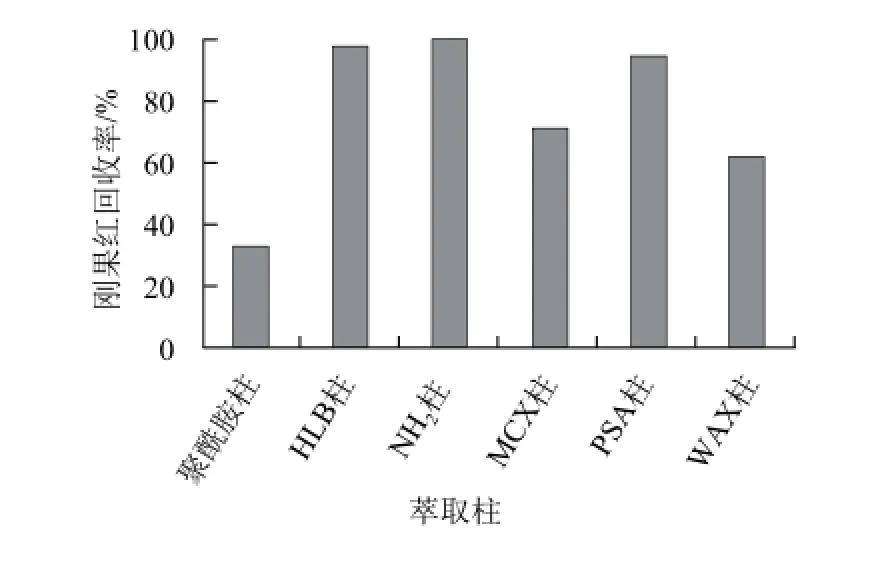
图6 不同萃取柱对辣椒面中提取刚果红回收率的影响Fig.6 Effect of different extraction columns on the recovery of Congo red from chili powder
2.4 标准曲线方程和检出限
按照2.1.2节的色谱条件进样分析,以标准品质量浓度为横坐标(X)、其相应的峰面积作为纵坐标(Y)进行线性回归得到回归方程:Y=34 213.07X+46.31,相关系数为0.999 9,刚果红在0.2~4 μg/mL范围内与峰面积呈良好线性关系。仪器检出限为0.006 μg/mL,该方法的检出限为0.029 0 mg/kg。
2.5 方法的回收率、精密度和重复性

表2 刚果红在辣椒面中的回收率和相对标准偏差(n=6)Table2 Average recoveries and RSD of Congo red from spiked chili samples (n=6)
选取不含刚果红的辣椒粉作为基质,对刚果红染料进行加标回收率实验,结果见表2。每一添加水平平行测定6次,取平均值,考察方法的回收率和精密度,同时做样品空白实验。结果表明,在10 mg/kg和20 mg/kg添加水平条件下刚果红的回收率较高,相对标准偏差满足实验求。而加标质量浓度为2 g/kg时,回收率只有72%,相对较低,主要原因可能是由于辣椒基质对样品的吸附造成的。
2.6 实际样品测定
对采自某市大型超市、批发市场、农贸市场等的20份辣椒面样品进行检测,结果均未检测出刚果红染料。
3 结 论
本研究以对染料具有较强吸附作用的辣椒面作为基质,采用氨水体积分数为30%的氨化乙醇提取剂,65℃超声提取3次,HLB萃取小柱净化样品。采用超高效液相色谱测定,选择498 nm作为检测波长,乙腈-乙酸铵溶液作为流动相,柱温40℃,方法的回收率达到72%~96%,相对标准偏差为2.16%~5.97%(n=6),检出限为0.029 0 mg/kg,线性方程相关系数达到0.999 9。刚果红在4 min内出峰并与杂质峰分离度良好。该法具有较高精确度和准确度,检出限低,能满足实验检测要求,可快速、准确地检测出辣椒面中的刚果红染料。同时也可用于食品安全风险评估,为国家制定相关标准提供了一定的理论依据和实验数据。
[1] 杨新玮, 罗钰言, 肖刚, 等. 染料[M]. 4版. 北京: 化学工业出版社, 2005: 294.
[2] 贺锋萍, 侍芳, 潘碌亭. 液相色谱/质谱联用检测刚果红及其微电解降解的研究[J]. 环境污染与防治, 2011, 33(4): 71-73.
[3] LORENZO A, YANKNER B A. β-amyloid neurotoxicity requires fi bril formation and is inhibited by congo red[J]. Proceedings of the National Academy of Sciences, 1994, 91(25): 12243-12247.
[4] JALANDONI-BUAN A C, DECENA-SOLIVEN A A, CAO E P, et al. Characterization and identifi cation of Congo red decolorizing bacteria from mo nocultures and consortia[J]. Philippine Journal of Science, 2010, 139(1): 71-78.
[5] RAMSAY J A, NGUYEN T. Decoloration of textile dyes by Trametes versicolor and its effect on dye toxicity[J]. Biotechnology Letters, 2002, 24(21): 1757-1761.
[6] GRAY L E, Jr, OSTBY J S, KAVLOCK R J, et al. Gonadal effects of fetal exposure to the azo dye congo red in mice: infertility in female but not male offspring[J]. Fundamental and Applied Toxicology, 1992, 19(3): 411-422.
[7] BAFANA A, JAIN M, AGRAWAL G, et al. Bacterial reduction in genotoxicity of Direct Red 28 dye[J]. Chemosphere, 2009, 74(10): 1404-1406.
[8] European Commission. Review the toxicology of a number of dyes illegally present in food in the EU[J]. The EFSA Journal, 2005, 263: 1-71.
[9] 卫生部. GB 2760—2011 食品添加剂使用标准[S]. 北京: 中国标准出版社, 2011.
[10] DIN M I, HUSSAIN Z, MIRZA M L, et al. Biosorption of toxic congo red dye from aqueous solution by eco-friendly biosorbent Saccharum bengalense: kinetics and thermodynamics[J]. Desalination and Water Treatment, 2013, 51(28): 1-11.
[11] GOPINATH K P, MUTHUKUMAR K, VELAN M. Sonochemicaldegradation of Congo red: optimization through response surface methodology[J]. Chemical Engineering Journal, 2010, 157(2): 427-433.
[12] KHADHRAOUI M, TRABELSI H, KSIBI M, et al. Discoloration and detoxicifi cation of a Congo red dye solution by means of ozone treatment for a possible water reuse[J]. Journal of Hazardous Materials, 2009, 161(2): 974-981.
[13] MITTAL A, THAKUR V, MITTAL J, et al. Process development for the removal of hazardous anionic azo dye Congo red from wastewater by using hen feather as potential adsorbent[J]. Desalination and Water Treatment, 2014, 52(1): 227-237.
[14] QI P, ZENG T, WEN Z, et al. Interference-free simultaneous determination of Sudan dyes in chili foods using solid phase extraction coupled with HPLC-DAD[J]. Food Chemistry, 2011, 125(4): 1462-1467.
[15] DIXIT S, KHANNA S K, DAS M. A simple method for simultaneous determination of basic dyes encountered in food preparations by reversed-phase HPLC[J]. Journal of AOAC International, 2011, 94(6): 1874-1881.
[16] ZACHARIS C K, KIKA F S, TZANAVARAS P D, et al. Development and validation of a rapid HPLC method for the determination of fi ve banned fat-soluble colorants in spices using a narrow-bore monolithic column[J]. Talanta, 2011, 84(2): 480-486.
[17] HOU X, LI Y, CAO S, et al. Analysis of para red and Sudan dyes in egg yolk by UPLC-MS-MS[J]. Chromatographia, 2010, 71(1/2): 135-138.
[18] LI C, WU Y L, SHEN J Z. UPLC-ESI-MS/MS analysis of Sudan dyes and Para Red in food[J]. Food Additives and Contaminants, 2010, 27(9): 1215-1220.
[19] SCHUMMER C, SASSEL J, BONENBERGER P, et al. Low-level detections of Sudan Ⅰ, Ⅱ, Ⅲ and Ⅳ in spices and chili-containing foodstuffs using UPLC-ESI-MS/MS[J]. Journal of Agricultural and Food Chemistry, 2013, 61(9): 2284-2289.
[20] DADÁKOVÁ E, KŘÍŽEK M, PELIKÁNOVÁ T. Determination of biogenic amines in foods using ultra-performance liquid chromatography (UPLC)[J]. Food Chemistry, 2009, 116(1): 365-370.
[21] SUN H, WANG L, AI L, et al. A sensitive and validated method for determination of melamine residue in liquid milk by reversed phase high-performance liquid chromatography with solid-phase extraction[J]. Food Control, 2010, 21(5): 686-691.
[22] 赵珊, 张晶, 丁晓静, 等. 凝胶净化/超高效液相色谱电喷雾质谱法检测调味油中11种禁用偶氮染料及罗丹明B[J]. 分析测试学报, 2012, 31(4): 448-452.
[23] 曾泳艇, 黎永乐, 张协光. 固相萃取. 超高效液相串联质谱法同时测定食品中红色2G、酸性大红、酸性橙Ⅱ和酸性金黄G[J]. 广东化工, 2012, 39(3): 151-160.
[24] 刘艳琴, 王浩, 杨红梅, 等. 固相萃取-高效液相色谱法同时测定食品中9 种人工合成色素[J]. 粮油加工, 2010, 40(12): 168-171.
[25] 刘艳琴, 王浩, 杨红梅, 等. 固相萃取-HPLC 法同时测定糕点中8种人工合成色素[J]. 食品研究与开发, 2010, 31(2): 139-142.
[26] 曹鹏, 乔旭光, 娄喜山, 等. 固相萃取结合超高效液相色谱-串联质谱法同时检测食品中的6 种工业染料[J]. 分析化学, 2011, 39(11): 1670-1675.
[27] 奚星林, 邵仕萍, 徐娟, 等. 固相萃取-高效液相色谱法同时测定食品中12 种合成色素[J]. 中国食品卫生杂志, 2012, 24(3): 217-222.
[28] SUN H, SUN N, LI H, et al. Development of multiresidue analysis for 21 synthetic colorants in meat by microwave-assisted extractionsolid-phase extraction-reversed-phase ultrahigh performance liquid chromatography[J]. Food Analytical Methods, 2013, 6(5): 1291-1299.
Determination of Congo Red in Chili Powder by Solid Phase Extraction Coupled with Ultra-High Performance Liquid Chromatography
ZHONG Ci-ping1, WEI Wei1, WANG Zheng-hong2, QIU Hong2, HU Li-li2, GU Wan-jiang2, GAN Yuan2, TANG Xiao-qin2, LI Lin3,*
(1. College of Food Science, Southwest University, Chongqing 400716, China; 2. Chongqing Center for Disease Control and Prevention, Chongqing 400042, China; 3. Hospital of Southwest University, Chongqing 400716, China)
Objective: To establish a method for determining Congo red in chili powder by ultra-high performance liquid chromatography (UPLC). Methods: Samples were extracted with a mixture of ammonia and ethanol (30:70, V/V). The extraction process was aided by ultrasonic treatment and repeated three times. The combined extract was concentrated and then clean-up on an HLB solid-phase extraction cartridge by washing with 5 mL of 1% formic acid in methanol and elution with 5 mL of 10% ammonia in methanol. The collected eluate was concentrated under a stream of nitrogen prior to analysis. The chromatographic separation was achieved within 4 min on a BEH C18column (50 mm×2.1 mm, 1.7 μm) by gradient elution using acetonitrile as mobile phase A and 10 mmol/L ammonium acetate as mobile phase B at a fl ow rate of 0.4 mL/min. The detection wavelength was set at 498 nm and the column temperature was maintained at 40 ℃. Results: Average recoveries of Congo red from chili samples spiked three concentration levels ranged from 72% to 96% with relative standard deviation of 2.16%–5.97% (n = 6). The detection limit of the proposed method was 0.029 0 mg/kg, and the correlation coeffi cient for the calibration curve was 0.999 9. Conclusion: This method is simple, rapid, accurate, sensitive and suitable for detecting Congo red dye in chili powder.
ultra-high performance liquid chromatography (UPLC); chili powder; Congo red; quantitative determination
TQ613.12
A
1002-6630(2014)10-0195-05
10.7506/spkx1002-6630-201410037
2013-07-10
钟慈平(1990—),男,硕士研究生,研究方向为食品安全与质量控制。E-mail:zcp772@163.com
*通信作者:李林(1957—),男,教授,主任医师,研究方向为食品营养与卫生。E-mail:lilinlqc@163.com
