贮藏温度对哈密瓜蔗糖代谢途径中14种酶活性的影响
2014-01-17蔡修臻庞广昌
蔡修臻,庞广昌*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
贮藏温度对哈密瓜蔗糖代谢途径中14种酶活性的影响
蔡修臻,庞广昌*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
为了系统研究哈密瓜在不同贮藏温度条件下的蔗糖积累和呼吸代谢情况,在不同贮藏温度(0、5、10、15、20、25、30、35、40、45 ℃)测定哈密瓜外果皮、内果皮、外果肉、中果肉、内果肉5个部位蔗糖、乳酸、呼吸代谢途径中14种酶的基因表达活性及其变化情况。结果表明:哈密瓜果实5个部位中蔗糖转化酶和乳酸脱氢酶活性最高,其活性大小依次为:内果皮>外果肉>外果皮>中果肉>内果肉;哈密瓜在5 ℃贮藏时,包括蔗糖转化酶和乳酸脱氢酶的14种酶的活性均处于最低水平,可见5 ℃可有效地控制蔗糖代谢,是哈密瓜的最适贮藏温度。
贮藏温度;哈密瓜;蔗糖代谢;酶活性;呼吸作用
温度影响生物的生理反应、基础代谢以及基因的表达,对采收后果实生理代谢的影响尤其重要。低温可以有效地抑制果实的呼吸代谢,延长贮藏期,但温度过低又会使果实组织损伤,代谢紊乱。现在越来越多的研究证明经热处理后果实的贮藏效果更佳[1-3],但其机理研究较少。温度对果实机体代谢以及基因的表达等产生的影响值得科研人员深入探究。温度的变动影响了果实呼吸代谢途径中酶的基因表达量,因此了解果实贮藏过程呼吸代谢途径中关键控制酶,进而深入研究这些关键酶的信号途径及其信号分子对果实贮藏条件优化、确保果实贮藏质量的影响具有重要的意义。既可达到贮藏目的,又可保证贮藏之后果实的品质,为果实的贮藏保鲜开辟一条新途径。
哈密瓜属葫芦科甜瓜属一年生蔓性草本植物,主要生产区在新疆。哈密瓜以其优良的品质、独特的风味、丰富的营养闻名国内外,成为当前国际市场上的畅销果品。然而由于哈密瓜生产地域性和季节性极强,采收后哈密瓜表皮易出现凹陷斑,易发生腐烂变质,影响哈密瓜的食用品质和商品价值。因此对哈密瓜采后贮藏运输过程中保鲜技术的研究显得尤为重要。目前对于哈密瓜的贮藏保鲜问题,国内外均有一些相关研究,采用低温冷藏[4-6]、气调贮藏[7]、涂膜保鲜[8-9]、化学抑菌剂[10-11]以及采前套袋[12]等方法达到哈密瓜贮藏保鲜的目的。但对于哈密瓜贮藏过程中的呼吸代谢和代谢控制的研究较少。哈密瓜果实形体较大,果肉较厚,是进行不同组织间代谢物信息交流和信号传递研究的优质材料。Moing等[13]研究发现甜瓜不同组织间物质代谢对其营养和感官品质有重大影响,但国内外对于哈密瓜代谢途径中酶活性的研究未见报道,因此本实验对不同贮藏温度的哈密瓜蔗糖流通和呼吸代谢途径中14种酶的基因表达量进行研究,旨在寻找哈密瓜贮藏过程中的关键性控制酶,为优化哈密瓜的贮藏保鲜方法和新型保鲜剂的研究提供参考。
1 材料与方法
1.1 材料与试剂
哈密瓜8601,从新疆哈密瓜原产地采摘后,选取无机械损伤、无病虫害、大小均匀、成熟度一致的优质哈密瓜贮藏备用。
三羟甲基氨基甲烷(Tris)、4-羟乙基哌嗪乙磺酸(4-(2-hydroxyerhyl) piperazine-1-erhaesulfonicacid HEPES)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA) 美国Amresco公司;NAD、NADP、三磷酸腺苷(adenosine triphosphate,ATP)、二磷酸腺苷(adenosine diphosphate,ADP)、一磷酸腺苷(adenosine monophosphate,AMP)、NADH、NADPH、磷酸烯醇丙酮酸、3-磷酸甘油酸、3-磷酸甘油醛、6-磷酸果糖、1,6-二磷酸果糖、丙酮酸 美国Sigma公司。
1.2 仪器与设备
3K15高速冷冻离心机 美国Sigma公司;J2-21高速冷冻离心机 美国Beckman公司;HVE-50哈雅玛高压灭菌器 日本Hirayama Manufacturing公司;752型紫外-可见光分光光度计 上海精密科学仪器有限公司;Fluoroskan Ascent FL荧光-化学发光检测仪 美国Thermo公司。
1.3 方法
1.3.1 溶液配制
0.1 mol/L PBS:称取NaCl 9 g、NaH2PO4·2H2O 0.4 g、Na2HPO4·12H2O 6 g溶于1 000 mL蒸馏水中,调pH值至7.0;0.1 mol/L HEPES:称取HEPES 23.831 g溶于1 000 mL蒸馏水中,分装4份分别调pH值至6.8、7.2、7.4、7.6,用于不同酶活力的测定;50 mmol/L Tris-HCl:称取6.057 g Tris溶于1 000 mL蒸馏水中,分装4份分别调pH值至6.8、7.2、7.4、7.8,用于不同酶活力的测定。
1.3.2 样本制备
将哈密瓜放于自制的P P材质气调箱(25 cm×43 cm×19.5 cm)中,气调比例[7]为5% O2+2% CO2。采用微型实验冷库控制温度,温度设置为0、5、10、15、20、25、30、35、40、45 ℃,气调贮藏24 h,每个温度设3个平行,取出后按哈密瓜中间部位2 cm厚沿赤道平面切开,从瓜皮向瓜心取样,将哈密瓜分为外果皮、内果皮、外果肉、中果肉、内果肉5个部分,分别对应于图1[13]的1、2、3、4、5,用液氮迅速冷冻,并于-80 ℃条件贮藏。

图1 哈密瓜分割图[13]Fig.1 Schematic diagram for preparation of melon flesh samples in an equatorial disk[13]
1.3.3 粗酶液的制备
称取样品10 g左右,加30 mL提取液(含100 mmol/L Tris-HCl、pH 7.5、8 mmol/L MgCl2、2 mmol/L EDTA、12.5%(V/V)甘油、0.5g/100 mL聚乙烯吡咯烷酮、50 mmol/L β-巯基乙醇),在冰浴条件下研磨,匀浆后将匀浆液全部转移入离心管,以10 000×g、4 ℃离心10 min,收集上清液,低温保存备用。
1.3.4 酶的基因表达活性的测定方法
采用酶偶联[14]法测定蔗糖代谢途径中相关酶的基因表达活性。该法利用NADH和NADPH 均在波长340 nm处有光吸收,且均能产生荧光,激发波长和发射波长分别为340 nm和460 nm,而NAD+和NADP+则无此特性的原理将待测酶反应和这两个脱氢反应偶联在一起,用荧光-化学发光检测仪监测荧光值的变化速率计算出相应酶的活力。酶基因表达活性的单位为:’mmol NADH或NADPH/(min·mg pro),用U/g表示。
不同温度对酶活性和酶的表达量都有影响,而机体内的酶活性较难准确测定。在保持测定条件一致,底物浓度足够高时,酶浓度(酶的基因表达量)与酶催化的反应速率呈正比。因此本实验将不同温度条件下制备的样本都在25 ℃时测定酶的活性,用酶的比活力表示不同温度条件下酶的基因表达活性。酶的反应体系参照Pierce等[15]的方法,测定时先加入反应体系,后加入适量稀释的粗酶液启动反应。不加样品液的反应体系(只含底物、辅因子和偶联酶)作为对照,同时做3个平行。用荧光检测仪进行动力学检测,动力学间隔为15 s,持续3 min。
测定的14种酶分别为:蔗糖转化酶(sucrose invertase,INV)、6-磷酸葡萄糖脱氢酶(glucose-6-phosphate dehydrogenase,G6PDH)、己糖激酶(h e x o k i n a s e,H K)、磷酸果糖激酶(phosphofructokinase,PFK)、醛缩酶(aldolase,ALD)、磷酸丙糖异构酶(triosephosphate isomerase,TPI)、3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、磷酸甘油酸激酶(phosphoglycerate kinase,PGK)、丙酮酸激酶(pyruvate kinase,PK)、乳酸脱氢酶(lactate dehydrogenase,LDH)、丙酮酸脱氢酶复合物(pyruvate dehydrogenase complex,PDHC)、异柠檬酸脱氢酶(isocitrate dehydrogenase,ICDH)、α-酮戊二酸脱氢酶复合物(α-ketoglutarate dehydrogenase complex,α-KGDHC)、苹果酸脱氢酶(malate dehydrogenase,MDH)。
1.4 数据分析
采用SPSS 18.0进行数据分析。
2 结果与分析
2.1 不同贮藏温度哈密瓜不同部位14种酶基因表达活性变化
2.1.1 哈密瓜外果皮14种酶基因表达活性变化


图2 不同贮藏温度哈密瓜外果皮中14种酶的基因表达活性Fig.2 The activities of 14 enzymes in epicarp at different temperatures
哈密瓜中可溶性糖含量最高的是蔗糖,占60%以上[16]。蔗糖含量是甜瓜果实糖分高低的主要决定因子[17-18]。在哈密瓜的贮藏过程中控制哈密瓜的蔗糖分解,降低糖类消耗显得尤为重要。由图2可以看出,哈密瓜的外果皮部位,随着温度的变化,蔗糖转化酶和乳酸脱氢酶的活力比其他12种酶的活力高,蔗糖转化酶和乳酸脱氢酶都有极显著性差异(P<0.01),大多数酶的基因表达活性在10 U/g左右。蔗糖转化酶的波动较大,其中活性最低的是5 ℃,最高的是45 ℃,两者差值为86.61 U/g,差异极显著(P<0.01),乳酸脱氢酶的变化趋势与蔗糖转化酶基本相似。在0 ℃时,除了蔗糖转化酶和乳酸脱氢酶以外,磷酸丙糖异构酶的活力也较高为27.36 U/g。总体来看,在5 ℃时14种酶的基因表达活性较低,45 ℃时酶的活性都较高。在10、20、45 ℃时,醛缩酶也表现出较强的活性,45 ℃时最高为46.54 U/g,从图2b、c和d可以看出其他酶的基因表达活性都在20 U/g左右。
2.1.2 哈密瓜内果皮14种酶基因表达活性变化
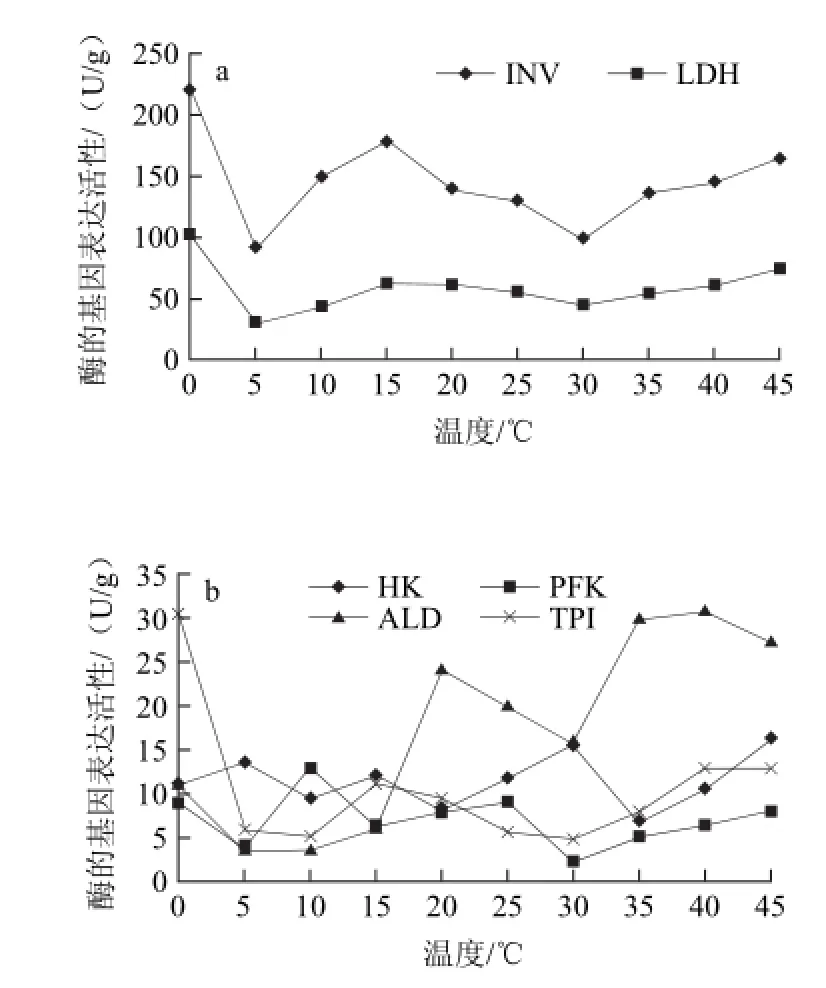

图3 不同贮藏温度哈密瓜内果皮中14种酶的基因表达活性Fig.3 The activities of 14 enzymes in endocarp at different temperatures
由图3可知,在哈密瓜的内果皮中,随着温度的升高蔗糖转化酶和乳酸脱氢酶的基因表达活性显著高于其他12种酶的活性,蔗糖转化酶的基因表达活性在不同温度间的波动较大,最高的是0 ℃,最低的是5 ℃,其差值为132.1 U/g,在5~15 ℃之间蔗糖转化酶的基因表达活性不断上升,15~30 ℃时略有下降,有研究发现植物受到一些非生物和生物胁迫后蔗糖转化酶的活性显著升高[4]。其次活力较高的是乳酸脱氢酶,乳酸脱氢酶在0 ℃时达到最高值103.34 U/g,在5 ℃时显著降低(P<0.01),5~15 ℃之间略有升高,此后基本处于稳定状态,波动的范围是45.95 ~74.88 U/g。在0 ℃时除蔗糖转化酶和乳酸脱氢酶外,丙酮酸激酶、磷酸丙糖异构酶、磷酸甘油酸激酶、3-磷酸甘油醛脱氢酶的活性也达到最高值。在15 ℃时丙酮酸激酶的活力较5 ℃显著升高(P<0.05)。当20 ℃时醛缩酶的基因表达量显著升高,之后随温度的升高呈先下降后又上升的趋势。
2.1.3 哈密瓜外果肉14种酶的基因表达活性变化
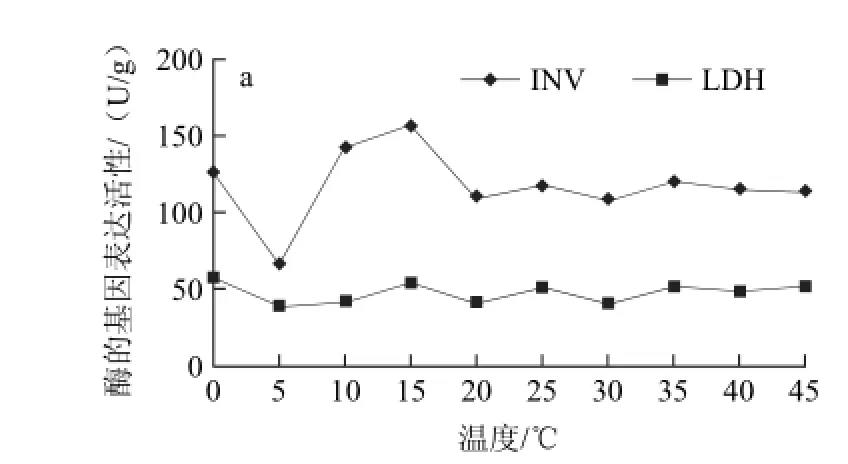

图4 不同贮藏温度哈密瓜外果肉中14种酶的基因表达活力Fig.4 The activities of 14 enzymes in outer pulp at different temperatures
哈密瓜果肉多数为橘红色,有少数为白色、黄红色或青色,因品种各异。本实验中哈密瓜8601果肉为橘红色。如图4所示,在哈密瓜的外果肉中蔗糖转化酶在各温度间的差异较大。蔗糖转化酶活性最高的是15 ℃,最低的是5 ℃,差异极显著(P<0.01)。此部位乳酸脱氢酶的变化较小,变幅为19.86 U/g。在0 ℃和15 ℃时丙酮酸激酶的活性显著升高,分别为43.46 U/g和35.28 U/g。醛缩酶的活性随温度变化而发生波动,但波动范围较小,一直介于10~35 U/g之间。在0 ℃时磷酸丙糖异构酶、磷酸甘油酸激酶、3-磷酸甘油醛脱氢酶活性为最高值,表明低温胁迫时酶的基因表达活性显著升高[19-20]。在45 ℃时3-磷酸甘油醛脱氢酶和己糖激酶的基因表达活性显著升高(P<0.05),有研究[21]显示植物中3-磷酸甘油醛脱氢酶在热激及能量供应中发挥着重要作用。
2.1.4 哈密瓜中果肉14种酶的基因表达活性变化

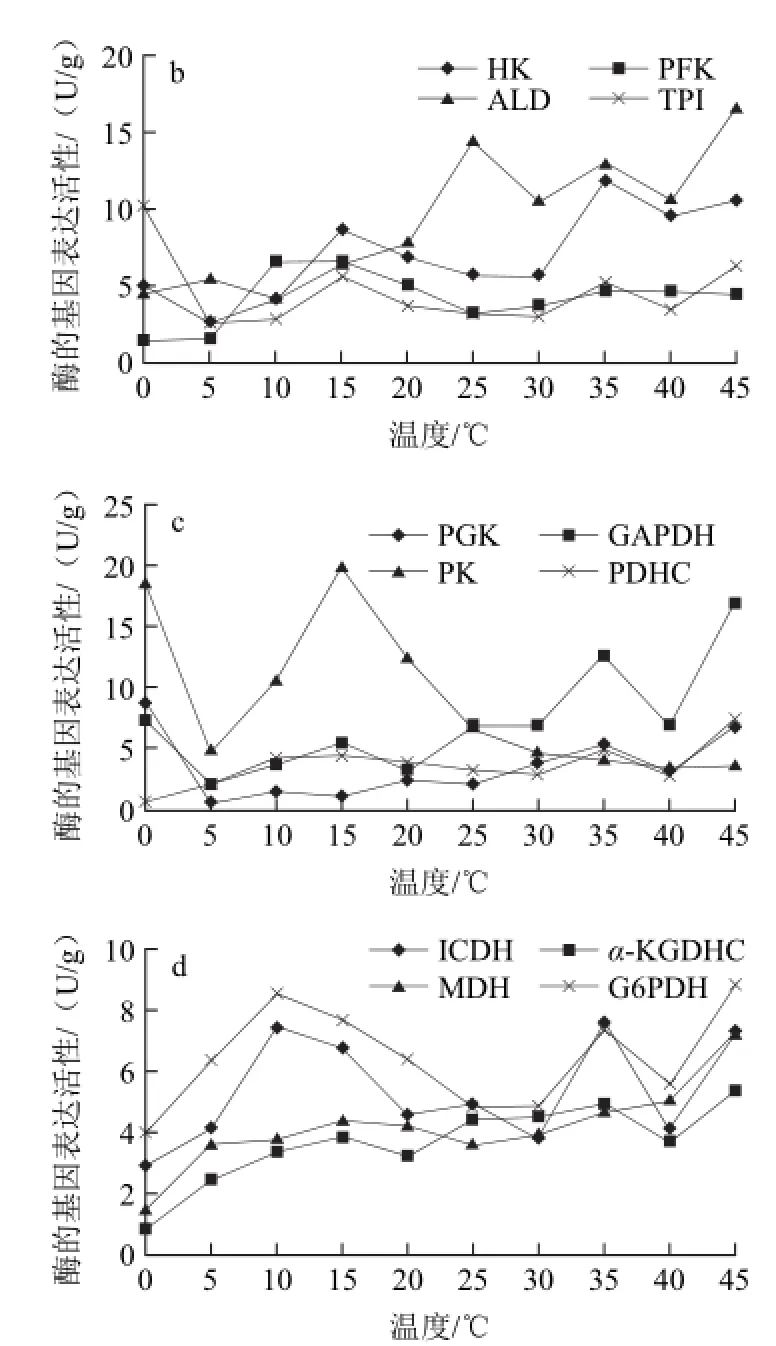
图5 不同贮藏温度哈密瓜中果肉中14种酶的基因表达活性Fig.5 The activities of 14 enzymes in middle pulp at different temperatures
由图5可知,哈密瓜的中果肉部位蔗糖转化酶和乳酸脱氢酶仍然是基因表达活性最高的两种酶,与其他12种酶相比差异显著。蔗糖转化酶在整个温度变化中处于基本稳定状态,变幅为19.71 U/g。乳酸脱氢酶在整个过程中变化也不显著,波动范围在23.01~36.34 U/g,各温度之间无显著性差异。由图5b、c和d可以看出,在0、10、15、20 ℃时丙酮酸激酶活性较高,温度高于25 ℃时醛缩酶、3-磷酸甘油醛脱氢酶、己糖激酶的活性略有升高,其他温度条件下各种酶的基因表达活性都处于较低水平,都在10 U/g以下。
2.1.5 哈密瓜内果肉14种酶的基因表达活性变化
内果肉是离种子腔最近的部位,也是哈密瓜中质地最细腻的部位。由图6可以看出,蔗糖转化酶的活性略有波动,但范围较小,酶的基因表达活性介于40~60 U/g之间。乳酸脱氢酶的基因表达活力只有在5 ℃时略低,为18.45 U/g,其他温度基本处于平稳状态,各温度之间无显著性差异。在0 ℃时活性较高的仍然是丙酮酸激酶、磷酸甘油酸激酶、磷酸丙糖异构酶、3-磷酸甘油醛脱氢酶。丙酮酸激酶在0 ℃时活性最高,5 ℃时降到最低,此后基本处于稳定状态。醛缩酶随温度的升高而有升高趋势,从图6b、c和d可以看出,其他酶的活性基本在10 U/g以下,均无显著性差异。在内果肉这个部位各种酶的活性都基本处于稳定状态且相对较低,尤其是蔗糖转化酶和乳酸脱氢酶,说明在这个部位蔗糖代谢较缓慢。

图6 不同贮藏温度哈密瓜内果肉中14种酶的基因表达活性Fig.6 The activities of 14 enzymes in inner pulp at different temperatures
2.2 哈密瓜不同组织间14种酶基因表达活性比较
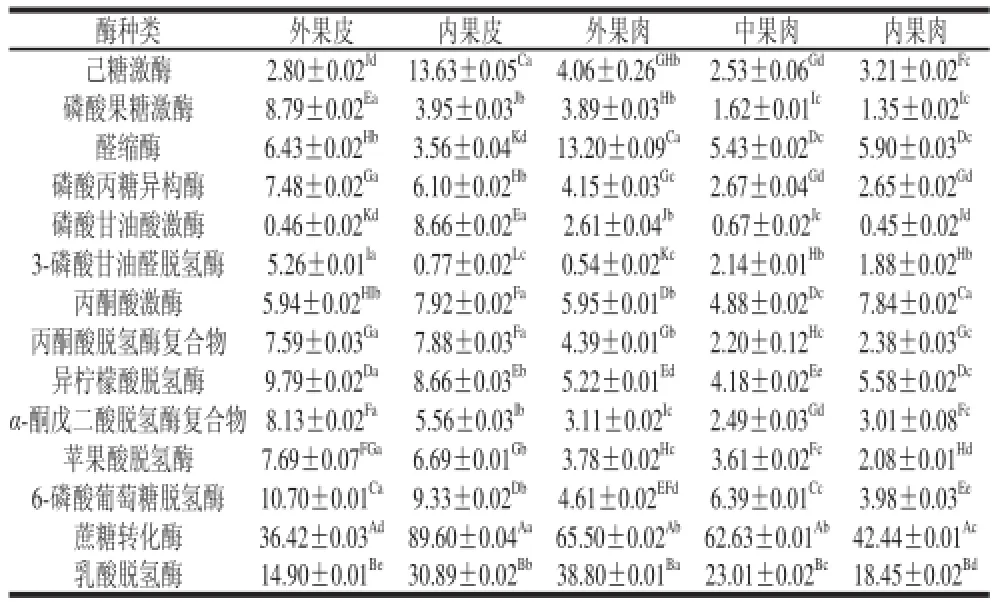
表1 不同组织间14种酶的基因表达活性比较Table1 Comparisons ofU/g
在贮藏过程中蔗糖代谢越缓慢越有利于哈密瓜的贮藏保鲜,从前面的分析中可以看出,14种酶的基因表达量最低的是5 ℃,为此,本实验对哈密瓜5 ℃时14种酶的基因表达量进行不同组织间的比较,研究不同组织间的信号传递和信息交流。
从表1可以看出,哈密瓜不同组织间酶含量差异显著,中果肉和内果肉酶基因表达活性有显著性差异的较少,且酶含量相对较低,内果皮中酶含量一般比其他部位高,尤其是己糖激酶和蔗糖转化酶,各部位间的蔗糖代谢并非处于同一状态。在同一组织各种酶基因表达量也有显著性差异,不同组织中酶含量较高的都是蔗糖转化酶和乳酸脱氢酶,在外果皮和内果皮中丙酮酸脱氢酶复合物、异柠檬酸脱氢酶、α-酮戊二酸脱氢酶复合物、苹果酸脱氢酶等含量都较高,可见在果皮中呼吸代谢较为旺盛。丙酮酸激酶在不同组织中活性差别不大,在哈密瓜不同组织中酶含量都较高的是:蔗糖转化酶、乳酸脱氢酶、6-磷酸葡萄糖脱氢酶和醛缩酶。
3 结 论
本实验测定了哈密瓜不同贮藏温度条件下蔗糖、乳酸和呼吸代谢途径中14种酶的基因表达活性,并对哈密瓜不同组织中蔗糖、乳酸和呼吸代谢的酶含量进行比较。结果表明:5 ℃时14种酶的基因表达量最低,呼吸代谢缓慢,证明5 ℃是最佳保鲜与贮藏温度,这对于优化哈密瓜的贮藏条件具有一定的指导意义。蔗糖转化酶催化蔗糖和葡萄糖之间的转化,在呼吸、分解和合成代谢中具有重要意义[22];乳酸脱氢酶是控制呼吸、氧化磷酸化等合成与分解代谢的关键酶,催化丙酮酸还原为乳酸,所需氢原子由NADH+H+离子提供,而NADH+H+在氧化磷酸化、呼吸代谢和基础代谢与控制相关基因的表达及调控与表观遗传修饰中发挥关键作用[23-25],另外6-磷酸葡萄糖脱氢酶在磷酸戊糖合成途径中发挥重要作用,醛缩酶也是糖酵解途径中的关键酶,这些酶都对蔗糖流通和呼吸代谢起关键控制作用。从代谢途径中可以看出丙酮酸是联系糖酵解、三羧酸循环和乳酸代谢的关键物质[26],在整个温度变化过程中丙酮酸脱氢酶一直处于相对稳定状态,说明该酶构成多条代谢途径的核心,是哈密瓜维持基础代谢所必须的,在任何温度条件下首先要保持足够大的稳定性,推测它可能是保持哈密瓜基础代谢不受损伤或丧失基础代谢能力的基础。哈密瓜不同组织间呼吸、合成与分解代谢处于动态平衡状态,降低其关键酶(差异最大的酶)是维护其动态平衡,减少基础代谢和组织之间的流通的重要保证。不同温度、不同部位基因表达活性越高、差异越显著的酶,越能说明这些酶就是控制代谢交互关系的关键。研究结果表明,各组织中基因表达活性最高的是蔗糖转化酶和乳酸脱氢酶,其活性大小依次为:内果皮>外果肉>外果皮>中果肉>内果肉。在清楚地了解了哈密瓜蔗糖、乳酸和呼吸代谢途径中各种酶基因表达活性的大小之后,可为呼吸代谢控制的深入研究,关键酶信号途径和信号分子的探索以及新型保鲜剂的研究提供重要参数。这些研究结果对于哈密瓜贮藏条件的优化,贮藏过程中的代谢研究与控制具有一定的参考价值,为哈密瓜的贮藏保鲜提供一条新途径。
[1] 毛晓英, 吴庆智, 李宝坤, 等. 热处理对新疆哈密瓜采后贮藏特性的研究[J]. 食品科学, 2007, 28(12): 491-493.
[2] 袁莉, 毕阳, 葛永红, 等. 采后热处理对厚皮甜瓜贮藏品质的影响[J].食品科学, 2010, 31(20): 421-424.
[3] 李健, 张萌, 李丽萍, 等. 热处理对草莓品质与活性氧代谢影响的多变量解析[J]. 食品科学, 2013, 34(16): 306-310.
[4] 张保才. “风味4号”甜瓜果实糖积累及采后生理代谢研究[D]. 武汉:华中农业大学, 2010.
[5] 斯越秀, 胡妙君, 汪财生, 等. 贮藏温度对哈密瓜“黄皮9818”采后营养品质的影响[J]. 江苏农业科学, 2012, 40(2): 210-212.
[6] CHEN Jiluan, ZHANG Jing, SONG Lijun. Changes in microorganism, enzyme, aroma of Hami melon (Cucumis melo L.) juice treated with dense phase carbon dioxide and stored at 4 ℃[J]. Innovative Food Science and Emerging Technologies, 2010, 11(4): 623-629.
[7] 李萍, 车凤斌, 胡柏文. 气调贮藏不同气体比例对哈密瓜86-1贮期品质及生理活性的影响[J]. 新疆农业科学, 2010, 47(1): 104-109.
[8] 胡少华, 张立宇, 杨超, 等. 哈密瓜涂膜保鲜技术应用初报[J]. 农村科技, 2010(4): 55-56.
[9] CONG Fengsong, ZHANG Yungui, DONG Wenyan. Use of surface coatings with natamycin to improve the storability of Hami melon at ambient temperature[J]. Postharvest Biology and Technology, 2007, 46(1): 71-75.
[10] 吴明辉. 新疆哈密瓜保鲜技术的研究与应用[D]. 乌鲁木齐: 新疆大学, 2008.
[11] 谢绍忠, 吴斌, 钟梅, 等. 1-MCP对切分哈密瓜保鲜效果的研究[J].食品科学, 2009, 30(10): 278-281.
[12] 王静, 王晓鹏, 妥丽敏. 哈密瓜采前套袋对贮期腐烂的影响[J]. 果树学报, 2013, 30(3): 465-469.
[13] MOING A, AHARONI A, BIAIS B, et al. Extensive metabolic crosstalk in melon fruit revealed by spatial and developmental combinatorial metabolomics[J]. New Phytologist, 2011, 190(3): 683-696.
[14] PIERCE V A, CRAWFORD D L. Rapid enzyme assays investigating the variation in the glycolytic pathway in field-caught populations of Fundulus heteroclitus[J]. Biochemical Genetic, 1994, 32(9/10): 317-330.
[15] PIERCE V A, CRAWFORD D L. Phylogenetic analysis of thermal acclimation of the glycolytic enzymes in the genus fundulus[J]. Physiological Zoology, 1997, 70(6): 597-609.
[16] LESTER G E, AREAS L S, GOMEZ-LIM M. Muskmelon fruit soluble acid invertase and sucrose phosphate synthase activity and polypeptide profiles during growth and maturation[J]. Journal of the American Society for Horticultural Science, 2001, 126(1): 33-36.
[17] 王贤磊, 高兴旺, 李冠. 甜瓜遗传图谱的构建及果实与种子QTL分析[J]. 遗传, 2011, 33(12): 1398-1408.
[18] 张明方, 李志凌, 陈坤松. 网纹甜瓜发育果实糖分积累与蔗糖代谢参与酶的关系[J]. 植物生理与分子生物学学报, 2003, 29(5): 455-462.
[19] BI Yang, TIAN Shiping, LIU Hongxia, et al. Effect of temperature on chilling injury, decay and quality of Hami melon during storage[J]. Postharvest Biology and Technology, 2003, 29(2): 341-348.
[20] MATSUURA-ENDO C, KOBAYASHI A, NODA T, et al. Changes in sugar content and activity of vacuolar acid invertase during low temperature storage of potato tubers from six Japanese cultivars[J]. Journal of Plant Research, 2004, 117(2): 131-137.
[21] 王幼宁, 刘孟雨, 李霞. 植物3-磷酸甘油醛脱氢酶的多维本质[J]. 西北植物学报, 2005, 25(3): 607-614.
[22] 王君, 李磊, 谢冰, 等. 采后皇冠梨果实糖代谢及相关酶活性变化规律[J]. 食品科学, 2010, 31(18): 390-393.
[23] COPPARI R. Metabolic actions of hypothalamic SIRT1[J]. Trends in Endocrinology and Metabolism, 2012, 23(4): 179-185.
[24] CHOWDHURY S K, DOBROWSKY R T, FERNYHOUGH P. Nutrient excess and altered mitochondrial proteome and function contribute to neurodegeneration in diabetes[J]. Mitochondrion, 2011, 11(6): 845-854.
[25] IMAI S, GUARENTE L. Ten years of NAD-dependent SIR2 family deacetylases: implications for metabolic diseases[J]. Trends Pharmacol, 2010, 31: 212-220.
[26] 庞广昌, 陈庆森, 胡志和. 乳酸盐代谢及其在健康中的关键作用[J].食品科学, 2012, 33(1): 1-15.
Effects of Different Storage Temperatures on the Activities of Fourteen Enzymes Involved in Sucrose Metabolism in Hami Melon
CAI Xiu-zhen, PANG Guang-chang*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
This study aimed to shed light on the respiratory metabolism and sucrose accumulation in Hami melon under different storage conditions. The activities (gene expression levels) of fourteen enzymes involved in sucrose metabolism were measured at different storage temperatures (0, 5, 10, 15, 20, 25, 30, 35, 40 and 45 ℃). These enzymes in the epicarp, endocarp, outer pulp, middle pulp, inner pulp were investigated as well. The results showed that among these enzymes examined, the activities of invertase and lactate dehydrogenase were the highest. The decreasing order of the two enzyme activities in five tissues was as follows: endocarp > outer pulp > epicarp > middle pulp > inner pulp. When Hami melon was stored at 5 ℃, the activities of all 14 enzymes were at a low level. Thus, 5 ℃ is the optimal storage temperature and sugar metabolism can be controlled effectively at this temperature.
storage temperature; Hami melon; sucrose metabolism; enzyme activity; respiration
TS255.1
A
1002-6630(2014)02-0271-06
10.7506/spkx1002-6630-201402053
2013-06-27
国家自然科学基金面上项目(30871951);天津市科技支撑计划项目(10ZCKFNC01800)
蔡修臻(1987—),女,硕士研究生,研究方向为代谢工程。E-mail:caixiuzhen2007@163.com
*通信作者:庞广昌(1956—),男,教授,博士,研究方向为食品生物技术。E-mail:pgctjcu.edu.cn
