食品中鸡源性成分实时荧光PCR检测方法的建立
2014-01-17范丽丽傅春玲丁洪流
范丽丽,李 培,傅春玲,*,丁洪流,陈 英
(1.苏州大学医学部公共卫生学院,江苏 苏州 215123;2.苏州市产品质量监督检验所,江苏 苏州 215128)
食品中鸡源性成分实时荧光PCR检测方法的建立
范丽丽1,李 培2,傅春玲1,*,丁洪流2,陈 英2
(1.苏州大学医学部公共卫生学院,江苏 苏州 215123;2.苏州市产品质量监督检验所,江苏 苏州 215128)
目的:建立基于实时荧光聚合酶链式反应技术的食品中鸡源性成分快速检测方法。方法:以鸡线粒体细胞色素b为目的基因,设计特异性引物和探针,通过特异性、灵敏性实验及模拟混合肉样和市售肉制品检测,对该体系进行验证。结果:该鸡源荧光聚合酶链式反应检测体系具有很好的特异性及灵敏性,可检测3.5 pg/μL鸡源DNA的存在;经含鸡源成分的模拟混合肉样检测,证实体系抗干扰能力强;并且通过市售食品检测表明体系可用于定性加工食品中的鸡源成分。结论:所建立的鸡源引物探针体系具有特异性好、灵敏度高、快速高效等优点,可用于对食品中鸡源性成分的掺假鉴别。
实时荧光聚合酶链式反应;鸡;线粒体细胞色素b基因;食品掺假
随着经济的高速发展,人民的消费需求增长,我国肉类产量逐年增加,其中鸡肉产量占据肉类总产量的13.97%[1]。与此同时,消费者对食品质量与安全性的要求也越来越高,其中掺杂使假不法行为是消费者长期关注的焦点之一[2]。不法商贩、企业为获得非法利润,常以较低价的鸡肉冒充牛、羊、猪肉,严重侵害了消费者利益。这不仅涉及经济、营养价值和食品安全等问题,更直接影响消费者的健康,尤其是对某些食物过敏的消费者[3]。为维护广大消费者合法权益,稳定市场秩序,对动物性食品进行种源的鉴定显得十分必要。由于食品种类繁多、成分复杂、加工程度高等因素,使得常规检测方法如电泳、免疫学技术、光谱技术在种源的定性检测方面多有不足,如灵敏度低、周期长、费时费力[4-6]。而实时荧光聚合酶链式反应(polymerase chain reaction,PCR)技术以DNA为模板,设计特异引物探针,在封闭的体系中进行扩增和实时检测,无需电泳就可以对结果进行分析,避免了PCR产物的污染和溴化乙锭(ethidium bromide,EB)带来的危害,也缩短了检测时间[5];且扩增目的片段较短,尤其适用于加工食品。该研究旨在利用实时荧光PCR技术建立肉食品中鸡源成分检测方法,为质检部门打击不法商贩的食品掺假、造假行为、维护消费者合法利益提供有力的技术参考。
1 材料与方法
1.1 材料与试剂
三黄鸡、儿童鸡肉酥、火腿肠、撒尿肉丸、火鸡等加工食品,以及鲜鸡、猪、牛、羊、鸭肉、鸽子、鹌鹑等(通过形态鉴别) 市售。
组织基因组DNA提取试剂盒及DNA Marker 天根生化科技有限公司;无水乙醇(分析纯);TaqMan Universal PCR master mix 美国ABI公司;DreamTaq PCR Master Mix及引物、探针合成 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
5810型台式高速冷冻离心机、生物分光光度计 德国Eppendorf公司;7000型实时荧光PCR 美国ABI公司;VORTEX-5涡旋振荡器 其林贝尔仪器制造有限公司;DKB-1915型恒温水浴槽、PCR仪 美国Bio-Rad公司;ER-200A凝胶成像系统 上海复日科技有限公司。
1.3 方法
1.3.1 样品均质及基因组模板制备
鲜肉和加工食品样品进行均质处理,其中纯鲜肉猪、牛、羊、鸡和鸭等烘干(105 ℃)后再进行均质处理,作为特异性、灵敏性中的标准纯品,以及制作后期模拟混合样使用,均质过程不同肉类分开处理,防止不同动物源性污染。按照组织基因组DNA提取试剂盒说明书步骤进行,最终提取光密度(optical density,OD)比值(OD260nm/OD280nm)均在1.7~2.0之间的动物组织DNA,置-20 ℃低温保存备检。
1.3.2 引物、探针的设计合成及有效性验证
根据GenBank所公布的鸡线粒体细胞色素b基因序列,利用Primer Express 2.0软件,依据引物探针设计原则,设计鸡特异性引物和探针,GeneBank Accession:GU261719.1,扩增目的片段长度为110 bp。引物探针序列见表1。

表1 鸡引物探针序列Table1 Sequences of primers and probe for chicken DNA
PCR反应体系:DreamTaq PCR Master Mix 25 μL,10 μmol/L上、下游引物各2 μL,模板DNA(50 ng/μL)2 μL,灭菌去离子水19 μL。反应条件:95 ℃预变性5 min;95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸40 s,40个循环;72 ℃延伸15 min。PCR结束后进行电泳验证。
1.3.3 实时荧光PCR反应体系与反应循环参数
反应体系的体积为25 μL:TaqMan PCR master mix;上、下游引物,荧光标记探针,各1μL,终浓度皆为0.4 μmol/L;模板DNA(0.0035~70ng/μL)1μL;其余不足用灭菌双蒸水补齐。反应循环参数为:50 ℃预变性2 min;95 ℃变性10 min;95 ℃退火15s,60 ℃延伸1 min,40个循环。1.3.4 特异性实验
以鸡、牛、羊、猪、鸭、火鸡、鸽子和鹌鹑等纯肉提取的DNA,质量浓度70 ng/μL,各取1 μL,分别进行实时荧光PCR反应,以验证所设计鸡引物、探针的特异性。
1.3.5 灵敏度实验
取纯鸡肉提取DNA样品1个,重复2次,用灭菌双蒸水10倍比例稀释,得质量浓度0.000 35~70 ng/μL,取1 μL为模板,进行实时荧光PCR,重复3次,检测所设计鸡引物、探针的灵敏度。
1.3.6 模拟混合肉样中鸡源性成分检测
为进一步检测鸡特异性引物探针体系,制备不同模拟混合肉样,其中 A、B、C、D分别为鸡肉和猪、牛、羊、鸭肉的混合样品,E为鸡、猪、牛、羊和鸭肉的混合样品,模拟混合肉样中各肉种所占质量百分比见表2。每个混合样提取DNA样品1个,重复2次,进行实时荧光PCR,重复3次,以检验该引物探针体系对模拟混合肉样中鸡源性成分的抗干扰检测能力。
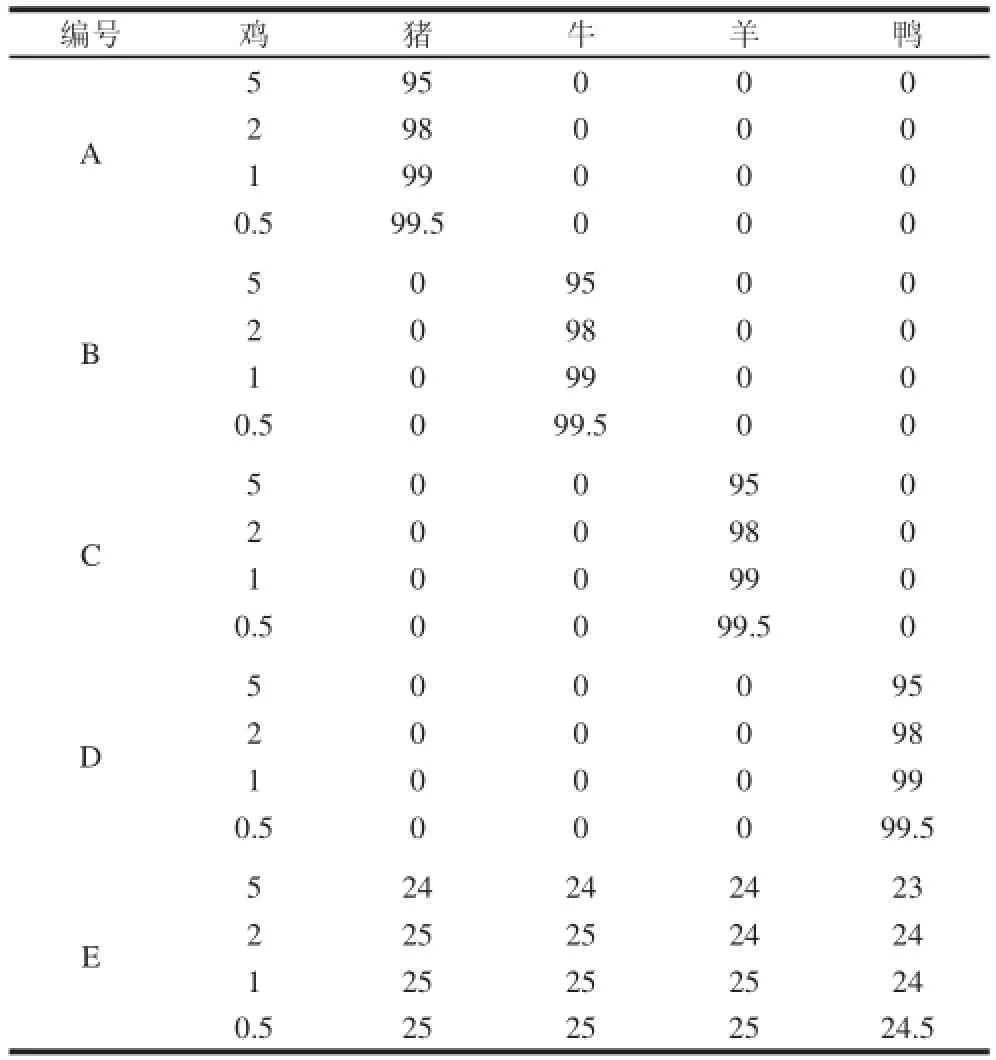
表2 模拟混合肉类样品Table2 Samples of meat mixtures %
2 结果与分析
2.1 引物的有效性验证
利用所设计的鸡线粒体细胞色素b基因引物,对鸡DNA模板进行PCR扩增,将所得到得PCR产物进行电泳,得图谱如图1所示,均能得到约110 bp的目的DNA片段,无非特异性杂带,与预期所设计目的片段长度相符。
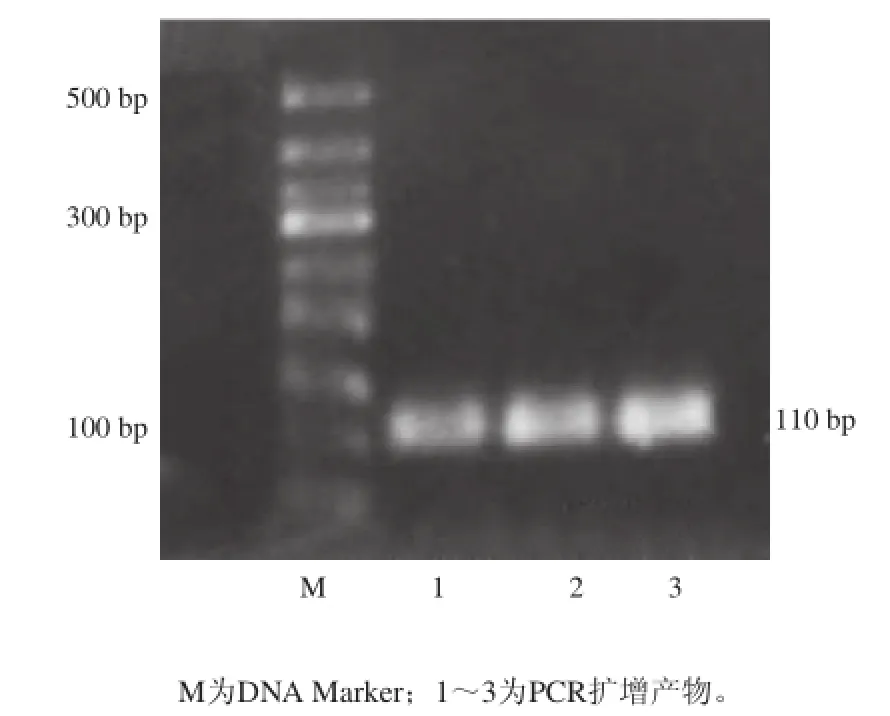
图1 鸡源引物扩增产物电泳图Fig.1 Gel electrophoresis of PCR amplification products of the chicken conservative region of Cyt b gene
2.2 鸡源引物探针体系的特异性实验
为检测所设计鸡的引物探针体系的特异性,将鸡、猪、牛、羊、鸭、火鸡、鹌鹑和鸽子等DNA模板进行PCR反应,特异性实验结果如图2所示,引物探针体系只对鸡源DNA模板进行扩增,且重复性良好,对其他动物源性成分,猪、牛、羊、鸭等肉类 DNA模板均不能扩增出正常曲线,正常扩增Ct值限定为35,证实该检测体系具有较好的特异性。
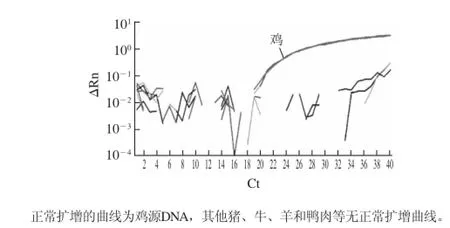
图2 鸡源性引物探针体系的特异性检测Fig.2 RT-PCR amplification plot showing the specificity of chicken primer-probe system
2.3 鸡源引物探针体系的灵敏度实验
将鸡肉DNA模板以10倍比例稀释,用PCR检测所设计引物探针体系的灵敏度,质量浓度依次为70、7、0.7、0.07、0.007 ng/μL及0.003 5 ng/μL,扩增结果如图3所示,各质量浓度均获得正常扩增,Ct值范围为19.85~35.11,且各质量浓度重复性好。其中质量浓度0.003 5 ng/μL的模板亦获得正常扩增,证实该体系最低可检测到3.5 pg/μL的纯鸡肉DNA,灵敏度较高。
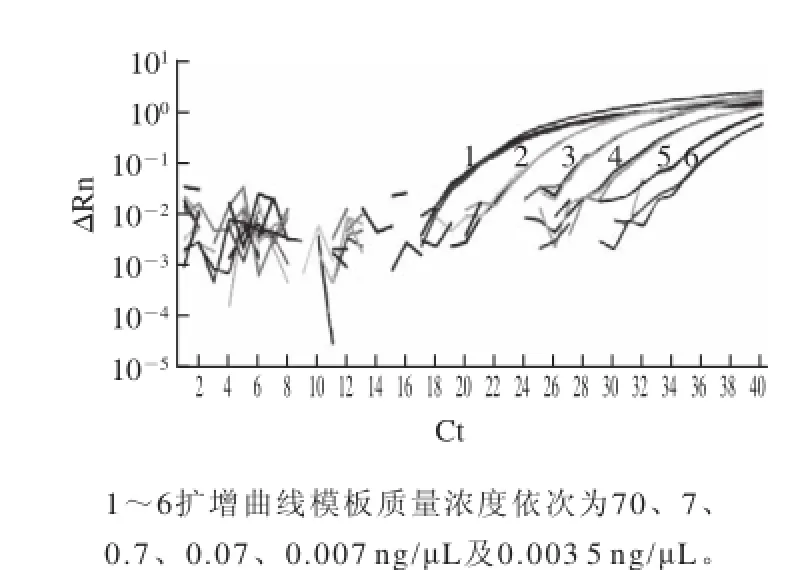
图3 鸡源引物探针体系的灵敏度检测F ig.3 RT-PCR amplification plots showing the sensitivity of the chicken-specific primer-probe system
2.4 模拟混合样品鸡源性成分检测
用所建立的鸡源性特异引物探针体系,对5类模拟混合肉样(表2)进行检测,结果见表3,5类模拟混合肉样的扩增结果,均显示随鸡肉成分含量降低,Ct值呈增高趋势,与样品中目的DNA含量由高到低的变化相符,且含0.5%~5%鸡肉的所有模拟混合肉样均获得成功扩增,Ct值范围为20.43~27.77,证实检测体系的抗干扰能力较强。
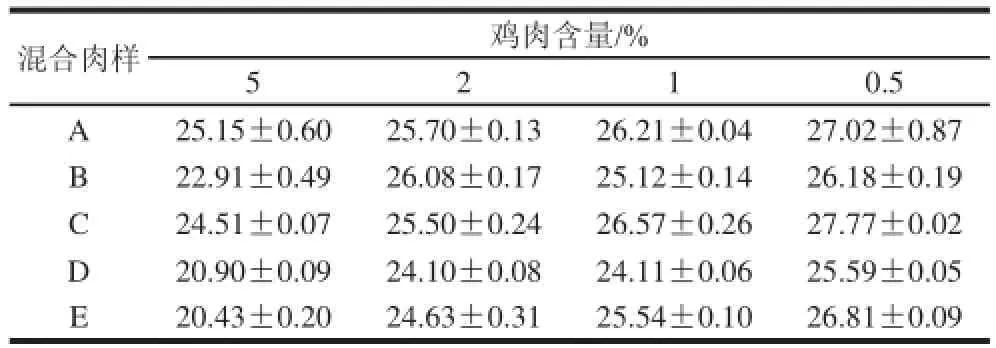
表3 模拟混合肉样中鸡源性成分Ct值的检测Table3 Detection of chicken-derived ingredients in meat mixtures
2.5 市售食品样品中鸡源性成分检测
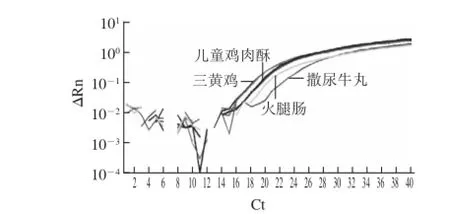
图4 食品样品鸡源成分检测Fig.4 Detection of chicken-derived ingredients in food samples using the chicken-specific primer-probe system
为了进一步验证鸡引物探针体系的准确性和实际应用能力,对购自市场的标签含有鸡肉的食品进行检测。各食品样品分别为三黄鸡(主要成分三黄鸡、食盐、酒、食品添加剂)、儿童鸡肉酥(主要成分鸡肉松、盐、糖)、火腿肠(主要成分猪肉和鸡肉、食品添加剂等)、速冻撒尿牛丸(主要成分猪肉、牛肉及鸡肉等)。4类食品各做3个重复,扩增结果如图3所示,均获得正常扩增,Ct值范围为17.1~21.0之间,验证鸡肉成分的存在,表明所建立的引物探针体系可检测加工食品中存在的鸡源性成分。
3 讨 论
目前利用实时荧光PCR对鸡源性成分进行鉴定的研究较少,其中Dooley等[8]同样以细胞色素b基因为目的基因建立实时PCR检测鸡源性成分的方法,检测限为鸡肉含量的0.5%,其方法主要局限性在于适合于生鲜肉样。本研究所建立方法模拟样品为烘干高温肉类样品,更适合于加工肉类食品的检测,同时获得了较高的灵敏度。本方法在用于检测含0.5%鸡肉不同模拟混合肉样时,各模拟混合肉样都获得正常扩增,Ct值范围为20.43~27.77,表明该体系抗干扰能力较强;以纯鸡肉DNA模板进行的灵敏度实验也显示该检测体系具有较好的灵敏度,可检测低至3.5 pg/μL的鸡肉DNA,较之Jonker等[9]建立的检测体系50 pg/μL更为灵敏;比之于Camma等[10]的体系较差,主要是因为本研究是用经过高温处理的标准样品做灵敏性检测,而Camma等的较好灵敏度是经生鲜肉测量所得。检测靶基因是影响荧光PCR检测灵敏度和特异性的关键因素,本研究中选择的细胞色素b基因位于线粒体,而大量线粒体存在于多数细胞中,且该基因为多拷贝基因,故可达到较高灵敏度而适宜于生物种源的定性研究[11]。
国内相关研究中,汪永信等[12]建立的双重实时荧光PCR法检测食品和饲料鸡源性成分,检测限为0.1 ng/μL,其在扩增目的基因同时,于同一体系内进行内参照扩增,以避免假阴性结果[13],但采用内标同时进行反应,会干扰目的片段的正常扩增反应,因此不能获得更高的灵敏度;罗家琴等[14]利用普通PCR检测饲料中鸡源性成分,虽然检测限可达0.1%,后期电泳等步骤却耗时费力;王金玲等[13]建立的饲料中鸡源性成分PCR和变性高效液相色谱分析相结合的检测方法,以12S rRNA基因为靶基因,设计引物具有较好的特异性,但灵敏度仅为2.04 ng/μL,且该方法相对而言更费事耗力。由于上述研究所采用方法的局限性,均不能获得很好的灵敏度、特异性和便捷性。本研究建立的方法可以避免以往研究的缺陷,具有一定的优势。
在已经建立的相关标准方法中,GB/T 21103—2007《动物源性饲料中哺乳动物源性成分定性检测方法》,其规定了饲料中哺乳动物源性成分通用的荧光PCR检测法,正常扩增的Ct值同样设定为35循环以内,检测限更低为0.1%[16]。但尚无以国家标准形式明确规定的肉类种源性荧光PCR检测方法,仅行业标准SN/T 2557—2010《畜肉食品中牛成分定性检测方法实时荧光PCR法》[17]明确了用实时荧光PCR技术定性牛源成分方法。因此,亟待建立准确、高效、灵敏的方法检测食品中鸡源性成分。本研究建立的食品中鸡源性成分检测体系具有较好的特异性和高灵敏度,具有准确、省时等特点,而且通过含鸡源成分市售样品的检测,证实了其实际应用能力,表明该检测体系可作为市售食品中鸡源成分检测的有效工具。
[1] 刘登勇, 周光宏, 徐幸莲. 我国肉鸡加工业的现状及发展趋势[J]. 食品科学, 2005, 26(11): 266-269.
[2] 李家鹏, 乔晓玲, 田寒友, 等. 食品和饲料中动物源性成分检测技术研究进展[J]. 食品科学, 2011, 32(9): 340-347.
[3] 王玲, 姜辉, 田亚平. 普通人群14种食物不耐受情况初步分析[J]. 军医进修学院学报, 2007, 28(2): 129-131.
[4] 陈颖, 吴亚君, 徐宝梁, 等. 食品及饲料中马属动物源性成分的PCR检测研究[J]. 中国生物工程杂志, 2004, 24(5): 78-83.
[5] Von HOLST C, HONIKEL K O, UNGLAUD W, et al. Determination of an appropriate heat treatment of animal waste using the ELISA technique: result of a validation survey[J]. Meat Science, 2000, 54(1): 1-7.
[6] 王小燕, 王锡昌, 刘源, 等. 近红外光谱技术在食品掺伪检测应用中的研究进展[J]. 食品科学, 2011, 32(1): 265-269.
[7] HEID C A, STEVENS J, LIVAK K J, et al. Real time quantitative PCR[J]. Genome Research, 1996, 6(10): 986-994.
[8] DOOLEY J J, PAINE K E, GARRETT S D, et al. Detection of meat species using TaqMan real-time PCR assays[J]. Meat Science, 2004, 68(3): 431-438.
[9] JONKER K, TILBURG J, HAGELE G, et al. Species identification in meat products using real-time PCR[J]. Food Additives and Contaminants, 2008, 25(5): 527-533.
[10] CAMMA C, DOMENICO M D, MONACO F. Development and validation of fast Real-Time PCR assays for species identi cation in raw and cooked meat mixtures[J]. Food Control, 2012, 23(2): 400-404.
[11] BALLIN N Z, VOGENSEN F K, KARLSSON A H. Species determination-can we detect and quantify meat adulteration[J]. Meat Science, 2009, 83(2): 165-174.
[12] 汪永信, 安虹, 程坚, 等. 双重实时荧光PCR法检测食品和饲料中的鸡源性成分[J]. 生物技术通报, 2012(1): 134-138.
[13] RODRÍGUEZ D, D’AGOSTINO, PLA M, et al. Construction strategy for an internal ampli cation control for real-time diagnostic assays using nucleic acid sequence-based ampli cation: development and clinical application[J]. Journal of Clinical Microbiology, 2004, 42(12): 5832-5836.
[14] 罗家琴, 王加启, 卜登攀, 等. 饲料中牛、羊、猪、鸡源性成分的PCR检测方法及其应用. 中国农业科学, 2008, 41(7): 2112-2119.
[15] 王金玲, 贾金生, 李俊环, 等. 饲料中鸡源性成分PCR-DHPLC检测方法的建立[J]. 中国兽医学报, 2012, 32(3): 493-496.
[16] GB/T 21103—2007 动物源性饲料中哺乳动物源性成分定性检测方法实时荧光PCR方法[S].
[17] SN/T 2557—2010 畜肉食品中牛成分定性检测方法实时荧光PCR法[S].
Detection of Chicken-Derived Ingredients in Foods by Fluorescence-Based Quantitative Real-Time PCR
FAN Li-li1, LI Pei2, FU Chun-ling1,*, DING Hong-liu2, CHEN Ying2
(1. School of Public Health, Medical College, Soochow University, Suzhou 215123, China; 2. Suzhou Products Quality Supervision and Inspection Institute, Suzhou 215128, China)
Objective: This study is aimed to establish a fluorescence-based real time polymerase chain reaction (PCR) assay for specific detection of chicken-derived ingredients in foods. Methods: A pair of primers and a Taqman probe targeting the conservative regions of the chicken mitochondrial cytochrome b (Cyt b) gene were designed. The assay system was validated with respect to sensitivity and specificity by detecting mixed meat samples and commercial meat products. Results: The assay was found to be highly specific and sensitive as evidenced by showing no amplification of DNA extracted from other meats and by its capability of detecting 3.5 pg/μL of chicken DNA. Its application for detecting mixed samples of chickenderived ingredients and other meats showed high strong anti-interference performance. Conclusion: The PCR system offers the advantages of high specificity and sensitivity as well as rapidity and is applicable to identify meat products adulterated with chicken-derived ingredients.
real-time PCR; chicken; mitochondrial cytochrome b gene; food adulteration
TS207.3
A
1002-6630(2014)02-0248-04
10.7506/spkx1002-6630-201402048
2013-04-22
苏州市科技支撑计划项目(SS201126)
范丽丽(1987—),女,硕士研究生,研究方向为食品卫生。E-mail:letitbe2010214@163.com
*通信作者:傅春玲(1962—),女,副教授,博士,研究方向为营养与食品卫生。E-mail:fuchunling@suda.edu.cn
