阴香花中原花青素的提取工艺
2014-01-17叶春飞
张 镜,叶春飞
(嘉应学院生命科学学院,广东 梅州 514015)
阴香花中原花青素的提取工艺
张 镜,叶春飞
(嘉应学院生命科学学院,广东 梅州 514015)
优化阴香花中原花青素的提取工艺。以经冷冻干燥、粉碎与80目过筛的阴香花粉末为供试物料,丙酮-乙醇混合提取,提取液以铁盐催化显色,测定反应体系的吸光度。在提取溶剂体积分数、pH值、料液比、温度及时间单因素试验基础上进行正交试验优化提取条件。结果表明:以体积分数70%的混合液(70%丙酮-70%乙醇(3∶2))为提取溶剂、pH 2、料液比1∶7.5(g/mL)、提取 温度50 ℃、提取时间2 h提取阴香花原花青素的效果为佳,以此参数条件下提取3次原花青素的提取率为95.37%、得率为9.02%。丙酮是阴香花原花青素提取的有效溶剂,采用优化提取条件可有效的提取阴香花原花青素。
阴香花;原花青素;提取工艺
阴香(Cinnamomum burmannii)为多年生常绿乔木,国内主要分布于广东、福建等省区,其根、茎、叶都可提取药用成分与制造香精等产品的化工原料,树干材质优良可用于家具、建筑及室内装饰等[1-2],是多用途的经济林木树种。阴香树形优美,亦具有良好的保水、保湿功能,是华南地区行道与园林绿化的常见树种,且近年大量用于水源涵养林种植。而且在素有“冬季天然温室”之称的广东境内,阴香树的果实产量高,果实中富含花色苷、原花青素、果胶、油脂类等多种具开发利用价值的天然产物[3-4]。另外,阴香树花量极大,每年3月底至4月初开花时树冠几乎全部为花序覆盖。笔者研究发现阴香花中亦含丰富的原花青素类天然活性物质,亦具有重要的开发利用潜力,但迄今国内外未见有相关的研究报道。研究阴香花原花青素的提取工艺不仅可为阴香花中原花青素的资源化开发利用积累研究资料,亦有助于进一步认识阴香树的综合利用价值。
1 材料与方法
1.1 材料与试剂
采集即将开花的阴香花序,冷冻干燥、粉碎、80目过筛后低温保存备用。
乙醇、丙酮、甲醇、盐酸、乙酸乙酯、正丁醇、硫酸铁铵均为分析纯。
1.2 仪器与设备
JLL28-B低速大容量多管离心机 上海安亭科学仪器厂;BT2K XL冻干机 美国VirTis公司;U-2800紫外-可见分光光度计 日本日立公司;PHS-2C 酸度计 上海沪西分析仪器厂;FA1604A 电子分析天平 上海精天电子仪器有限公司。
1.3 方法
1.3.1 提取效果测定方法
取1 mL原花青素提取液于比色管中,依次加入6 mL的正丁醇-盐酸(95∶5,V/V)溶液及0.2 mL 2%硫酸铁铵溶液,沸水浴40 min后迅速冷却,以蒸馏水代替样液为参比,测定546 nm波长处的吸光度[5],以546 nm波长处的吸光度(A546nm)为衡量提取效果的依据。
1.3.2 提取溶剂筛选
1.3.2.1 提取溶剂与原花青素提取的效果关系
准确称取500 mg阴香花粉末,分别加入70%乙醇、70%甲醇、70%丙酮、乙酸乙酯、无水乙醇、无水甲醇、无水丙酮及水,料液比1∶10(g/mL)、30 ℃提取2 h,4 500 r/min离心20 min,收集上清液,蒸馏水定容100 mL,正丁醇-盐酸法显色,测定A546nm。
1.3.2.2 乙醇-丙酮比例对原花青素提取效果的影响
准确称取500 mg阴香花粉末,70%丙酮-70%乙醇按1∶1、2∶3、3∶2、4∶1及1∶4体积比混合作为原花青素提取用溶液,按料液比1∶10(g/mL)、30 ℃提取2 h,4 500 r/min离心20 min,收集上清液,蒸馏水定容100 mL,正丁醇-盐酸法显色,测定A546nm。
1.3.3 单因素试验
1.3.3.1 提取溶剂
准确称取500 mg阴香花粉末,以70%丙酮-70%乙醇(3∶2,V/V)比例混合液为原花青素提取溶剂。物料按1∶10(g/mL)的料液比分别加入40%、50%、60%、70%、80%、90%及100%的提取溶剂,30 ℃、提取2 h,4 500 r/min离心20 min,收集上清液,蒸馏水定容100 mL,正丁醇-盐酸法显色,测定A546nm。
1.3.3.2 提取时间
准确称取500 mg阴香花粉末,按料液比1∶10(g/mL)加入60%的混合溶剂,30 ℃、分别提取0.5、1.0、1.5、2.0、2.5 h及3 h,4 500 r/min离心20 min,收集上清液,蒸馏水定容100 mL,正丁醇-盐酸法显色,测定A546nm。
1.3.3.3 提取料液比
准确称取500 mg阴香花粉末,分别以料液比1∶5、1∶7.5、1∶10、1∶12.5、1∶15、1∶17.5(g/mL)加入60%混合溶剂,30 ℃、提取2 h,4 500 r/min、离心20 min,收集上清液,蒸馏水定容100 mL,正丁醇-盐酸法显色,测定A546nm。
1.3.3.4 提取液pH值
准确称取500 mg阴香花粉末,以料液比1∶10比例分别加入以HCl或NaOH调pH值为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0及14.0体积分数60%的混合溶剂,30 ℃、提取2 h,4 500 r/min离心20 min,收集上清液,蒸馏水定容100 mL,正丁醇-盐酸法显色,测定A546nm。
1.3.3.5 提取温度
准确称取500 mg阴香花粉末,以料液比1∶10的比例加入60%混合溶剂,分别于30、40、50、60 ℃提取2 h,4 500 r/min离心20 min,收集上清液,蒸馏水定容100 mL,正丁醇-盐酸法显色,测定A546nm。
1.3.4 提取参数正交优化
根据单因素试验结果,选择提取溶剂体积分数、料液比、提取温度、提取时间4个因素进行L9(34)正交试验,正交试验设计见表1。

表1 提取参数正交试验因素与水平Table1 Coded levels for independent variables used in orthogonal array design for optimization of extraction parameters
1.3.5 原花青素的得率
准确称取500 mg阴香花粉末,按照优化条件下离心收集上清液,蒸馏水定容100 mL,正丁醇-盐酸法显色,测定A546nm值。重复提取5次,以下式计算每次提取原花青素的累计提取得率[5]:
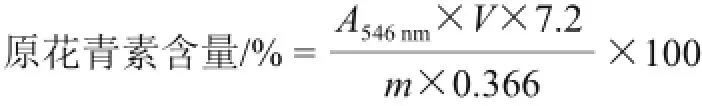
式中:A546nm为546 nm波长处吸光度;V为稀释倍数;m为样品质量/mg。
1.4 数据处理
各处理重复3次,SPSS 11.0进行数据处理,3次数据平均值以Excel作图,以Duncans’法进行差异显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 溶剂筛选
2.1.1 不同溶剂对原花青素的提取效果
由图1可以看出,供试溶剂中以70%丙酮溶液的提取效果最佳,吸光度为0.776,与其余处理的差异极显著(P<0.01)。70%乙醇及70%甲醇次之,两者间无显著差异,提取液的吸光度分别为70%丙酮溶液的27.98%及26.24%。乙酸乙酯、无水乙醇、无水甲醇及无水丙酮的提取效果极差,提取液呈青绿色。水与物料浸泡后呈黏性胶状,不能固液分离,其吸光度按0.000计算。阴香花中胶体物质的吸水量大,吸水后为黏性胶体,与果实胶体特性一致[4],但迄今尚未见植物花中存在大量吸水力强的胶物质的报道。植物材料中的原花青素现多用70%左右的乙醇溶液浸取[6-7],但70%乙醇溶液提取阴香花原花青素的实用价值不大。虽然70%丙酮溶液提取阴香原花青素具有很好的效果,但丙酮的毒性较大,从安全性考虑若适当降低丙酮用量并能获得较好的提取效果,则生产应用价值更大。
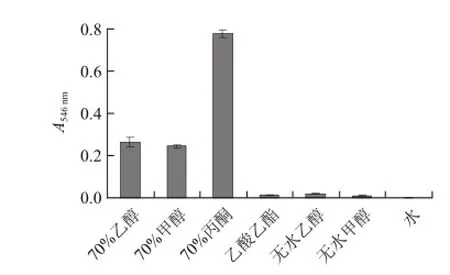
图1 不同溶剂对原花青素的提取效果Fig.1 Effects of different solvents on the extraction efficiency of proanthocyanidins
2.1.2 丙酮-乙醇比例对提取原花青素效果的影响
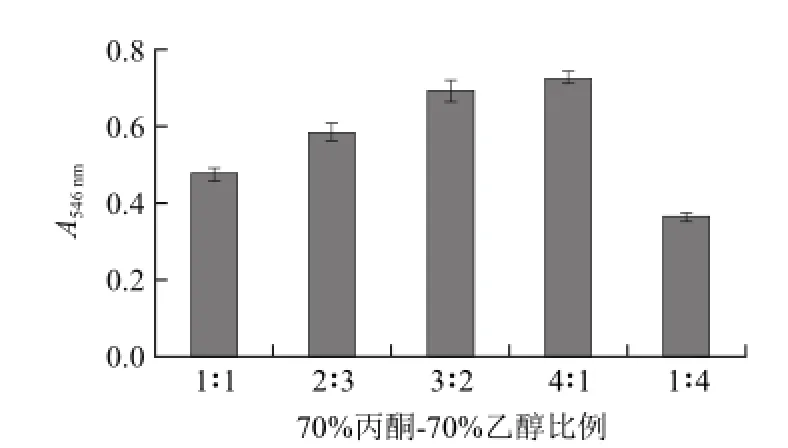
图2 70%丙酮与70%乙醇比例对原花青素提取效果的影响Fig.2 Effects of different ratios between 70% acetone and 70% ethanol on the extraction efficiency of proanthocyanidins
由图2可以看出,以丙酮-乙醇3∶2及4∶1溶液的提取效果为佳,提取液吸光度分别为0.694和0.728,两者差异不显著。丙酮-乙醇3∶2及4∶1溶液提取液吸光度较70%乙醇溶液原花青素提取液的吸光度高165.38%及180.77%,较70%丙酮溶液原花青素提取液的吸光度低11.45%及6.41%。丙酮-乙醇比例为1∶1、2∶3和1∶4比例的效果较差,吸光度与前2比例的差异显著(P<0.05)。考虑到丙酮-乙醇3∶2及4∶1溶液的提取效果较好,且两者差异不显著因,考虑丙酮用量以下试验采用均丙酮-乙醇为3∶2比例的混合液对提取原花青素进行提取。
2.2 丙酮-乙醇混合溶剂体积分数对提取效果的影响
由图3可以看出,随丙酮-乙醇混合液体积分数的提高,提取液的吸光度逐渐增大。以60%及70%混合液提取,提取液的吸光度分别为0.715与0.737,两者无显著差异,混合溶剂体积分数高于70%提取液的吸光度逐渐下降,原花青素的提取效果降低。结果表明较低体积分数的丙酮-乙醇混合溶剂更利于原花青素的提取。提取溶剂体积分数过高,极性较低,物料中极性较高物质的溶解度小而阻碍了原花青素的溶出,也可能直接影响了原花青素从物料中溶出,导致原花青素提取效果不佳。江岩[8]认为高浓度乙醇提取原花青素提取效果不佳的原因可能是一些醇溶性杂质和亲脂性强的成分溶出量增加,从而导致原花青素的提取率降低。故以下试验选择60%的丙酮-乙醇混合溶剂。
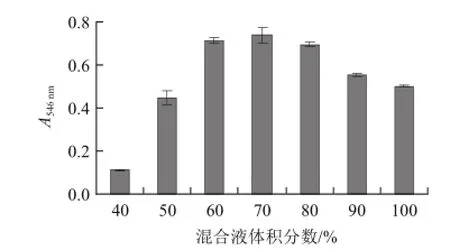
图3 溶剂体积分数对原花青素的提取效果Fig.3 Effect of extraction solvent concentration on the extraction efficiency of proanthocyanidins
2.3 提取时间对提取效果的影响

图4 提取时间对原花青素提取效果的影响Fig.4 Effect of extraction time on the extraction efficiency of proanthocyanidins
由图4可以看出,提取时间30 min及60 min时原花青素溶出量较少,90~180 min时原花青素溶出量大,其中120 min提取液的吸光度0.756为最大,但提取液的吸光度与90 min及180 min均差异不显著。一般植物材料中原花青素的提取随时间的延长,提取率增大,但时间过长提取液中原花青素的分解而逐渐下降,如木槿花、荔枝皮原花青素的提取[9-10],而180 min提取阴香花原花青素提取液的吸光度较90 min的吸光度无显著差异,表明其稳定性较高。
2.4 pH值对提取效果的影响
由图5可以看出,溶液pH 1提取的提取液的吸光度0.730、pH 2的吸光度0.763,相对较高,两者间无显著差异。pH 3~10提取液的吸光度略有下降,pH 11~14内随pH值的升高,提取液的吸光度大幅降低,提取液为黄褐色。结果表明:pH 1~2时阴香花原花青素的提取更佳,但在弱酸、弱碱条件下也能获得较好的效果,仅强碱条件(pH 13~14)对提取极不利,表明阴香花原花青素的酸碱稳定性较好。

图5 pH值对提取效果的影响Fig.5 Effect of pH on the extraction efficiency of proanthocyanidins
2.5 料液比对提取效果的影响
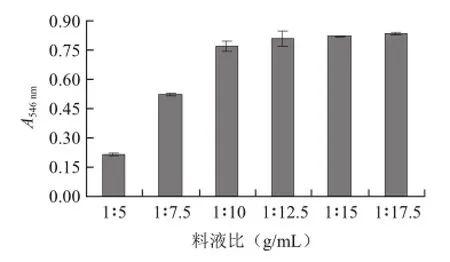
图6 不同料液比与原花青素提取效果的关系Fig.6 Effect of solid/liquid ratio on the extraction efficiency of proanthocyanidins
由图6可以看出,料液比在1∶5~1∶10间随溶剂用量的增大,提取液的吸光度大幅升高,差异极显著。料液比1∶10~1∶17.5间提取液吸光度的差值减小,无显著差异。虽然料液比小于1∶10提取液的吸光度仍有小幅增大,但溶剂消耗量大幅上升,提取液后续干燥的费用明显加大,因而1∶10的料液比更实用。虽然料液比与阴香花原花青素提取效果的关系与地榆根原花青素提取的料液比相当[11],但阴香花中含有较多的胶体物质,物料性质与其有明显的区别,70%乙醇溶液以1∶10的料液比对阴香花原花青素的提取效果却很差。
2.6 提取温度对提取效果的影响
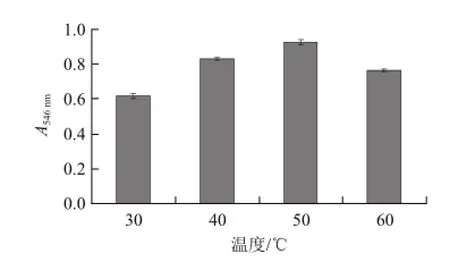
图7 提取温度与原花青素提取效果的关系Fig.7 Effect of extraction temperature on the extraction efficiency of proanthocyanidins
由图7可以看出,提取液的吸光度随温度升高而增加,当提取温度为50 ℃时提取效率最高,提取液的吸光度较加热30、40、60 ℃提取液的吸光度差异极显著。60 ℃加热2 h提取液的吸光度明显下降,可能是阴香花原花青素的热稳定性较差,加热时间较长使部分溶出的原花青素的结构被破坏。温度与阴香花原花青素提取效果的关系与多数文献报道的研究结果接近[12]。
2.7 正交试验
根据单因素试验选择料液比、时间、温度及提取溶液体积分数四因素三水平L9(34)进行参数优化,结果见表2。由表2看出,各因素对原花青素提取效果的影响,由大到小依次为料液比>提取时间>提取温度>提取溶液体积分数,各因素与水平的最佳组合为A2B3C2D1,即提取温度50 ℃、提取时间2 h、丙酮-乙醇混合液积分数70%、料液比1∶7.5。
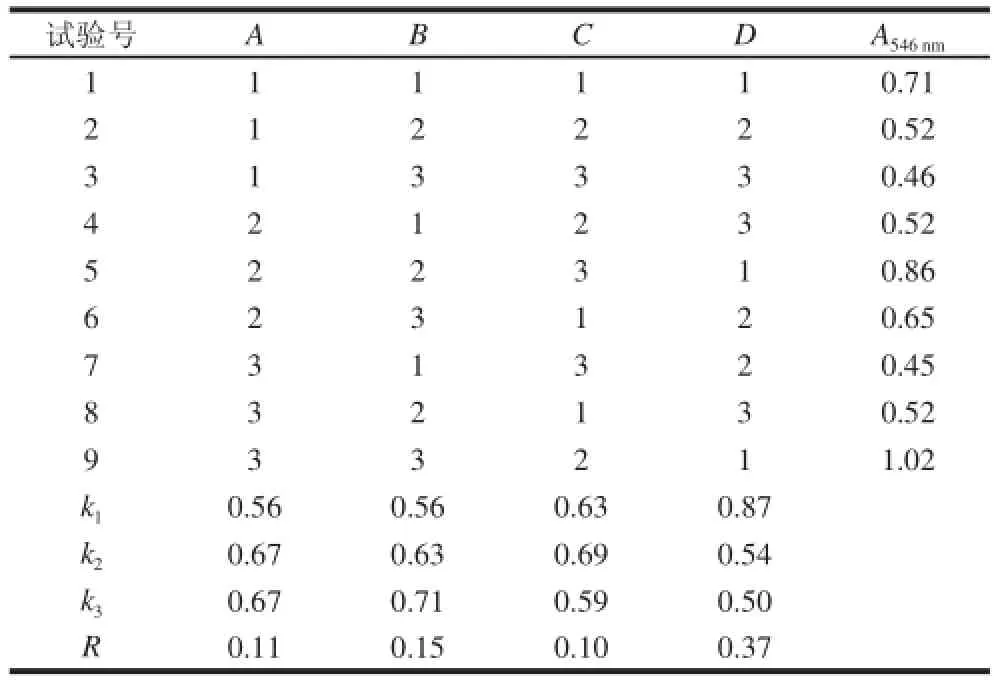
表2 正交试验设计及结果Table2 Orthogonal array design and corresponding results
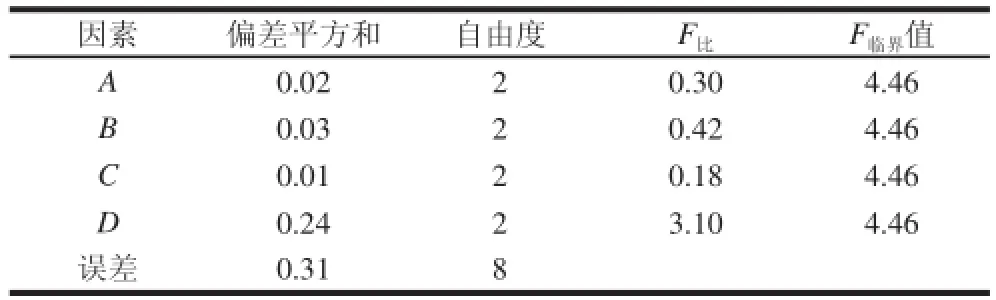
表3 方差分析结果Table3 Analysis of variance for the experiment results of orthogonal array design
2.8 提取次数对提取效果的影响实验
从图8可以看出,经2次及3次浸提原花青素提取率分别为89.07%与95.37%,即3次提取后物料中绝大部分原花青素已被提出,而第4及5次提取液的吸光度已很低,提取获得的原花青素量极少,第5次提取液显色后仅淡红色。经2次及3次提取原花青素的得率分别为8.34%及9.02%,全部5次提取原花青素的累计得率达9.53%,表明阴香花原花青素经2~3次浸提即可。
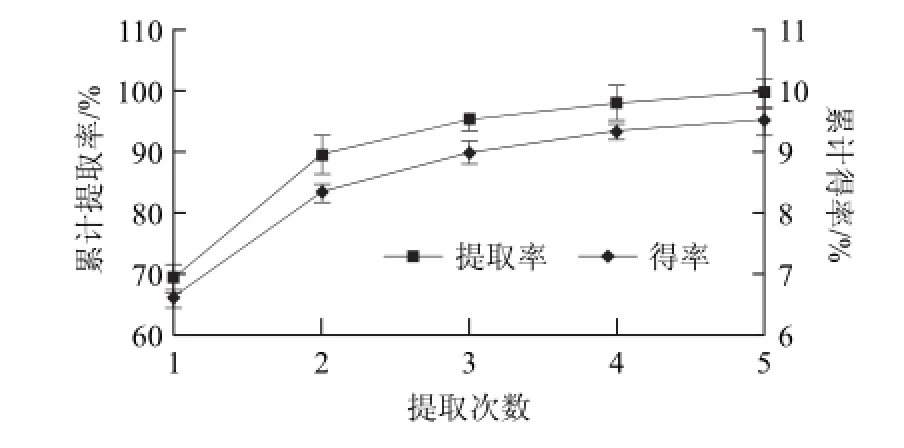
图8 提取次数与原花青素的提取率及得率的关系Fig.8 Effect of number of repeated extractions on the recovery and content of proanthocyanidins in dried flowers of Cinnamomum burmannii
3 讨 论
3.1 阴香花原花青素提取的工艺参数
经单因素和正交试验表明,阴香花原花青素提取的最佳条件为温度50 ℃、时间2 h、提取液为70%丙酮和70%乙醇3∶2混合液(pH 2)、料液比1∶7.5,2次提取原花青素的提取率达90%。
3.2 丙酮作为阴香花原花青素提取的有效溶剂
目前植物活性成分提取主要用乙醇溶液为提取液。但阴香花物料以70%以下乙醇溶液浸泡呈黏性胶体,不能固液分离,而无水乙醇对原花青素的提取效果很差,故阴香花原花青素难以乙醇为溶剂提取。研究表明70%丙酮溶液及60%的丙酮-乙醇混合液(混合液由70%丙酮∶70%乙醇按3∶2比例组成)提取原花青素的效果好,表明丙酮提取对原花青素的作用大。
3.3 阴香花原花青素的开发潜力
原花青素是高效自由基清除与抗氧化活性[3,13]的天然产物,具有增强免疫、抗菌、抗衰老、降低血浆胆固醇等多文献的医疗保健作用[14-22],已在功能性食品与保健品行业大量使用。阴香花原花青素的含量达9.37%,经2次及3次提取原花青素的得率分别为8.34%及9.02%,而木槿花、蓝莓叶的原花青素分别为2.63%及4.17%[9,23]。植物花中均含有多种活性成分,可以推测阴香花除原花青素外,还有多种活性物质。另外,阴香为华南沿海省、区乡土常绿树种且花产量大、不用精细栽植管理,又系废弃的自然资源,以阴香花开发具有医疗保健功能的天然活性物质具一定的潜力。
[1] 刘发光, 李鹏, 王羽梅. 粤北阴香不同器官中精油成分研究[J]. 生物技术, 2007, 24(5): 25-27.
[2] 刘艳清, 汪洪武, 鲁湘鄂. 阴香茎及叶挥发油化学成分的气相色谱-质谱联用分析比较[J]. 时珍国医国药, 2007, 18(10): 2383-2385.
[3] 张镜, 廖富林, 黄思梅, 等. 阴香果实花色苷体外抗氧化活性[J]. 食品科学, 2011, 32(17): 128-132.
[4] 张镜, 朱明睿, 刁树平. 阴香果实主要生物活性成分的提取工艺[J].食品科学, 2013, 34(4): 65-70.
[5] 鲁长征, 任蓓蕾, 山永凯. 沙棘籽中原花青素的分离纯化及抗氧化性的研究[J]. 国际沙棘研究与开发, 2010, 8(3): 11-16.
[6] 陈卫航, 谭美亭, 张婕. 响应曲面法优化莲房原花青素提取工艺研究[J]. 郑州大学学报: 工学版, 2012, 33(2): 31-35.
[7] 董瑞霞, 李立祥, 邢志强, 等. 茶籽壳原花青素提取参数优化[J]. 食品与发酵工业, 2007, 33(12): 142-144.
[8] 江岩. 新疆药桑椹花青素的提取和测定[J]. 食品科学, 2010, 31(14): 93-94.
[9] 张媫, 李瑞光, 陈卫航. 木槿花中原花青素的提取工艺研究[J]. 郑州大学学报, 2009, 30(4): 53-57.
[10] 孙智达, 谢笔钧, 杨尔宁, 等. 荔枝皮原花青素提取、纯化及抗氧化活性研究[J]. 食品科学, 2009, 30(8): 68-71.
[11] 姜贵全, 方桂珍. 地榆根中低聚原花青素的提取工艺[J]. 东北林业大学学报, 2008, 36(1): 41-42.
[12] 谢伟光, 张黎明. 山楂中原花青素提取分离工艺研究[J]. 食品工业科技, 2008(3): 216-219.
[13] 张镜, 刁树平. 海南蒲桃果实原花青素的体外抗氧化活性[J]. 食品科学, 2012, 33(17): 101-105.
[14] 郭卓雨, 高丽萍, 李贞. 葡萄籽原花青素对顺铂诱发小鼠肾毒性的保护作用[J]. 食品科学, 2013, 34(21): 325-328.
[15] 谢文利, 晋玉章, 万宗明, 等. 聚果多酚抗衰老作用的实验研究[J].食品科学, 2009, 30(9): 207-209.
[16] 单静敏, 曹雁平, 肖俊松, 等. 葡萄籽和苹果原花青素对变形链球菌和金黄色葡萄球菌的抑制作用基础研究[J]. 食品科学, 2011, 32(17): 123-127.
[17] YASUDAA A, NATSUMEA M, SASAKIA K, et al. Cacao procyanidins reduce plasma cholesterol and increase fecal steroid excretion in rats fed a high-cholesterol diet[J]. BioFactors, 2008, 33(3): 211-223.
[18] ZHU Qinyan, SCHRAMM D D, HEIDRUN G B, et al. Influence of cocoa flavanols and procyanidins on free radical-induced human erythrocyte hemolysis[J]. Clinical & Developmental Immunology, March, 2005, 12(1): 27-34.
[19] ZHANG Fengjiao, YANG Jingyu, MOU Yanhua, et al. Oligomer procyanidins from grape seeds induce a paraptosis-like programmed cell death in human glioblastoma U-87 cells[J]. Pharmaceutical Biology, 2010, 48(8): 883-890.
[20] DAUGHENBAUGHA K F, HOLEDMESS J, GRAFF J C, et al. Contribution of transcript stability to a conserved procyanidin-induced cytokine response in γδ T cells[J]. Genes and Immunity, 2011(12): 378-389.
[21] MARTINEZ-MICAELO N, GONZ˘LEZ-ABU¸N N, ARD˚VOL A, et al. Procyanidins and inflammation: Molecular targets and health implications[J]. BioFactors, 2012, 38(4): 257-265.
[22] SUN C, MCINTYER K, SALEEM A, et al. The relationship between antiglycation activity and procyanidin and phenolic content in commercial grape seed products[J]. Canadian Journal of Physiology and Pharmacology, 2012, 90(2): 167-174.
[23] 战伟伟, 司振军, 王超萍, 等. 蓝莓叶原花青素提取工艺研究[J]. 粮食与油脂, 2010(6): 39-42.
Extraction of Proanthocyanidins from Flowers of Cinnamomum burmannii
ZHANG Jing, YE Chun-fei
(College of Life Science, Jiaying University, Meizhou 514015, China)
This study was undertaken to optimize the extraction of proanthocyanidins from flowers of Cinnamomum burmannii. The starting raw material, freeze-dried flowers of Cinnamomum burmannii ground and sieved through a 80-mesh sieve, was extracted using acetone-ethanol and the extract was submitted to color development catalyzed by iron salt before measuring the absorbance. Five extraction conditions including extractant concentration, pH, solid-to-solvent ratio, temperature and time were optimized by one-factor-at-a-time and orthogonal array design methods. The optimal extraction efficiency was obtained by three repeated cycles of extraction at 50 ℃ for 2 h using an extractant consisting of 70% acetoneethanol in water, as prepared by mixing 70% acetone and 70% ethanol with a volume ratio of 3:2, with a solid-to-solvent ratio of 1:7.5 (g/mL). Under these conditions, the proanthocyanidin recovery was 95.37%, and the proanthocyanidin content in dried flowers of Cinnamomum burmannii was 9.02%. Thus acetone is an effective solvent for extracting proanthocyanidins from flowers of Cinnamomum burmannii under optimized conditions.
flower of Cinnamomum burmannii; proanthocyanidins; extraction process
Q946.836
A
1002-6630(2014)02-0115-05
10.7506/spkx1002-6630-201402021
2013-07-15
广东省科技计划项目(2009B011300015)
张镜(1957—),男,教授,硕士,研究方向为天然产物与应用微生物。E-mail:zhangcqf@jyu.edu.cn
