超声波辅助酶法分离提取葡萄酒泥酵母SOD工艺条件的优化
2014-01-17杨学山韩舜愈付文力盛文军
杜 娜,杨学山*,韩舜愈,祝 霞,付文力,王 婧,盛文军,张 波
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
超声波辅助酶法分离提取葡萄酒泥酵母SOD工艺条件的优化
杜 娜1,杨学山2,*,韩舜愈1,祝 霞1,付文力2,王 婧1,盛文军1,张 波1
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
以葡萄酒泥酵母为试材,超氧化物歧化酶(SOD)比活力为指标,在超声功率、超声时间、蜗牛酶质量浓度、酶解pH值和酶解温度等单因素试验基础上,采用正交试验优化超声波辅助蜗牛酶法提取SOD的工艺条件。结果表明:提取工艺因素对SOD比活力影响大小顺序为超声时间>蜗牛酶质量浓度>超声功率>酶解pH值>酶解温度,1 g湿酵母悬浮于5 mL 0.2 mol/L的磷酸盐缓冲液,其提取SOD最佳工艺条件为超声功率400 W、超声时间12 min、2.0 mg/100 mL蜗牛酶液1 mL、pH 6.6、温度37 ℃,在此条件下,分离提取得到的SOD比活力达192.27 U/mg。结果表明超声波辅助酶法在葡萄酒泥酵母SOD的提取中具有较高的应用价值。
葡萄酒泥酵母;超氧化物歧化酶;超声波;蜗牛酶
超氧化物歧化酶(superoxide dismutase,SOD)广泛分布于动物、植物和需氧微生物细胞内[1],可维持体内超氧阴离子自由基的动态平衡,防止其对生物体的毒害[2]。SOD制剂在医药、食品及化妆品等方面具有广泛的用途[3]。目前国内利用动物血液制备SOD取得了一定的成果,但存在原料来源受限,产品质量不稳定及潜在安全性风险等问题,因此利用微生物安全性较高、繁殖快、易大规模工业化生产等优点生产SOD成为了研究热点[4-6]。
2011年我国葡萄酒年产量已达1.16×106kL,且保持年均10%~15%的增长速度[7]。在葡萄酿酒过程中会产生总加工酒量2%~4%的葡萄酒泥[8-9],其中含有大量的酵母细胞。大多数生产企业将酒泥酵母直接丢弃或发酵后用作肥料,不仅浪费了宝贵的生物资源,而且会造成环境污染[10]。因此,利用葡萄酒泥酵母分离提取SOD,不仅可以获得良好的经济效益,而且能够有效减轻葡萄酒生产企业的环保压力。
利用葡萄酒泥酵母分离提取SOD国内外尚未见报道。马森等[11]利用超声波辅助提取啤酒废酵母中活性成分,李永霞等[12]采用酶法结合机械破碎酵母提取肽酶,吴桂英等[13]运用高压破碎酵母释放乙醛脱氢酶,曾俊华等[14]介绍了乙酸乙酯处理酵母细胞,再采用挤压法破碎酵母释放腺苷蛋氨酸。结果显示单一的破壁方法效果均不理想。超声波可通过水介质的空化作用,使细胞壁结构发生破碎,释放内容物[15-16]。蜗牛酶是从蜗牛的嗉囊和消化道中制备的混合酶,含有纤维素酶、果胶酶、淀粉酶、蛋白酶等20多种酶,可用于植物及酵母细胞壁的破碎[17]。因此本实验以葡萄酒泥酵母为原料,采用超声波辅助蜗牛酶酶解葡萄酒泥酵母细胞壁分离提取SOD,并对其工艺进行优化,以期为葡萄酒泥酵母资源开发提供理论依据和技术参考。
1 材料与方法
1.1 材料与试剂
葡萄酒泥酵母 甘肃祁连葡萄酒业有限公司。
牛血清白蛋白 美国Pharmacia公司;蜗牛酶 金田生物科技有限公司;SOD活性测定试剂盒 南京建成生物工程有限公司;三羟甲基氨基甲烷(Tris)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、邻苯三酚、柠檬酸钠、山梨醇、Na2HPO4·12H2O、考马斯亮蓝均为国产分析纯。
1.2 仪器与设备
SCIENTZ-D超声波细胞粉碎机 宁波新芝生物科技股份有限公司;SL-1001电子天平 上海民桥精密科学仪器有限公司;TDZ5-WS离心机 湘仪离心机仪器有限公司;HH-6数显恒温水浴锅 国华电器有限公司;PHS-3C pH计 上海雷磁有限公司;808型紫外-可见分光光度计 日本日立公司。
1.3 方法
1.3.1 葡萄酒泥酵母SOD提取工艺流程
葡萄酒泥→预处理→收集湿酵母→加入磷酸盐缓冲液→超声波处理→加入蜗牛酶→保温处理→离心→热变性→离心→提取液→SOD活性及蛋白质含量测定
1.3.2 操作要点
葡萄酒泥酵母预处理:收集足量的葡萄酒泥,与蒸馏水以1∶1比例混合,用80目的筛子进行筛分[18],在4 000 r/min离心20 min,重复上述步骤,直至所得沉淀为白色,上清液无色透明为止,收集沉淀备用;超声波处理:以料液比1∶5(g/mL)将酵母悬浮于0.2 mol/L、pH 5.8的磷酸盐缓冲液中,进行超声波处理;蜗牛酶消化:在超声波处理液中加入质量浓度1.0 mg/100 mL蜗牛酶液(蜗牛酶需用1.0 mol/L山梨醇等渗溶液溶解),控制温度和pH值,酶解2 h,4 000 r/min离心20 min,收集上清液;热变性:上清液45 ℃水浴20 min,4 000 r/min离心15 min,除去杂蛋白,即得SOD液。取样进行SOD活性及蛋白质含量的测定。
1.3.3 单因素试验设计
分别对不同超声功率、超声时间、蜗牛酶质量浓度、酶解pH值和酶解温度进行单因素试验,重复3次。以SOD比活力为指标,为正交试验选择因素水平。
1.3.4 正交试验优化
根据单因素试验结果确定葡萄酒泥酵母中提取SOD的正交试验因素和水平,采用L9(34)正交试验设计,优化超声波辅助蜗牛酶法提取SOD的最优工艺,平行重复2次。
1.3.5 蛋白质含量测定
采用考马斯亮蓝法测定蛋白质含量[19]。通过实验数据绘制的蛋白质标准曲线线性回归方程为:y=0.004 9X-0.006 9(R2=0.998 9)。方程符合测定要求。
1.3.6 SOD酶活力测定
SOD活性测定试剂盒进行 。根据蛋白质含量和酶活力测定值计算SOD比活力。

2 结果与分析
2.1 单因素试验
2.1.1 超声功率对SOD比活力的影响
将1 g湿酵母分别悬浮于5 mL pH 5.8、0.2 mol/L磷酸盐缓冲液中,分别在超声功率为200、300、400、500、600 W条件下处理16 min,再加入质量浓度1 mg/100 mL的蜗牛酶液1 mL,37 ℃保温2 h,离心后热变性除去杂蛋白。SOD比活力测定结果见图1。
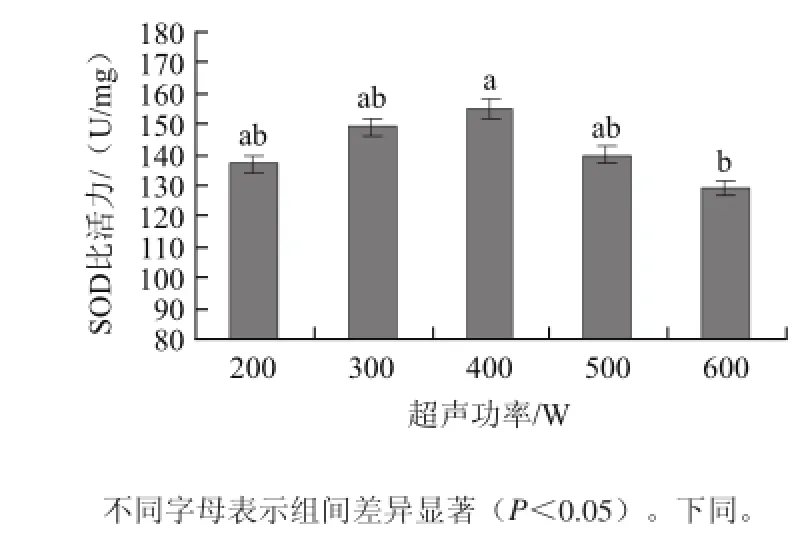
图1 超声功率对SOD比活力的影响Fig.1 Effect of ultrasonic power on SOD specific activity
由图1可知,随着超声功率的增加,SOD比活力在呈先上升后下降趋势,400 W时达到最大值。其原因是,在超声波作用时间一定时,超声波的破碎作用主要取决于超声功率,功率越大,其机械振动强度越大,酵母细胞壁破碎效果就越好,越有利于SOD释放[20-21],但超声功率过大可能会导致酶分子结构变化,从而影响酶的活性。因此,选择最佳超声功率为400 W。
2.1.2 超声时间对SOD比活力的影响
将1 g湿酵母分别悬浮于5 mL 0.2 mol/L、pH 5.8的磷酸盐缓冲液中,在超声功率400 W条件下分别处理8、12、16、20、24 min,再加入质量浓度为1.0 mg/100 mL的蜗牛酶液1 mL,37 ℃保温2 h,离心后热变性除去部分杂蛋白。测定SOD比活力,结果见图2。

图2 超声时间对SOD比活力的影响Fig.2 Effect of ultrasonic treatment time on SOD specific activity
由图2可知,随着超声时间的延长,SOD比活力先不断升高,当超声时间为16 min时达到最大值,随后开始下降。因为适当的超声时间,可以有效破坏酵母细胞壁的结构,有利于SOD释放,但处理时间过长,可能会引起热量积聚或机械剪切作用导致酶结构变化[22],进而影响SOD比活力。因此超声时间可控制在16 min左右。
2.1.3 蜗牛酶液质量浓度对SOD比活力的影响
将1 g湿酵母分别悬浮于5 mL 0.2 mol/L、pH 5.8的磷酸盐缓冲液中,超声功率400 W处理16 min后分别加入质量浓度0.2、0.5、1.0、1.5、2.0 mg/100 mL的蜗牛酶液1 mL, 37 ℃水浴2 h,离心后热变性。SOD比活力测定结果见图3。

图3 蜗牛酶质量浓度对SOD比活力的影响Fig.3 Effects of snailase dosage on SOD specific activity
由图3可知,SOD比活力随着蜗牛酶量的增加而增加,当蜗牛酶质量浓度增加至1.5 mg/100 mL时,SOD比活力达到最大值。当蜗牛酶量再增加时,SOD比活力开始下降。因为蜗牛酶中含有蛋白酶,过量的蜗牛酶在水解酵母细胞壁的同时,也可降解SOD[23-24],这也是单一大量使用蜗牛酶进行酵母细胞破碎提取蛋白质类效果不佳的原因之一。综合考虑结果及成本等因素,故最终选择1.5 mg/100 mL蜗牛酶液为最佳质量浓度。
2.1.4 酶解pH值对SOD比活力的影响
将1g湿酵母分别悬浮于5 mL pH值为5.4、5.8、6.2、6.6、7.0的0.2 mol/L磷酸盐缓冲液,在超声功率400W处理16 min后,加入质量浓度1.5 mg/100 mL蜗牛酶液1 mL,37 ℃保温2h,离心后热变性。SOD比活力测定结果见图4。

图4 酶解pH值对SOD比活力的影响Fig.4 Effect of initial hydrolysis pH on SOD specific activity
由图4可知,pH值对SOD比活力影响较大,当pH值小于或大于6.2时,酶的比活力都有所下降。这是由于当pH值为6.2时,既介于蜗牛酶的作用pH值(5.5~7.2)范围内[25-26],使酵母细胞破碎效果较好,又对SOD的活性影响较小,当pH值高于或低于6.2,SOD稳定性会受到一定影响,进而导致SOD比活力降低。
2.1.5 酶解温度对SOD比活力的影响
将1g湿酵母悬浮于5 mL 0.2 mol/L、pH 6.2的磷酸盐缓冲液中,超声功率400W处理16 min后加入质量浓度1.5 mg/100 mL蜗牛酶液1 mL,分别于31、34、37、40、43 ℃水浴2h,离心后热变性,SOD比活力测定结果见图5。

图5 酶解温度对SOD比活力的影响Fig.5 Effect of hydrolysis temperature on SOD specific activity
由图5可知,随着酶解温度升高,SOD比活力逐渐增高,在37 ℃时达到最大值,超过37 ℃后酶活性开始下降,证明37 ℃为蜗牛酶液的最佳酶解温度,与李永霞[12]、张培德[17]等的研究结果一致。
2.2 正交试验优化
根据单因素试验结果,选择对SOD比活力影响较大的超声功率、超声时间、蜗牛酶质量浓度和酶解pH值进行L9(34)正交试验,试验设计及结果见表1。计算每一试验组合的SOD比活力,并对试验结果进行统计分析,得到最优组合后进行验证实验,确定超声波辅助蜗牛酶法提取葡萄酒泥酵母SOD的最优工艺条件。

表1 L 1 L9(34)正交试验设计及结果Table1 Lle1 L9(3(34) orthogonal array design arrangement and experimental results ) orthogonal array design arrangement and experimental results
从表1可以看出,分离提取葡萄酒泥酵母SOD影响因素的主次顺序为B>C>A>D,即超声时间>蜗牛酶质量浓度>超声功率>酶解pH值。由K值可以确定最佳工艺组合为A2B1C3D3,即超声功率400 W、超声时间12 min、质量浓度2.0 mg/100 mL蜗牛酶液1 mL、酶解pH 6.6。
用SPSS 17.0统计软件对试验结果进行方差分析,其结果见表2。

表2 正交试验方差分析Table2 Analysis of variances for SOD specific activity with various extraction conditions
由表2可知,因素A、B、C在P<0.05的水平上有显著性差异,因素D酶解pH值不显著。
2.3 验证实验
由于L9(34)正交试验得到的最优组合在L9(34)正交试验设计中未出现,因而需对正交试验得到的最优组合进行验证实验。1 g湿酵母分别悬浮于5 mL 0.2 mol/L的磷酸盐缓冲液中,在超声功率400 W、超声时间12 min、质量浓度2.0 mg/100 mL蜗牛酶液1 mL、酶解pH 6.6、酶解温度37 ℃条件下提取SOD,重复3次。测得平均SOD比活力为192.27 U/mg,比正交试验中最优组合得到的酶比活力高,可见正交试验方差分析所确定的为最佳工艺参数。
3 结 论
本实验以葡萄酒泥酵母为原料,通过不同单因素条件下的提取结果,对超声波辅助蜗牛酶法提取葡萄酒泥酵母SOD主要影响因素进行L9(34)正交试验优化,确定的最优工艺参数为1 g湿酵母分别悬浮于5 mL 0.2 mol/L的磷酸盐缓冲液中,超声功率400 W、超声时间12 min、质量浓度2.0 mg/100 mL蜗牛酶液1 mL、酶解pH 6.6、酶解温度37 ℃,在此条件下提取SOD,所得平均SOD比活力为192.27 U/mg。该工艺具有工艺简单、条件温和、产品安全性高等特点,具有一定的应用前景。
[1] JOSE R P, AlFONSO C, RAQUELV, et al. Mitochondrial 1-cysperoxiredoxin/thioredoxin system protects manganese-containing superoxide dismutase (Mn-SOD) against inactivation by peroxynitrite in Saccharomyces cerevisiae[J]. Nitric Oxide, 2010, 23(1): 206-213.
[2] STEFANO R, DANIELA U, ALBERTO A, et al. Secretion of Kluyveromyces lactis Cu/Zn SOD: strategies for enhanced production[J]. Applied Microbiology and Biotechnology, 2010, 86(23): 871-878.
[3] IMEN H M, NEJIB M, DANIELA F, et al. Purification and characterization of a Cu, Zn-SOD from garlic (Allium sativum L.). Antioxidant effect on tumoral cell lines[J]. Applied Biochemist Biotechnology, 2007, 143(7): 129-141.
[4] KOLEVA D I, DOCHEVA G P, PETROVA V Y, et al. Superoxide dismutase enzymes in oxidative type yeast H. polymorpha[J]. Biotechnology & Biotechnological Equipment, 2010, 24(1): 488-492.
[5] 王岁楼, 张平之, 张欣. 从微生物中提取SOD的研究[J]. 工业微生物, 1997, 27(2): 45-47.
[6] PETROVA V Y, UZUNOV Z G, KUJUMDZIEVA A V. Peroxisomal localion of Mn-SOD enzyme in saccharomyces cerevisiae yeasts: in silico analysis[J]. Biotechnology & Biotechnological Equipment, 2009, 23(4): 1531-1536.
[7] 唐文龙. 未雨绸缪. 顺应行业深度调整: 2012中国葡萄酒市场回眸与展望[J]. 中国酒, 2013, 7(1): 31-32.
[8] 李莹, 苏婷婷, 王战勇. 葡萄加工副产品的综合利用研究[J]. 食品科学, 2006, 27(4): 106-108.
[9] LIAU Y J, WEN L, SHAW J F, et al. A highly stable cambialisticsuperoxide dismutase from Antrodia camphorata: expression in yeast and enzyme properties[J]. Journal of Biotechnology, 2007, 131(1): 84-91.
[10] 刘军, 李进, 曲健, 等. 葡萄皮渣的综合利用[J]. 中外葡萄与葡萄酒, 2006(3): 51-53.
[11] 马森, 卢家炯, 初兰娜, 等. 超声波辅助提取啤酒废酵母中活性成分的研究[J]. 四川食品与发酵, 2008, 44(6): 10-13.
[12] 李永霞, 曾海英, 秦礼康. 酵母细胞破碎条件优化及高肽酶菌株筛选[J]. 食品科学, 2010, 31(17): 302-306.
[13] 吴桂英, 吴元欣, 赵玉凤, 等. 破碎酵母释放乙醛脱氢酶的研究[J].酿酒科技, 2006, 27(11): 21-23.
[14] 曾俊华, 王昌禄, 陈容容, 等. 破碎酵母释放腺苷蛋氨酸的研究[J].中国食品添加剂, 2005(2): 24-26.
[15] 江学斌, 陈颖恒, 冯燕平, 等. 蜡样芽孢杆菌的破碎条件及对SOD活性的影响[J]. 广东化工, 2010, 37(5): 78-79.
[16] 林松毅, 李海霞, 平红, 等. 超声波破壁释放啤酒废酵母细胞中核糖核酸的实验研究[J]. 食品科技, 2009, 34(5): 107-109.
[17] 张培德, 胡琛, 余文博. 添加蜗牛酶对纤维素酶产生菌发酵的影响初探[J]. 工业微生物, 2000, 30(4): 6-9.
[18] 赵光远, 付扬志. 啤酒酵母自溶物乳酸发酵饮料的研究[J]. 食品科学, 2001, 22(4): 57-58.
[19] TRAYANA N, PAVLINA D A, VESELA M, et al. Purification and partial characterization of Cu/Zn superoxide dismutase from Kluyveromyces marxianusyeast[J]. Journal of Chromatography B, 2009, 87(7): 3529-3536.
[20] 刘进杰, 张玉香, 冯志彬, 等. 超声波提取莲花粉多糖工艺[J]. 食品科学, 2011, 32(18): 44-48.
[21] 于明, 朱文学, 郭菡, 等. 响应面分析法优化超声提取槐豆胶工艺[J].食品科学, 2013, 34(2): 114-118.
[22] 李佳, 吴朝霞, 张旋, 等. 响应面优化提取决明子游离蒽醌工艺[J].食品科学, 2011, 32(16): 192-195.
[23] 赵宏宇, 李珺, 赵玥, 等. 4种酵母基因组提取方法的比较[J]. 食品科学, 2011, 32(9): 170-173.
[24] 杜木英, 陈娟, 阚建全, 等. 青稞酒曲中酿酒酵母与假丝酵母原生质体形成与再生条件的研究[J]. 食品科学, 2007, 28(9): 378-383.
[25] 金鑫, 张振海, 朱静, 等. 响应面法优化纳米二氧化硅固体分散技术辅助酶解制备染料木素[J]. 药学学报, 2012, 47(4): 522-528.
[26] 周连文, 张存兰, 刘新华. 酶辅助超声波提取何首乌多糖及其抗氧化性研究[J]. 食品科技, 2008, 33(17): 170-173.
Optimization of Process Conditions for Ultrasonic-Assisted Enzymatic Extraction of Superoxide Dismutase from Waste Wine Yeast
DU Na1, YANG Xue-shan2,*, HAN Shun-yu1, ZHU Xia1, FU Wen-li2, WANG Jing1, SHENG Wen-jun1, ZHANG Bo1
(1. College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China; 2. College of Life Science and Technology, Gansu Agricultural University, Lanzhou 730070, China)
The current work was designed to establish an optimal procedure for the extraction of superoxide dismutase (SOD) from waste wine yeast by ultrasonic-assisted snailase hydrolysis. Five process parameters, ultrasonic power, radiation time, enzyme concentration, pH and temperature were optimized by one-factor-at-a-time and orthogonal array design. The effects of these variables on SOD specific activity in extracts decreased in this order: radiation time > enzyme concentration >ultrasonic power > pH > hydrolysis time. The optimal extraction conditions were found to be ultrasonic pretreatment at a power of 400 W for 12 min and subsequent hydrolysis with 1 mL of 2.0 mg/100 mL snailase solution at 37 ℃ with an initial pH of 6.6. Under these optimal conditions, the specific activity of SOD was 192.27 U/mg. The ultrasonic-assisted snailase hydrolysis procedure deserves further application in the production of SOD from waste wine yeast.
wine yeast; superoxide dismutase (SOD); ultrasound; snailase
TS261.9
A
1002-6630(2014)02-0087-04
10.7506/spkx1002-6630-201402016
2013-01-05
甘肃省科技支撑计划项目(1104NKCA080)
杜娜(1988—),女,硕士研究生,研究方向为农产品加工利用。E-mail:dnxiaole88@163.com
*通信作者:杨学山(1977—),男,讲师,硕士,研究方向为生物化学与生物产品开发。E-mail:yangxs@gsau.edu.cn
