近距离放疗联合间歇性内分泌治疗在局限性前列腺癌治疗中的应用
2014-01-17张国辉姜涛李志辉郑清友关亚伟朱立夏王金萍贾卓敏高峰
张国辉 姜涛 李志辉 郑清友 关亚伟 朱立夏 王金萍 贾卓敏 高峰
北京军区总医院1泌尿外科,2保健科,北京 100700
近距离放疗联合间歇性内分泌治疗在局限性前列腺癌治疗中的应用
张国辉1姜涛2#李志辉1郑清友1关亚伟1朱立夏1王金萍1贾卓敏1高峰1
北京军区总医院1泌尿外科,2保健科,北京 100700
目的分析比较近距离125I粒子置入联合间歇性内分泌疗法(intermittent hormonal therapy,IHT)在局限性前列腺癌治疗中的效果。方法回顾2003年1月至2013年7月期间未接受根治性前列腺切除而接受治疗满5年的136例局限性前列腺癌患者,按治疗方式分为单纯间歇性内分泌治疗(A组,46例)、单纯近距离125I粒子置入(B组,42例)和近距离125I粒子置入+间歇性内分泌治疗(C组,48例)三组,分析比较三组患者的治疗无效率、5年无事件生存率和5年生存率。结果A组、B组、C组治疗无效率分别为17.39%、16.67%、2.08%,5年无事件生存率分别为36.96%、66.67%、87.50%,5年生存率分别为50.00%、73.81%、93.75%。C组的治疗无效率明显低于A组和B组,差异有统计学意义(P<0.05);C组的5年无事件生存率和5年生存率明显高于A组和B组,差异均有统计学意义(P<0.05);C组的不良反应发生率明显低于B组,差异有统计学意义(P<0.05)。结论
近距离125I粒子置入联合间歇性内分泌治疗作为局限性前列腺癌的综合治疗手段,可以增加治疗有效率、提高无事件生存率和生存率,是局限性前列腺癌安全有效的治疗方法。
近距离125I粒子置入;间歇性内分泌治疗;局限性前列腺癌
Oncol Prog,2014,12(1)
前列腺癌在我国的发病率呈逐年增高的趋势[1],根治性前列腺切除、外放射治疗及近距离放射治疗都是局限性前列腺癌行之有效的根治治疗方法[2]。为提高放射性粒子组织间置入治疗的效果,近距离125I粒子置入联合间歇性内分泌疗法已开始应用于局限性前列腺癌的治疗,并取得较好的疗效。回顾性分析136例未接受根治性前列腺切除,而采用单纯间歇性内分泌治疗、单纯近距离125I粒子置入、近距离125I粒子置入+间歇性内分泌治疗满5年的局限性前列腺癌患者,以评判近距离125I粒子置入联合间歇性内分泌疗法治疗局限性前列腺癌的临床疗效,现报道如下:
1 资料与方法
1.1 临床资料
收集北京军区总医院自2003年1月至2013年7月未接受根治性前列腺切除的局限性前列腺癌患者共226例,剔除治疗未满5年的患者,剩余136例患者,根据采用的治疗方式分为:单纯间歇性内分泌治疗组(A组)、单纯近距离125I粒子置入组(B组)、近距离125I粒子置入+间歇性内分泌治疗组(C组)三组。患者年龄在52~89岁,平均72岁。所有患者均按照诊疗标准进行直肠指诊,并经超声引导下前列腺穿刺活检,病理检查证实为前列腺腺癌,全身骨扫描、胸片、盆腔CT或MRI等检查显示癌肿未超出前列腺包膜,未发现转移灶,均为局限性前列腺癌(T1~2N0M0)。其中PSA≤10 ng/ml者19例(13.97%),10 ng/ml<PSA≤20 ng/ml者94例(69.12%),PSA>20ng/ml者23例(16.91%);Gleason评分3~8分,其中≤7分者112例(82.35%),>7分者24例(17.65%)。参照纽约Mount Sinai医院风险分级系统[3],中、低危患者110例(80.88%),高危患者26例(19.12%)。136例患者在进行以上治疗前均未进行其他治疗。三组患者治疗前的临床特征见表1。经统计分析,任何两组间在平均年龄、治疗前前列腺平均体积、治疗前平均血清PSA及风险分级所占例数等方面的差异均无统计学意义(均P>0.05),具有可比性。
1.2 治疗方法和疗效评价
136例均为拒绝或不能耐受前列腺癌根治手术治疗的患者。根据疾病进展、身体状况、年龄、患者及其家属意愿等,分别采用以下三种方式进行治疗。
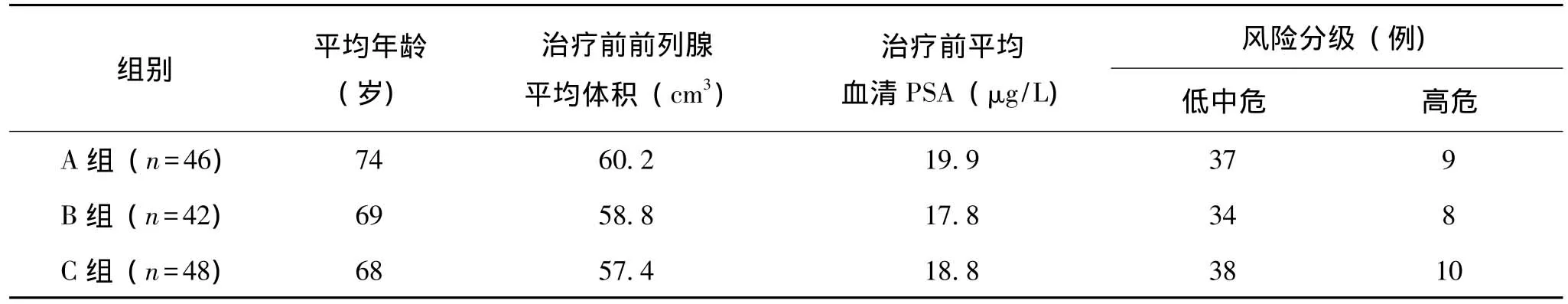
表1 A、B、C三组患者治疗前的临床特征
A组:46例采用药物去势联合抗雄激素治疗的全雄激素阻断治疗,即促黄体激素释放激素(LHRH)类似物(皮下注射戈舍瑞林3.6 mg或亮丙瑞林3.757 mg,每28天1次)+抗雄激素药物(口服比卡鲁胺50mg、qd或氟他胺250 mg、tid)。用药期间每月监测血清PSA,待PSA≤0.2 ng/ml持续2~3个月,且持续用药至少6个月后终止内分泌治疗,进入间歇期。间歇期每月复查血清PSA,每3~6个月复查前列腺MRI及骨扫描,以观察PSA变化、局部及远处转移灶的情况,同时观察并发症。根据复查情况确定IHT停用和继续应用的时间。如果PSA持续升高且>4 ng/ml,则重新启用内分泌治疗[4]。血睾酮达到去势水平,间隔两周连续3次PSA较基础值升高50%以上,认为疾病进展或临床症状加重,此治疗失败。经过1年的治疗,血清PSA不能下降到治疗前的50%,且有局部或远端进展,经查血清睾酮已达到去势水平(<50 ng/dl),则考虑为雄激素非依赖前列腺癌,单纯间歇性内分泌治疗无效。
B组:42例采用单纯近距离125I粒子置入。术前采用MRI扫描,应用三维治疗计划系统作术前预计划,确定治疗剂量及粒子数量,术前清洁灌肠。使用由美国SSGI公司提供放射性粒子三维治疗计划系统和质量验证系统,美国Mick Radio-Nuclear公司提供的前列腺穿刺固定器、模板、步进器、18G粒子置入针和Mick枪等辅助设备,丹麦B-K公司提供的配有直肠探头的超声诊断仪。中国原子能研究院提供125I放射性粒子(0.8 mm×0.45 mm,镍钛合金包壳,放射性活度为0.35~0.50 mCi,辐射半径1.70 cm,半衰期60 d,失效期180 d)。患者给予连续硬模外麻醉,截石位,放置导尿管气囊注水20 ml固定于腹壁,气囊标识前列腺近端。将前列腺穿刺固定器与手术台连接,固定步进器模板及直肠超声探头,将探头置于前列腺精囊交界部,获取第一帧图像,然后利用步进器移动探头,由内而外,连续获取前列腺5 mm间距横断面图像,三维治疗计划系统绘制重建前列腺三维形态并自动生成符合处方剂量的粒子分布图,人工调整粒子分布,前列腺组织间照射剂量145 Gy,尿道周围剂量≤80 Gy,直肠周围剂量≤60 Gy。超声引导下按模板前列腺穿刺并置入125I粒子,术后复查CT进行剂量分布评估。术后每月复查血清PSA,连续3次 PSA值高于最低点,即为治疗失败,其余复查方法与A组相同。治疗后复查血清PSA不能下降到治疗前的50%,且有局部或远端进展者,定义为单纯近距离125I粒子置入治疗无效。
C组:48例施行近距离125I粒子置入+间歇性内分泌治疗。近距离125I粒子置入方法与B组相同,间歇性内分泌治疗用药方法与A组相同,用药开始时间为近距离放射治疗前2~3个月。治疗后评估及复查与A组相同。
1.3 统计学方法
采用非随机同期对照研究,分别计算、比较三组间的无效率、5年无事件生存率(5年内未发生转移或复发事件的患者比例)、5年生存率、不良反应发生率,采用SPSS17.0统计软件进行统计学分析,3组间计数资料比较采用χ2检验或Fisher′s确切概率法,以P<0.05为差异有统计学意义。若P<0.05,再进一步进行两两比较,以P<0.025为差异有统计学意义。
2 结果
2.1 术后随访情况
A组采用药物治疗后,8例(17.39%)经过1年的治疗,血清PSA未下降至治疗前的50%,且有局部进展或远处转移,经查血清睾酮已达到去势水平(<50 ng/dl),确认为雄激素非依赖前列腺癌而放弃内分泌治疗。其余38例(82.61%)在用药后平均3.25(2~9)个月,PSA降至0.2 ng/ml以下,并于随后的2~3个月停药,平均用药时间为6.86(6~10)个月。治疗5年后,17例内分泌治疗停止后未出现PSA再次升高或继续间歇性内分泌治疗仍处于激素依赖状态,5年无事件生存率为36.96%(17/46)。21例于治疗中转变为激素难治性前列腺癌,其中有17例为中、低危前列腺癌患者,4例为高危患者。23例患者5年内死于前列腺癌,5年生存率50.00%(23/46)。
B组采用单纯近距离125I粒子置入,术后28.57%(12/42)的患者出现血尿,45.24%(19/ 42)的患者出现轻至中度尿路刺激症状,21.43% (9/42)的患者出现直肠刺激征,14.76%(6/42)的患者出现血便,无尿道狭窄及尿失禁等并发症出现。7例(16.67%)治疗后血清PSA未下降至治疗前的50%,并发生局部进展或远处转移。术后5年内28例患者PSA降至最低水平后未再升高,其中20例患者的PSA降至0.2 ng/mL以下,5年无事件生存率为66.67%(28/42)。10例患者治疗后短期内出现不同程度的缓解,但于术后12~24个月(平均18.00个月)出现复发或远处转移,其中有8例为中、低危患者,2例为高危患者。11例患者于术后5年内死于前列腺癌,5年生存率73.81%(31/42)。
C组施行近距离125I粒子置入+间歇性内分泌治疗,手术方式与B组相同,术后10.42%(5/48)的患者出现血尿,25.00%(12/48)的患者出现轻至中度尿路刺激症状,6.25%(3/48)的患者出现直肠刺激征,2.08%(2/48)的患者出现血便,无出现尿道狭窄及尿失禁等并发症的患者。1例(2.08%)治疗后血清PSA未下降至治疗前的50%,且治疗1年后血清睾酮已达到去势水平(<50 ng/ dl),有局部或远处进展,放弃继续内分泌治疗。47例(97.92%)患者术后2~4个月PSA均降到0.2 ng/ml以下,其中24例的PSA降至0 ng/ml。对随访中22例再次出现PSA升高的患者,继续给予间歇性内分泌治疗,其中17例患者PSA维持在0.2 ng/ml以下,5例转变为雄激素难治性前列腺癌,其中4例为中、低危前列腺癌患者,1例为高危患者。5年无事件生存率为87.50%(42/48)。3例患者术后5年内死于前列腺癌,5年生存率93.75%(45/48)。
2.1.1 治疗无效率三种治疗方案的疗效见表2,其中联合治疗组的治疗无效率最低,为2.08%(1/ 48)。经统计学比较,3组间的治疗无效率差异有统计学意义(χ2=6.709,P=0.035);进一步进行两两比较,联合治疗组无效率明显低于单纯近距离放疗组和单纯内分泌治疗组,差异有统计学意义(P<0.025),单纯近距离放疗组和单纯内分泌治疗组的无效率差异无统计学意义(P>0.025)。

表2 三种前列腺癌治疗方案的疗效评价
2.1.2 5年无事件生存率三组患者治疗后5年的无事件生存及死亡情况见表3,其中联合治疗组5年无事件生存率最高,为87.50%(42/48)。经统计学比较,3组间差异有统计学意义(χ2=26.227,P=0.00);联合治疗组分别与单纯近距离放疗组和单纯内分泌治疗组比较,差异均有统计学意义(P<0.025);单纯近距离放疗组与单纯内分泌治疗组比较,差异有统计学意义(P<0.025)。
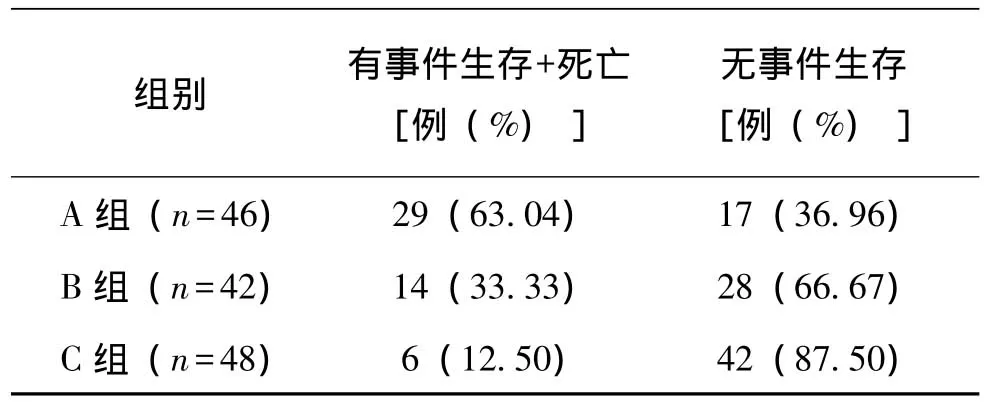
表3 三组患者治疗后5年的无事件生存和死亡例数及百分比
2.1.3 5年生存率三组患者治疗后5年的生存及死亡情况见表4,其中联合治疗组的5年生存率最高,为93.75%(45/48)。经统计学比较,3组间差异有统计学意义(χ2=22.734,P=0.000);联合治疗组分别与单纯近距离放疗组和单纯内分泌治疗组比较,差异均有统计学意义(P<0.025);单纯近距离放疗组与单纯内分泌治疗组比较,差异有统计学意义(P<0.025)。

表4 三组患者治疗后5年的生存及死亡情况
2.2 不良反应发生率
联合治疗组和单纯近距离放疗组术后出现血尿反应的比例分别为10.42%(5/48)、28.57% (12/42);出现轻至中度尿路刺激症状的比例分别为25.00%(12/48)、45.24%(19/42);出现直肠刺激征的比例分别为6.25%(3/48)、21.43% (9/42);出现血便的比例分别为2.08%(1/48)、14.76%(6/42);两组患者均无尿道狭窄及尿失禁等并发症出现(表5)。多数患者症状随访1周至1年后缓解。联合治疗组与单纯近距离放疗组比较,联合治疗组不良反应发生率低,差异有统计学意义(P<0.05)。
3 讨论
20世纪80年代,放射性粒子治疗前列腺癌在西方国家得到广泛应用,我国于2002年开始应用于临床,取得了很好的局部控制疗效[5]。随着计算机治疗计划系统的运用,近10年来在直肠超声引导下,经会阴穿刺,放射性粒子置入前列腺,三维适形内放疗治疗前列腺癌得到了很大的发展,并且疗效也进一步提高。随着近距离放疗发展,国外自20世纪90年代起治疗例数显著增加,同时根治手术比例减少[6]。现在放射性粒子置入治疗已经可以达到与根治性前列腺切除术和外放射治疗类似的效果[7],但是治疗的效果与患者的风险级别相关,美国近距离放疗协会[8]和中国泌尿外科疾病诊治指南(2011)[9]都推荐单一放射性粒子置入术治疗前列腺癌的适应证为低危前列腺癌患者。
近年来间歇性内分泌治疗受到越来越多人的关注,实验研究提示,周期性地进行IHT可恢复肿瘤细胞的凋亡能力,从而延缓雄激素非依赖的产生;临床观察也提示IHT可能能够延缓前列腺癌进展为雄激素非依赖状态,延长生存期,提高生活质量(恢复性欲、性能力等)以及减少相关的治疗费用和不良反应[10]。
联合内分泌治疗的放射治疗最早来自于Green等[11]采用雌二醇联合放疗治疗进展期前列腺癌,其结果是减小了肿瘤的体积,降低了局部进展率。放疗联合内分泌治疗的理论基础是基于放疗可以达到杀癌、减瘤的目的,配合内分泌治疗,能够进一步提高5年无事件生存率和5年生存率[12]。Lee等[13]运用内分泌和粒子置入术治疗中高危前列腺癌患者,多因素分析发现结合内分泌治疗能够显著改善5年生存率,使用内分泌与否,其5年生存率分别为79%和54%。Stock等[14]报道通过联合近距离放疗、内分泌治疗和外放疗治疗132位高危前列腺癌患者,5年PSA无进展生存率为86%,效果良好。本回顾性分析的结果显示联合治疗组、单纯近距离放疗组、单纯内分泌治疗组无效率分别为2.29%、16.67%、17.39%,5年无事件生存率分别为87.50%、66.67%、36.96%,5年生存率分别为93.75%、73.81%、50.00%,联合治疗组无效率明显低于单纯近距离放疗组和单纯内分泌治疗组,联合治疗组5年无事件生存率和5年生存率明显高于单纯近距离放疗组和单纯内分泌治疗组,差异均有统计学意义(P<0.05),提示在降低无效率、提高5年无事件生存率和5年生存率方面,前列腺放射性粒子置入联合间歇性内分泌治疗均较单纯粒子置入和单纯间歇性内分泌治疗明显,无论是否为高危患者均可能会从联合治疗中获益[15-16]。笔者认为这可能与患者内分泌治疗后前列腺体积缩小,避免了粒子置入过程中因为前列腺体积大而造成耻骨弓阻挡穿刺针,使得部分前列腺不能按治疗计划置入粒子有关,还可能与粒子置入术后继续内分泌治疗使前列腺体积进一步缩小,弥补了随着时间延长粒子逐渐衰减使前列腺局部放射剂量不足的情况,从而尽可能的保持了粒子治疗的匹配剂量有关。
前列腺放射性粒子置入内放疗可产生放射性前列腺炎、尿道炎、直肠炎及性功能相关并发症。研究表明置入后剂量(包括前列腺、尿道、血管神经束、球部尿道及直肠前壁部位的照射剂量)与治疗并发症有关。肿瘤分期、PSA值及Gleason评分与并发症无关。Gelblum等[17]报道了693例粒子置入后2个月、6个月和1年后,泌尿系统不良反应发生率分别为80.5%、37.2%和20%,直肠出血发生率为9%。本研究显示联合治疗组和单纯近距离放疗组术后出现血尿反应分别为10.42%(5/ 48)、28.57%(12/42);轻至中度尿路刺激症状分别为25.00%(12/48)、45.24%(19/42);直肠刺激征分别为6.25%(3/48)、21.43%(9/42);血便分别为2.08%(1/48)、14.76%(6/42),两组均无尿道狭窄及尿失禁等并发症出现,联合治疗组不良反应发生率较单纯近距离放疗组低,差异有统计学意义(P<0.05)。笔者认为这可能与患者内分泌治疗后前列腺体积缩小,粒子置入数量减少,置入后剂量降低有关。
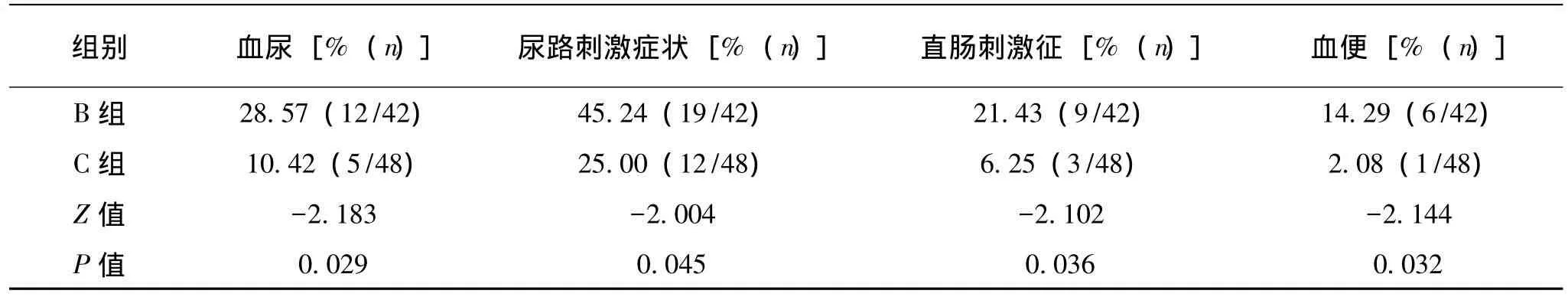
表5 联合治疗组和单纯近距离放疗组的早期泌尿系统不良反应发生率比较
本分析提示125I放射性粒子置入联合间歇性内分泌疗法治疗局限性前列腺癌,可以减少放射剂量,缩小放射野,降低费用,减少放射及内分泌治疗引起的不良反应,同时可以降低治疗的无效率、提高患者的5年无事件生存率和5年生存率。综合其他相关实验研究及临床观察,提示125I粒子置入联合间歇性内分泌治疗在局限性前列腺癌的临床治疗中存在优势,显示出越来越广阔的应用前景,但鉴于此报告样本量较小及随访时间有限,仍期待大样本随机对照的有力论证以确定125I粒子置入联合间歇性内分泌治疗可最大程度缓解疾病进展及改善预后。
[1]叶定伟.前列腺癌的流行病学和中国的发病趋势[J].中华外科杂志,2006,44(6)∶362-364.
[2]李青,李明川,姜永光,等.近距放疗联合间歇性内分泌治疗在前列腺癌治疗中的应用[J].临床泌尿外科杂志,2012,27(7)∶522-514.
[3]Sylvester JE,Blasko JC,Grimm PD,et al.Ten-year biochemical relapse-free survival after external beam radiation and brachytherapy for localized prostate cancer:the Seattle experience[J].Int J Radiat Oncol Biol Phys,2003,57 (4)∶944-952.
[4]张国辉,王金萍,关亚伟,等.局限性前列腺癌间歇性内分泌治疗的临床观察[J].现代泌尿外科杂志,2011,16(2)∶25-26.
[5]王俊杰,黄毅,冉维强,等.125I粒子近距离治疗前列腺癌临床应用[J].中华放射医学与防护杂志,2004,24(6)∶509-512.
[6]朱晓应,叶林阳,林茂虎,等.125I放射粒子植入治疗前列腺癌12例临床分析[J].现代泌尿外科杂志,2009,14(1)∶25-26.
[7]Potters L,Klein EA,Kattan MW,et al.Monotherapy for stage T1-T2prostatecancer:radicalprostatectomy,external beam radiotherapy,or permanent seed implantation[J].Radiother Oncol,2004,71(1)∶29-33.
[8]Nag S,Beyer D,Friedland J,et al.American Brachytherapy Society(ABS)recommendations for transperineal permanent brachytherapy of prostate cancer[J].Int J Radiat Oncol Biol Phys,1999,44(4)∶789-799.
[9]那彦群,叶章群,孙光.2011版中国泌尿外科疾病诊断治疗指南手册[M].北京:人民卫生出版社,2011:74-77.
[10]MiyamotoH,MessingEM,ChangC.Androgen deprivation therapy for prostate cancer:current status and future prospects[J].Prostate,2004,61(4)∶332 -353.
[11]Green N,Bodner H,Broth E,et al.Improved control of bulky prostate carcinoma with sequential estrogen and radiation therapy[J].Int J Radiat Oncol Biol Phys,1984,10(7)∶971-976.
[12]Crook J,Ludgate C,Malone S,et al.Final report of multicenter Canadian phaseⅢrandomized trial of 3 versus 8 months of neoadjuvant androgen deprivation therapy beforeconventional-doseradiotherapyforclinically localized prostate cancer[J].Int J Radiat Oncol Biol Phys,2009,73(2)∶327-333.
[13]Lee LN,Stock RG,Stone NN.Role of hormonal therapy in the management of intermediate-to high-risk prostate cancer treated with permanent radioactive seed implantation[J].Int J Radiat Oncol Biol Phys,2002,52(2)∶444-452.
[14]Stock RG,Cahlon O,Cesaretti JA,et al.Combined modality treatment in the management of high-risk prostate cancer[J].Int J Radiat Oncol Biol Phys,2004,59(5)∶1352-1359.
[15]Bagshaw MA,Pistenma DA,Ray GR,et al.Evaluation of extended-field radiotherapy for prostatic neoplasm:1976 progress report[J].Cancer Treat ReP,1977,61(2)∶297-306.
[16]Ravery V,Boccon-Gibod LA,Dauge-Geffroy MC,et al.Systematicbiopsiesaccuratelypredictextracapsular extension of prostate cancer and persistent/recurrent detectable PSA after radical prostatectomy[J].Urology,1994,44(3)∶371-376.
[17]Gelblum DY,Potters L,Ashley R,et al.Urinary morbidity following ultrasound-guided transperineal prostate seed implantation[J].Int J Radiat Oncol Bio Phys,1999,45(1)∶59-67.
Clinical observation:the clinical therapeutic effect of the combining of intermittent endocrine therapy and brachytherapy in localized prostate cancer
ZHANG Guo-hui1JIANG Tao2#LI Zhi-hui1ZHENG Qing-you1GUAN Ya-wei1ZHU Li-xia1WANG Jin-ping1JIA Zhuo-min1GAO Feng1
1Department of Urology,2Department of Preventive Medicine,General Hospital of Beijing Military Command of Chinese PLA,Beijing 100700,China
ObjectiveTo investigate the clinical therapeutic effect of the combining of intermittent endocrine therapy and brachytherapy in localized prostate cancer.MethodAtotal of 136 localized prostate cancer patients who had
5-year treatment without radical prostatectomy from January 2003 to July 2013 were retrospectively analyzed.All patients were divided into three groups based on therapy:A group(46 cases)received intermittent endocrine therapy;B group(42 cases)accepted125I brachytherapy;And C group(48 cases)was applied with125I brachytherapy+intermittentendocrine therapy.And the inefficiency,5-year event-free survival rate and 5-year overall survival rate of the three groups were compared.ResultThe inefficiency in A group,B group,C group was 17.39%,16.67%,2.08%,while 5-year event-free survival rate was 36.96%,66.67%,87.50%,and 5-year survival rate was 50.00%,73.81%,93.75%,respectively.The inefficiency of C was lower than A and B(P<0.05),but the 5-year event-free survival rate and 5-year survival rate in C were statistically better than A and B(P<0.05);And the adverse reaction in C was statistically less than B(P<0.05).ConclusionAs a comprehensive therapy,the combination of intermittent endocrine therapy and125I brachytherapy can increase response rate,event-free survival rate and overall survival rate,and is an effective and safe treatment for localized prostate cancer.
125I brachytherapy;intermittent endocrine therapy;localized prostate cancer
R737.25/R730.58
A
10.11877/j.issn.1672-1535.2014.12.01.01
#通信作者(Corresponding author),e-mail:menyuang@sina.cn
2013-09-27)
