绵羊卵巢不同获卵方法及体外成熟效果比较
2014-01-16宁方勇白秀娟
宁方勇,白秀娟
(东北农业大学动物科学技术学院,哈尔滨 150030)
绵羊卵巢不同获卵方法及体外成熟效果比较
宁方勇,白秀娟*
(东北农业大学动物科学技术学院,哈尔滨 150030)
采用抽吸、切割和抽吸结合切割3种方法,从绵羊卵巢获取卵母细胞,分别比较3种方法获得A、B、C级卵母细胞的数量及耗时。结果表明,抽吸结合切割和切割法耗时分别为136.07和131.60 s,均显著高于抽吸法61.33 s(P<0.05);而获得可用卵(包括A、B级)以切割法最好为8个。对比不同激素剂量组合的3种培养液,均能获得81%以上成熟率,但成熟率差异不显著。成熟液:TCM199-HCO3+10%FBS+l μg·mL-1雌二醇+2.2 g·mL-1NaHCO3+50 μg·mL-1庆大霉素+5 μg·mL-1FSH+0.38 mmol·L-1丙酮酸钠+1 IU·mL-1LH+10 mmol·L-1Hepes可获得最高83.4%卵母细胞成熟率;绵羊卵巢保存在10~15℃、15~20℃和20~30℃条件下,所获卵母细胞成熟率都在82%以上,差异不显著;IA23187联合6-DMAP孤雌激活体外成熟绵羊卵母细胞,可获最高91.5%孤雌胚率。
绵羊卵巢;获卵方法;体外成熟;比较
胚胎干细胞、转基因、核移植及传统的体外受精技术[1-5]需要大量卵母细胞和胚胎。随着现代胚胎工程技术迅速发展,对绵羊卵母细胞需求量迅速增加。不断改进现有卵母细胞采集方法,最大限度从屠宰绵羊卵巢获取最大数量的优质卵母细胞,提高绵羊卵巢的利用效率是胚胎工程技术研究的热点。
影响绵羊卵母细胞体外成熟因素较多,目前,绵羊卵母细胞体外成熟培养液大部分采用稳定性较好的TCM199作为基础培养液,不同研究者通过添加各种离子、激素和细胞因子等获得较高成熟率。激素在绵羊卵母细胞体外成熟培养体系中具有重要作用。激素在体外成熟培养液中添加,能显著提高绵羊卵母细胞体外成熟成熟率,提高卵母细胞核成熟和胞质成熟同步化,所获成熟卵母细胞在后续胚胎发育过程中表现出较好发育能力。FSH、LH和雌二醇是当前各种成熟培养体系中应用较多,效果较为明显的3种激素。
本试验旨在筛选一种适合绵羊卵巢的采卵方法,确定绵羊卵巢理想保存温度,探索保证卵母细胞成熟率的适宜激素浓度剂量组合,并确立体外成熟绵羊卵母细胞的孤雌激活方法。
1 材料与方法
1.1 材料
1.1.1 供试卵巢
绵羊卵巢采集于黑龙江省兰西县榆林镇兴达畜禽屠宰公司。
1.1.2 供试药剂
卵巢保存液:0.9%灭菌生理盐水、100 μg·mL-1青霉素、100 μg·mL-1链霉素;PBI操作液:NaCl 8 g·L-1、KCl 0.2 g·L-1、Na2HPO4·12H2O(或Na2HPO4)2.9 g·L-1(或1.15 g·L-1)、KH2PO40.2 g·L-1、MgCl2·6H2O 0.1 g·L-1、CaCl2·6H2O 0.13 g·L-1、葡萄糖(Glucose)1 g·L-1、丙酮酸钠(Na-Pyrurate)0.36 g·L-1、K-penicilin 0.075 g·L-1、BSA 3 g·L-1或1 g·L-1。
SOFaa培养液:KCl 0.534 g·L-1、NaCl 6.294 g·L-1、KH2PO40.162 g·L-1、NaHCO32.106 g·L-1、丙酮酸钠0.033 g·L-1、L-谷氨酰胺(L-Glutamine)0.146 g·L-1、CaCl2·2H2O 0.251 g·L-1、MgCl2·6H2O 0.100 g·L-1、乳酸钠(Sodium lactate)0.370 g·L-1(或282.4 μl·L-1)、青霉素(Penicillin)0.075 g·L-1、链霉素0.050 g·L-1、2%(V/V)必需氨基酸、1%(V/V)非必需氨基酸。
1.2 方法
1.2.1 绵羊卵巢的获取
75%酒精消毒剪刀采集绵羊卵巢,10~35℃卵巢保存液存放,2~6 h内运回实验室。
1.2.2 绵羊卵母细胞的采集
1.2.2.1 绵羊卵巢的处理
用灭菌生理盐水将采集的绵羊卵巢洗涤4~6次,如卵巢上有多余的结缔组织和脂肪,用经75%酒精消毒的手术刀剪将其剪除。卵巢处理完毕后置于卵巢保存液中采集卵母细胞,整个操作过程,需在添加双抗的PBI液中进行。
1.2.2.2 绵羊卵母细胞的采集
采用下列3种方法进行绵羊卵母细胞的采集:
I(抽吸法):5 mL注射器抽吸绵羊卵巢表面可见卵泡,将抽吸所得卵泡液于体式显微镜下挑拣卵母细胞。获取卵母细胞移入平衡3~5 h成熟液中洗涤,然后按标准划分卵母细胞级别,统计卵母细胞数量。
П(抽吸结合切割法):先后采用I(抽吸法)和Ш(切割法)处理绵羊卵巢,将经过两种方法处理获得卵母细胞按标准划分卵母细胞级别,统计卵母细胞数量。
Ш(切割法):在Φ60 mm培养皿中放入采卵液(PBI),将采卵绵羊卵巢置于其中。操作时,一手将卵巢用组织镊固定后,另一只手用刀片在卵巢表面轻轻划割,多次划割后,用采卵液反复冲洗划割后的卵巢。操作完毕,取出处理的绵羊卵巢,在体视显微镜下配合划线法(见图1)挑拣卵母细胞,然后按照标准划分卵母细胞级别,并统计不同级别卵母细胞数量。
划线法配合不同采集方法采集绵羊卵母细胞,是经反复试验证实适合卵母细胞采集的一种便捷方法。操作时,用黑色标记笔在Φ60 mm培养皿的皿盖外部划出“Z”字形线条,然后将培养皿翻转倒置作为卵母细胞采集容器。用不同方法对绵羊卵巢进行处理后,将含有卵母细胞的皿盖移到显微镜下进行挑拣,此法不但大大提高卵母细胞的挑拣速度,而且最大程度减少了因操作失误而造成的卵母细胞丢失,确保获取卵母细胞数量统计的准确性。

图1 划线法Fig.1 Lineation method
卵泡液体外放置一段时间常会形成胶冻样物质,严重影响卵母细胞的收集。因此,在采集卵母细胞的过程中,每次处理完1个卵巢后,立即进行卵母细胞的挑拣。
1.2.3 绵羊卵母细胞的分级
通过不同方法获取的绵羊卵丘—卵母细胞复合体(Cumulus-oocyte complex,COCs)用成熟液洗涤2~3次后,置于体式显微镜下进行等级划分和评定。所获卵母细胞按照形态学标准可以划分为3个等级(参见图2):
A级:卵母细胞的细胞形态规则,细胞胞质均一,卵母细胞周围至少被3层以上卵丘细胞完全包裹,卵丘细胞致密,不扩散;
B级:卵母细胞的细胞形态良好,卵母细胞周围被1~3层的卵丘细胞所包裹;
C级:卵母细胞周围没有卵丘细胞存在,变形卵和退化的卵母细胞,或者裸卵。
研究结果证实,在现有体外成熟培养体系条件下,C级卵母细胞无法体外培养成熟,因此只选择A、B级卵母细胞用于体外成熟的培养。
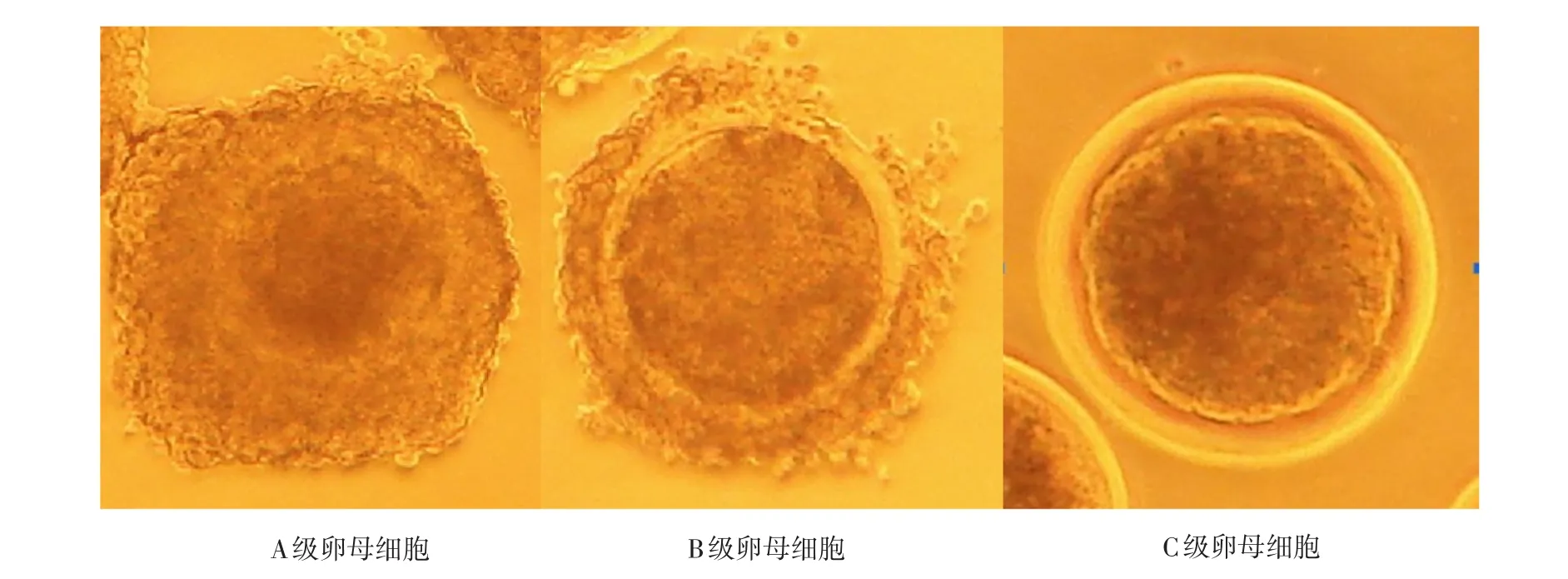
图2 卵母细胞的等级划分Fig.2 Classification of sheep oocyte
1.2.4 绵羊卵母细胞的体外成熟培养
1.2.4.1 绵羊卵母细胞体外成熟培养的3种成熟液
采用如下3种成熟液对卵母细胞进行体外成熟培养:
成熟液1:TCM199-HCO3+10%FBS+1 μg·mL-1雌二醇+2.2 g·mL-1NaHCO3+50 μg·mL-1庆大霉素+ 5 μg·mL-1FSH+0.38 mmol·L-1丙酮酸钠+1 IU·mL-1LH+10 mmol·L-1Hepes。
成熟液2:TCM199-HCO3+10%FBS+l μg·mL-1雌二醇+2.2 g·mL-1NaHCO3+50 μg·mL-1庆大霉素+10 μg·mL-1FSH+0.38 mmol·L-1丙酮酸钠+1 IU·mL-1LH+10 mmol·L-1Hepes。
成熟液3:TCM199-HCO3+10%FBS+10 μg·mL-1雌二醇+2.2 g·mL-1NaHCO3+50 μg·mL-1庆大霉素+ 5 μg·mL-1FSH+0.38 mmol·L-1丙酮酸钠+1 IU·mL-1LH+10 mmol·L-1Hepes。
1.2.4.2 绵羊卵母细胞体外成熟培养用卵巢的保存
分别采用10~15℃、15~20℃和20~30℃卵巢保存液保存卵巢。
1.2.5 绵羊卵母细胞成熟的判定
绵羊卵母细胞成熟包括核成熟和同步的胞质成熟,胞质成熟难以界定。因此,常以卵母细胞形态变化进行判别。成熟卵母细胞周围卵丘细胞常发生放射状排列的弥散形扩散(见图3)。未成熟卵母细胞,其卵丘细胞仍呈成熟前与卵母细胞结合紧密状态(见图4)。统计卵母细胞成熟率以第一极体排出(见图5)为标准。
1.2.6 成熟卵母细胞的孤雌激活
采用方法1(IA23187+6-DMAP)、方法2(Ionomycin+6-DMAP)和方法3(7%乙醇+6-DMAP)激活成熟卵母细胞。分别在5 μmol/IA23187、5 μmol·L-1离子霉素(Ionomycin)和7%乙醇的SOFaa中激活成
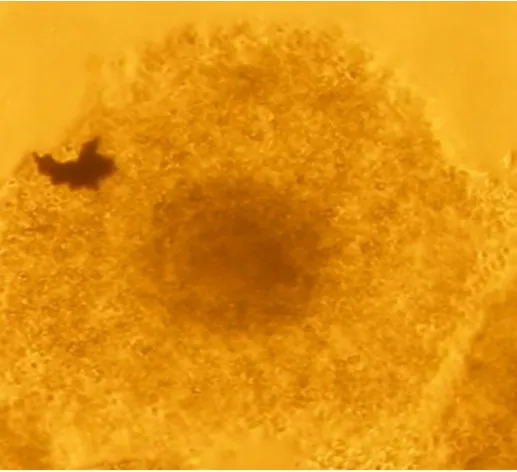
图3 成熟卵母细胞Fig.3 Matured oocyte
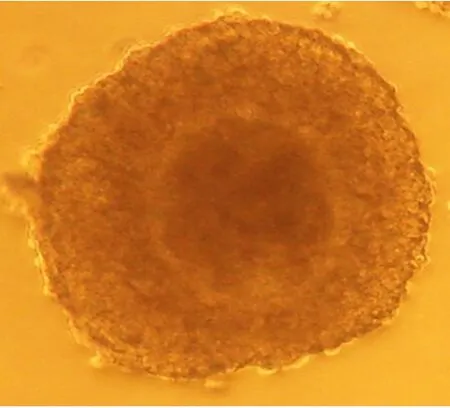
图4 未成熟卵母细胞Fig.4 Unmatured oocyte
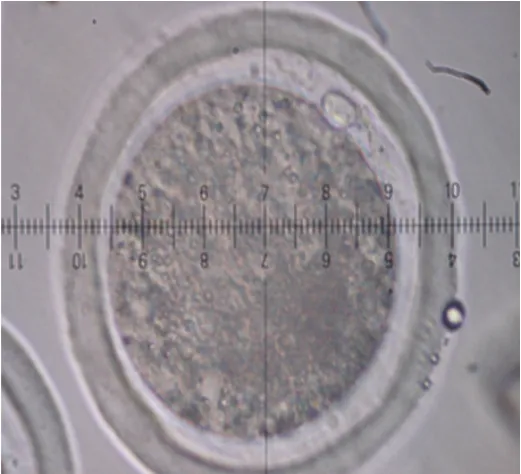
图5 第一极体排出Fig.5 Elimination of the first polar body
图6 细胞Fig.6 Cell
2 结果与分析
2.1 不同获卵方法获卵效果比较
由表1可以看出,从处理卵巢所用时间看,当采用I(抽吸法)、П(抽吸结合切割法)和Ш(切割法)3种不同的采卵方法时,采集1个卵巢的卵母细熟卵母细胞5 min,再分别用浓度2 mmol·L-16-DMAP的SOFaa培养液培养4 h。然后用SOFaa洗涤卵母细胞3~4次,移入培养液SOFaa中,在5%CO2空气、38.5℃,饱和湿度下培养48 h后,检查卵母细胞的2细胞(见图6)卵裂情况,孤雌胚率为2细胞胚胎占成熟卵母细胞数的比率。胞,抽吸法耗时为61.33 s。与其比较,当采用抽吸结合切割法和切割法采集1个卵巢的卵母细胞时,耗时分别为136.07 s和131.60 s,抽吸法处理卵巢耗时显著低于抽吸结合切割法和切割法(P<0.05),而抽吸结合切割法和切割法间耗时差异不显著。

表1 不同收集卵母细胞方法的比较Table 1 Comparison of different collecting oocytes method
从所获各级卵母细胞数量看,采用抽吸法、抽吸结合切割法和切割法处理1个卵巢时,能够分别获得1.37、2.00和3.97个的A级卵母细胞。A级卵母细胞获得数,切割法要显著的高于抽吸法和抽吸结合切割法(P<0.05),而抽吸法与抽吸结合切割法相比差异不显著;抽吸法、抽吸结合切割法和切割法处理1个卵巢时,B级卵母细胞获得数分别为0.87、3.63和4.03个。B级卵母细胞获得数,抽吸法显著低于抽吸结合切割法和切割法(P<0.05),抽吸结合切割法与切割法相比差异不显著(P>0.05);抽吸法、抽吸结合切割法和切割法处理1个卵巢时,C级卵母细胞的获得数分别为0.33、2.37和2.40个。C级卵母细胞获得数,抽吸法显著低于抽吸结合切割法和切割法(P<0.05),而抽吸结合切割法与切割法相比差异不显著(P>0.05)。
2.2 不同成熟液成熟效果比较
由表2可知,绵羊卵母细胞在3种不同培养液中体外成熟培养24 h后,成熟液1、成熟液2和成熟液3的成熟率分别为83.4%、81.1%和82.6%。经卡方检验,3种成熟液体外培养卵母细胞的成熟率差异均不显著(P>0.05)。
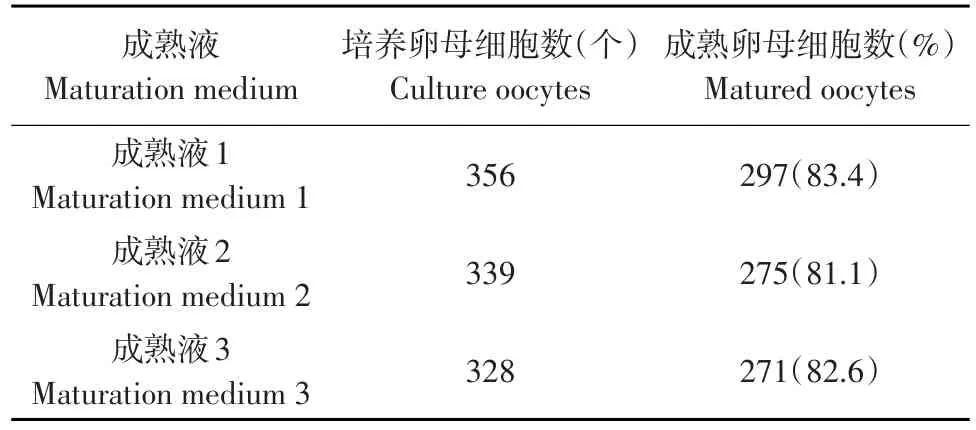
表2 不同成熟液成熟效果比较Table 2 Influence of different maturation liquid on oocyte maturation
2.3 绵羊卵巢不同保存温度成熟效果比较
由表3可知,绵羊离体卵巢在10~15℃、15~20℃和20~30℃条件下保存,卵母细胞的体外成熟率分别为82.5%、85.2%和82.9%。经卡方检验,3种温度条件下的成熟率差异均不显著(P>0.05)。
2.4 不同激活液激活效果比较
由表4可知,采用方法1(IA23187+6-DMAP)、方法2(Ionomycin+6-DMAP)和方法3(7%乙醇+ 6-DMAP)激活体外成熟卵母细胞,孤雌胚率分别是91.5%、89.5%和60.5%。经卡方检验,方法1与方法2的孤雌胚率差异不显著,但方法1和方法2的孤雌胚率极显著地高于方法3(P<0.01)。

表3 绵羊卵巢不同保存温度成熟效果比较Table 3 Influence of different conserved temperature for sheep ovary on oocyte maturation

表4 不同激活液激活效果比较Table 4 Comparison of different parthenogenetic activation liquid in sheep oocytes
3 讨论
3.1 不同获卵方法获卵效果比较
采用不同方法获取足够数量卵母细胞对于胚胎工程技术具有重要意义,卵母细胞作为重组胚胎核受体,是核移植等胚胎工程技术操作先决条件。绵羊离体卵巢卵母细胞获取方法主要有抽吸法、剖切(切割)法以及两种方法相结合方法[6-8]。
本试验中,切割法和抽吸法每处理1个卵巢耗用时间分别为:131和61 s。这与王建锋[9]等报道的剖切(切割)法耗用时间要显著长于抽吸法的研究结果相一致。其主要原因是在试验操作过程中,抽吸只针对卵巢表面可见卵泡进行操作,发育成熟突出于卵巢表面的可见卵泡数量有限,而切割法需对卵巢广泛表面反复进行操作,耗用时间较长。
本试验中,剖切(切割)法和抽吸法处理1个卵巢时,分别能够获得8个和2个可用卵母细胞。这与汪立芹等切割法能够采集2~3个可用卵母细胞研究[10]有显著差异。绵羊发情具有季节性,绵羊卵巢在不同季节处于不同的生殖发育状态,即使季节相同,卵泡发育进展情况也会因个体情况不同而存在较大差异。卵母细胞采集时,操作者采集卵母细胞的技术熟练程度差异较大,都是造成不同研究者卵巢获卵数量差异较大的原因。此外,本试验卵母细胞采集过程中配合划线法进行辅助,减少卵母细胞的遗漏,也是卵母细胞获取数量较为理想的原因。
Sommersberg等研究结果证实,卵母细胞成熟须在包裹卵丘细胞作用下完成[11]。体外成熟培养时,裸卵失去周围卵丘细胞包裹,无法成熟。要求卵母细胞进行采集时,采集方法应尽量避免对卵母细胞周围包裹卵丘细胞破坏。抽吸法采集卵母细胞,能够通过更换针头大小方法降低对卵丘细胞破坏,但当针头型号较大时,抽吸时会在卵巢表面形成较大空洞,卵泡液中卵母细胞流失,减少获取卵母细胞数量。
为提高卵巢的利用率,尽可能从单个卵巢获取更多可用卵母细胞。本试验将切割与抽吸两种方法结合处理卵巢。从试验结果看,切割与抽吸相结合方法在处理时间、获得1~3层卵母细胞数与切割法相比差异均不显著,但获得3层以上卵母细胞数却显著低于切割法(P<0.05)。这可能是在进行抽吸操作时,针头抽吸卵泡形成较大孔洞,有部分卵母细胞随卵泡液流出而导致丢失。因此,在耗时基本相同时,抽吸结合切割的方法不能显著提高从卵巢上获取卵母细胞数量。
3.2 不同成熟液成熟效果比较
哺乳动物体内激素作用机制尚不完全清楚,激素在生物体内通过复杂机制对生殖细胞的生长发育和凋亡起重要调控作用。进行卵母细胞体外成熟培养时,在TCM199培养液基础上额外添加激素[12]、各种离子[13]、细胞因子以及血清,是当前研究卵母细胞体外成熟培养体系时普遍采用的方法。檀利长等曾对比卵泡液在体外成熟培养时对卵母细胞成熟的促进作用,并取得较为理想的效果[14]。为了获得较高的成熟率,激素成为当前而各种体外成熟培养体系中必不可少的添加物。
本试验比较5 μg·mL-1FSH与l μg·mL-1雌二醇,10 μg·mL-1FSH与l μg·mL-1雌二醇,5 μg·mL-1FSH与10 μg·mL-1雌二醇3种组合不同激素浓度条件下,体外培养卵母细胞成熟情况。试验结果证实,成熟液1可获得最高为83.4%成熟率,成熟液2成熟率最低为81.1%,成熟液3成熟率则为82.6%。经卡方检验,3种成熟液体外成熟率差异均不显著。本试验中,3种成熟液的卵母细胞体外成熟率都在81%以上,这与与杨志杰等报道[15]基本一致。
促卵泡素(Follicle-stimulating hormone,FSH)是生物体内的糖蛋白激素,对卵母细胞生长发育和成熟都具有促进作用,能促进卵泡颗粒细胞增生,促进卵巢上卵泡生长以及雌激素合成和分泌,及刺激卵泡细胞产生LH受体作用。FSH能够诱导卵丘细胞扩散,使生发泡破裂出现暂时性的抑制,使第一次成熟分裂时间发生改变,达到促进胞质成熟效果。目前,FSH在卵母细胞体外成熟培养中的作用机制,尚未达成共识。雌二醇是动物体内由雄激素转化而来一类性腺类固醇激素,在生物体生殖过程中具有广泛调节作用。卵母细胞体外成熟培养时,将FSH与LH协同添加,显著提高卵母细胞的体外成熟率[16]。因此,当前研究动物卵母细胞的体外成熟培养效果时,成熟液中多是不同种类的激素协同添加。
本试验证实,体外培养绵羊卵母细胞,培养液中5 μg·mL-1FSH与l μg·mL-1雌二醇浓度,能满足一定数量卵母细胞的成熟需要,获得较高的成熟率。但绵羊卵母细胞体外成熟培养时,FSH、LH和雌二醇等激素所需精确浓度仍待进一步研究确定。
3.3 卵巢保存温度对卵母细胞成熟效果的影响
活体动物卵巢处于机体恒定内环境中,不受外界因素影响。为保证卵巢上卵母细胞活性和发育能力,从离体卵巢获取卵母细胞需对卵巢进行保温,使保存温度尽量维持恒定。
Ravindranatha认为低温打击能够引起卵母细胞冷休克,并显著降低卵母细胞发育能力[17]。潘晓燕等报道将猪卵巢保存在35℃,其卵泡液pH会随保存时间延长不断降低,过酸环境和代谢废物增加卵母细胞核DNA碎片化比率,降低卵母细胞的成熟能力[18]。本试验对比10~15℃、15~20℃和20~30℃保存绵羊离体卵巢,其卵母细胞的体外成熟率分别为82.5%、85.2%和82.9%。经卡方检验,3种温度条件下的成熟率差异均不显著(P>0.05)。试验结果证实,卵巢保存温度从10℃到30℃,卵母细胞成熟率不受明显影响,随着温度的升高和降低,卵母细胞成熟率未发现规律性变化。动物离体卵巢保存在适宜温度下是卵母细胞体外成熟的重要条件,但卵巢保存的极限高、低温,及其对卵母细胞成熟的影响仍待深入研究。
3.4 体外成熟卵母细胞的孤雌激活
正常情况下,卵母细胞由动物卵巢上排出时处于细胞周期的第二次减数分裂中期。从离体卵巢获取的卵母细胞,只有借助外源物理或化学刺激恢复减数分裂,排出第二极体,才能继续其细胞周期,完成发育过程。
乙醇早就被发现对卵母细胞具有激活作用,乙醇激活主要是通过水解细胞膜上4,5—二磷酸磷脂酰肌醇(PIP2)产生1,4,5—三磷酸肌醇(IP3),诱发细胞内源钙向胞质中释放,引起胞质钙离子浓度升高,激活卵母细胞[19]。本试验利用7%乙醇对绵羊卵母细胞进行孤雌激活,仅获60.5%孤雌胚率,低于张云生85.5%孤雌胚率[20]。本试验7%乙醇是由卵母细胞成熟液配制而成,而张云生所用7%乙醇为SOFaa配制而成[20],卵母细胞成熟液与培养用SOFaa成分差别较大,是否由此引起两者孤雌胚率差异悬殊有待研究证实。
A23187和离子霉素都是钙离子载体,A23187是增加Ca2+跨膜转运引起细胞内Ca2+浓度升高激活卵母细胞;离子霉素是通过动员细胞内Ca2+释放,依次触发Ca2+内流而引起细胞内Ca2+升高,激活卵母细胞。A23187和离子霉素激活卵母细胞的效率均高于乙醇,单独使用A23187和离子霉素激活时,卵母细胞无原核生成,因此A23187和离子霉素常与CHX或6-DMAP联合使用,才能获得理想的激活效果[21]。本试验利用A23187激活绵羊卵母细胞,获得91.5%孤雌胚率,虽与离子霉素89.5%孤雌胚率相比差异不显著,但极显著高于7%乙醇的方法(P<0.01)。比张红琴[22]、潘晓燕[23]等报道80%孤雌胚率高很多。这是因为本试验所有激活卵母细胞都经过严格形态学筛选,剔除形态较差的卵母细胞。成熟卵母细胞进行孤雌激活时,不但应注意激活方法选择,更应重视激活卵母细胞筛选。
4 结论
采用切割、抽吸及切割结合抽吸3种方法从绵羊卵巢获取卵母细胞时,切割方法获卵效果最好,可以从1个绵羊离体卵巢上获取8个可用卵母细胞;成熟液:TCM199-HCO3+10%FBS+l μg·mL-1雌二醇+2.2 g·mL-1NaHCO3+50 μg·mL-1庆大霉素+ 5 μg·mL-1FSH+0.38 mmol·L-1丙酮酸钠+1 IU·mL-1LH+10 mmol·L-1Hepes,体外成熟培养卵母细胞可获83.4%效果最好的卵母细胞成熟率;10~30℃卵巢保存温度对其卵母细胞的体外成熟没有显著影响;A23187联合6-DMAP可使成熟卵母细胞获得91.5%的孤雌胚率,证实其具有较好的胚胎发育能力。
[1]胡彦营,王传美.胚胎干细胞技术的研究进展[J].生物技术通报,2007(4):90-92.
[2]李东伟,张苗苗,李文雍.影响体细胞核移植重构胚发育的因素[J].阜阳师范学院学报,2007(1):56-59.
[3]马芳菲,魏红江.哺乳动物核移植技术研究进展及应用的问题和前景[J].上海畜牧兽医通讯,2008,4:6-8.
[4]汪立芹,陈童,林嘉鹏.影响转基因绵羊胚胎移植受胎率的因素[J].西北农业学报,2012,21(9):6-9.
[5]孙剑锋,岳文斌.家畜体外受精技术研究进展[J].河北农业科学,2008,12(2):125-126.
[6]卫恒习,田树军,朱士恩,等.提高绵羊卵母细胞发育能力的研究[J].畜禽生产,2005(5):34-36.
[7]岳永明,裴利祥,王福强,等.哺乳动物卵母细胞体外成熟技术应用与研究[J].畜牧与饲料科学,2008,29(6):47-50.
[8]曹忻,张德荣,罗海玲.月份对绵羊卵母细胞采卵数及体外成熟的影响[J].西南农业学报,2012,25(6):2347-2350.
[9]王建锋,张勇,赵兴绪.不同采卵方式对绵羊卵母细胞质量、体外成熟及体外受精的影响[J].动物医学进展,2007,28(8): 51-54.
[10]汪立芹,杨梅,陈童,等.季节和方法对牛、绵羊卵母细胞回收及体外成熟的影响[J].中国畜牧兽医,2008,35(11):74-76.
[11]Sommersberg B,Bulling A,Salzer U,et al.Gap junction communication and connexin 43 gene expression in a rat granulose cell line: regulation by follicle-stimulating hormone[J].Bio Reprod,2000, 63(6):1661-1668.
[12]孙桂金,尹逊河,敖红.绵羊卵母细胞体外成熟的研究[J].中国草食动物,2006,26(5):14-16.
[13]刘丑生,陆会宁,张利平,等.EGF和IGF-I对绵羊卵母细胞体外成熟和卵裂的影响[J].畜牧兽医学报,2008,39(5):588-593.
[14]檀利长,田宁宁,霍道坦,等.牛卵泡液对牛卵母细胞体外成熟及受精胚发育力的影响[J].黑龙江动物繁殖,2008,16(5):3-5.
[15]杨志杰,樊江峰,王立斌.绵羊卵巢卵母细胞体外成熟培养的研究[J].甘肃农业大学学报,2005,40(5):583-585.
[16]闵江涛,杜卫华,赵学明,等.绵羊卵母细胞采集、体外成熟和胚胎体外培养对体外受精技术效率的影响[J].中国畜牧兽医, 2014,41(5):202-209.
[17]Ravindranatha B M,Nandi S,Raghu H M,et al.In vitro maturation and fertilization of buffalo oocytes:effects of storage of ovaries, IVM temperature,storage of processed sperm and fertiliaziton[J]. Reprod Domest Anim,2003,38(1):21-26.
[18]潘晓燕,陈童,汪立琴.低温长时间保存的绵羊卵巢对卵母细胞发育潜力的影响[J].畜牧与兽医,2008,40(3):49-51.
[19]Machaty Zrather R S.Strategies for activating nuclear transfer oocyte[J].Reprod Fertil Dev,1998,10:599-613.
[20]张云生,张永胜,皮文辉.乙醇对绵羊卵母细胞孤雌激活的研究草食家畜[J].草食家畜,2005,3(126):36-39.
[21]乌云其其格,李向臣,跃华,等.不同哺乳动物卵母细胞孤雌激活的研究进展[J].中国畜牧兽医,2008,35(9):55-59.
[22]张红琴,周欢敏,李宝山.不同激活方法对绵羊体外成熟卵母细胞孤雌生殖的影响[J].内蒙古农业大学学报,2008,29(1): 78-81.
[23]潘晓燕,杨梅,王正朝.绵羊卵母细胞孤雌发育的研究[J].西北农业学报,2007,16(3):7-10.
Comparsion of different collecting oocytes method andin vitromatura- tion on sheep
NING Fangyong,BAI Xiujuan(School of of Animal Science and Technology, Northeast Agricultural University,Harbin 150030,China)
The paper collected oocytes from the sheep ovary by using 3 methods:the syrine aspiration,slicing and syrine aspiration combining with slicing,and then compared the oocytes number and time consuming to acquire A,B and C standard sheep oocytes.The results showed that the time consuming are 136.07 s and 131.60 s by syrine aspiration combining with slicing and slicing method, respectively.both of them are significantly higher than the time consuming by syrine aspiration,which time is 61.33 s(P<0.05);slicing is the best way to collect 8 available oocytes(including A and B sheep oocytes).compared the 3 kinds medium with different hormone dose,all the maturation rate is higher above 81%,however,the difference is not significant,the maturation medium:TCM199-HCO3+10% FBS+lµg·mL-1E2+2.2 g·mL-1NaHCO3+50µg·mL-1Gentamycin+5µg·mL-1FSH+0.38 mmol·L-1Na-Pyruvate 1 IU·mL-1LH+10 mmol·L-1Hepes can be obtained the highest oocytes maturation rate 83.4%;83.4%;the sheep oocytes conserve in 10-15℃,15-20℃and 20-30℃,all the oocytes maturation rate is 82%above,the difference is not significant;IA23187 and 6-DMAP be used for parthenogenetic activation,parthenogenetic activation embryo rate is the highest 91.5%.
sheep oocyte;collecting oocytes method;in vitromaturation;comparsion
S826
A
1005-9369(2014)08-0065-07
2012-03-28
国家自然科学基金(30771538,31000990)
宁方勇(1977-),男,讲师,博士,研究方向为特种经济动物。E-mail:654293748@qq.com
*通讯作者:白秀娟,教授,博士生导师,研究方向为特种经济动物。E-mail:bxj630306@163.com
时间2014-7-26 14:35:46[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140726.1435.004.html
宁方勇,白秀娟.绵羊卵巢不同获卵方法及体外成熟效果比较[J].东北农业大学学报,2014,45(8):65-71.
Ning Fangyong,Bai xiujuan.Comparsion of different collecting oocytes method andin vitromaturation on sheep[J].Journal of Northeast Agricultural University,2014,45(8):65-71.(in Chinese with English abstract)
