miR-21 在乳腺癌患者血清中的表达及意义
2014-01-16王贵年
王贵年 吴 娟
乳腺癌是目前全世界范围内女性最常见的恶性肿瘤之一,严重威胁女性身心健康及危害其生命。近年来研究表明,miRNA 功能失调与恶性肿瘤的发生、发展密切相关,在细胞的增殖、凋亡、分化等过程中发挥重要作用,miRNA 成为肿瘤研究领域的热点[1]。迄今,尚无miR -21 在乳腺癌患者血清中确切表达情况的研究报道。为此本研究拟通过检测乳腺癌患者血清中miR-21 表达水平,重点探讨血清miR-21与乳腺癌临床病理特征之间的关系,为临床诊断治疗乳腺癌提供新的思路。
材料与方法
1.研究对象:随机选取2012 年3 月~2013 年7 月淄博市第一医院住院、门诊乳腺疾病女性患者共49 例作为研究对象,其中乳腺良性肿瘤组23 例,患者年龄23 ~65 岁,平均年龄42.15 ±15.73 岁,乳腺浸润性导管癌组26 例,年龄25 ~76岁,平均36. 24 ±29. 57 岁,(Ⅰ期9 例、Ⅱ期11 例、Ⅲ期6例),所有研究对象均排除妊娠、感染、肝肾功能不全、糖尿病和心脑血管疾病等并发症及无其他肿瘤等疾病。本研究中乳腺癌患者病例诊断参照美国癌症联合会第七版癌症分期手册(cancer staging manual)[2],全部病例术前均未行化疗或放疗,内分泌治疗。采集研究对象受试者空腹静脉血3ml,3500r/min 离心5min,取血清于-20℃保存备用。
2.仪器及试剂:ABI Prism7000 荧光定量PCR 仪(Applied bio systems 公司);总RNA 提取试剂盒(QiaGen miReasy Mini Kit)购于德国QiaGen 公司;反转录试剂盒(U6 snRNA,PCR primer set,has-miR-21,LNATM PCR primer set);实时荧光定量PCR 试剂盒(Roche 公司)。
3.血清miR-21 检测:(1)miR-21 及U6 snRNA 的反转录:按照总RNA 提取试剂盒说明书对所有标本操作,提取总RNA 后保存于-20℃冰箱中;按反转录试剂盒说明书,反转录前cRNA 总浓度稀释为5ng/μl,反应条件:42℃水浴中温育60min,合成cDNA 温育完成后,将此离心管置于95℃空气浴中加热样品5min 取出于-20℃保存。(2)SYBR Green -real-time PCR 法测定miR -21 表达:总反应体系20μl:SYBR Green Mix 9μl,miR - 21 forward primer 2μl,miRNA reverse primer 2μl,template cDNA 2μl,RNase - free H2O 5μl;qRT -PCR 反应条件:95℃20s 预变性;95℃10s、60℃20s,70℃10s采集荧光,40 个循环。以U6 snRNA 作为内参,并设置空白对照,所有标本反应均设有3 个重复。
4.统计学方法:应用SPSS 17.0 统计软件分析,数据采用均数± 标准差(±s)表示,各实验组血清miR -21 浓度比较用秩和检验(检验水准α =0.05);血清miR -21 表达水平与乳腺癌临床病理特征之间的相关性,采用Fisher 精确检验;以P <0.05 为差异有统计学意义。
结 果
1.实时荧光定量PCR 检测结果:阳性曲线和研究对象血清miR-21 及U6 snRNA 的反应曲线呈标准S 型,阴性和空白对照反应曲线呈不规则型。U6 snRNA 在所有检测标本中都有表达,其Ct 值在28.20 ±1.03,可作为本实验的内参照,说明扩增效果满意,实验结果可靠。
2.乳腺良性肿瘤组、乳腺癌组的血清miR -21表达水平比较:以△Ct 表示标本miR -21 的表达量,ΔCt=(CtmiR-21-CtU6snRNA),△Ct 越低说明miR -21表达量越高,检测结果显示血清miR -21 的表达量在Ⅰ、Ⅱ、Ⅲ期乳腺浸润性导管癌中表达量递增,提示血清miR-21 可作为疾病进展的指标(表1)。
表1 乳腺良性肿瘤组、乳腺癌组的血清miR-21表达水平比较(△Ct,±s)

表1 乳腺良性肿瘤组、乳腺癌组的血清miR-21表达水平比较(△Ct,±s)
P 值为与对照组(乳腺良性肿瘤组)相比
分组 n miR-21(△Ct)P乳腺良性肿瘤组23 4.02 ±1.56Ⅰ期 9 2.11 ±1.02 0.009Ⅱ期 11 1.13 ±0.96 0.005Ⅲ期6 1.01 ±0.53 0.001
2.血清miR -21 的表达与乳腺癌临床病理特征的关系:26 例乳腺癌患者进行血清miR-21 定量检测,基因表达变化倍数采用2-△△Ct法进行比较,得出miR-21 相对表达量,结果符合正态分布(P >0.05),平均值为0.60 ±0.21,以miR -21 相对表达的平均值0.60 为界,将乳腺癌患者分为miR-21低表达组和高表达组。乳腺癌组患者血清miR -21相对表达量与其年龄(P =0.751)、肿瘤大小(P =0.062)经统计学分析差异无统计学意义(P >0.05),乳腺癌组患者血清miR -21 相对表达量与TNM 分期(P =0.014)、淋巴结转移(P =0.021)经统计学分析差异有统计学意义,呈正相关(P <0.05),详见表2。
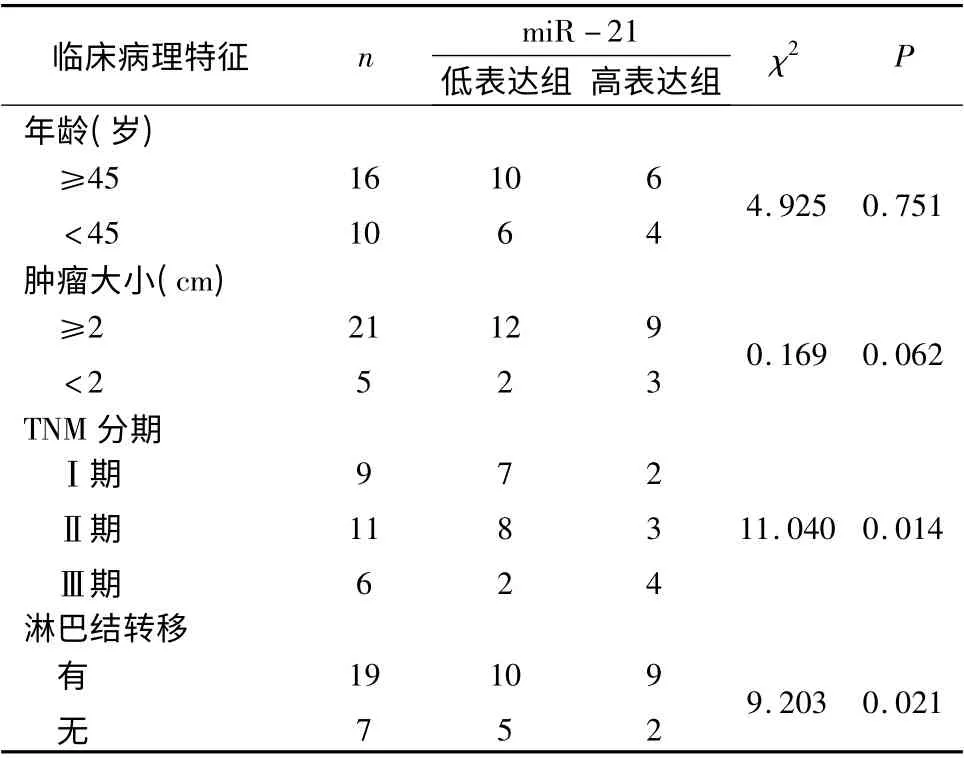
表2 血清miR-21 的表达与乳腺癌临床病理特征的关系(n)
讨 论
近年来我国乳腺癌的病死率增长了38.91%,已成为对妇女健康威胁最大的疾病之一[3]。目前,缺少乳腺癌的理想血清分子诊断标志物,CA153 被作为乳腺癌疗效的理想观察指标,但不能作为乳腺癌早期诊断标志物[4]。外周血循环肿瘤细胞可用来判断乳腺癌的转移,但早期转移因肿瘤细胞少而隐蔽,导致阳性率低,限制了其临床应用。随着基因分子水平检测方法的深入研究,乳腺癌发病机制取得了部分进展,因此应用qRT-PCR 法适用于检测乳腺癌的血清分子诊断标志物[5,6]。
miRNA 是近年来发现的一类长度为19 ~25 个核苷酸的非编码RNA,通过与mRNA 的3'端非翻译区(3'untranslated regions,UTRs)进行序列特异性的结合从而抑制基因的转录后表达。随着对miRNA 研究的不断深入,发现miRNA 作为一种新的基因调控机制,在肿瘤细胞增殖、分化等发挥重要作用,越来越多的研究发现miRNA 通过作用于下游基因参与了乳腺癌细胞增殖、凋亡、转移侵袭及放化疗抵抗等,在乳腺癌的发生发展中扮演着重要的角色[7]。
研究证明,miR -21 是单个基因编码miRNA,编码基因位于17q23.2,miR -21 在胶质瘤、肺癌、乳腺癌等多种恶性肿瘤中表达升高,并能通过抑制PTEN、PDCD4、TIMP3、TMP -1、RECK、p53 等抑癌基因的翻译过程参与调控多种恶性肿瘤的发生[8]。目前miR-21 已被证实在许多类型肿瘤中均表达异常,虽然已预测出许多miR -21 直接调控的靶基因,但仅部分临床中得到证实。2008 年Chen 等通过不同的实验发现miRNA 以一种非常稳定的形态存在于血清,血清miRNA 作为一种非损伤性检查,在乳腺癌的诊断和预后判断方面具有良好的应用前景。通过文献分析,大量研究人员开始关注循环miR -21,认为血清中升高的miR -21 表达对恶性肿瘤的早期诊断、肿瘤转移、肿瘤进展、对治疗的反应和预后等方面具有预测价值。研究者发现[9],相对于健康成年女性人群,乳腺癌患者血清miR -21 显著上升,miR -92a 显著下降,研究成果表明,miR -21 可以作为乳腺癌诊断的血清分子标志物。
本研究通过应用荧光定量PCR 法对血清miR -21 表达水平的检测发现乳腺癌组明显高于乳腺良性肿瘤组,提示血清miR -21 可能会成为乳腺癌患者的诊断参考指标,与Kumar 等[10]研究结果一致。26例乳腺癌组患者血清miR -21 的检测结果与乳腺癌临床病理特征相关性初步探讨,结果显示血清miR - 21 的表达水平与乳腺癌患者年龄(P =0.751)、肿瘤大小(P =0.062)经统计学分析差异无统计学意义(P >0.05),乳腺癌患者血清miR -21 相对表达量与TNM 分期(P =0.014)、淋巴结转移(P =0.021)经统计学分析差异有统计学意义,呈正相关(P <0.05)。
为了明确miR -21 与乳腺癌转移的相关性,本研究应用荧光定量PCR 法检测发现,乳腺癌患者血清miR -21 高表达不仅与乳腺癌的发生有关,而且其表达上调可能会导致淋巴结转移,说明miR -21与乳腺癌的转移具有相关性,miR-21 可能作为一个肿瘤转移促进基因在乳腺癌的转移中发挥一定的作用,以上均提示血清miR -21 有望成为未来乳腺癌诊断和治疗的一个新的靶点。
综上所述,血清miR -21 在乳腺癌诊治方面的临床应用价值存在争议,因此,血清miR -21 作为乳腺癌潜在的重要分子诊断标志物,仍需大样本的临床研究支持,以证实血清miR -21 表达水平与乳腺癌患者临床病理因素的相关性以及评价预后的临床意义。
1 Almeida MI,Reis RM,Calin GA. MicroRNA history:discovery,recent applications,and next frontiers[J]. Mutat Res,2011,717 (1-2):1 -8
2 Edge SB,Byrd DR,Compton CC,et al. AJCC Cancer Staging Manual[M]. 7th ed. New York:Spring,2009
3 谢碧琛,李国利.Wnt/ wnt 基因信号通路与乳腺癌[J].中国生物化学与分子生物学报,2011,27(2):125 -129
4 叶蓓,柳光宇,陆劲松,等.常用的乳腺癌血清肿瘤标志物在早期诊断中的应用价值不高[J].中国癌症杂志,2009,19(10):807 -808
5 Van Schooneveld E,Wouters MC,Van der Auweral I,et al. Expression profiling of cancerous and normal breast tissues identifies microRNAs that are differentially expressed in serum from patients with (metastatic)breast cancer and healthy volunteers [J]. Breast Cancer Res,2012,14 (1):R34
6 Asaga S,Kuo C,Nguyen T,et al. Direct serum assay for MicroRNA-21 concentrations in early and advanced breast cancer[J]. Clinical Chemistry,2011,57(1):84 -91
7 Li M,Li J,Ding X,et al. MicroRNA and cancer[J]. AAPS J,2010,12(3):309 -317
8 杨旸,康春生.miRNA-21 与肿瘤相关研究新进展[J]. 中国肿瘤临床,2011,38(6):357 -360
9 Si H,Sun X,Chen Y,et al. Circulating microRNA -92a and microRNA -21 as novel minimally invasive biomarkers for primary breast cancer[J]. J Cancer Res Clin Oncol,2013,139(2):223 -229
10 Kumar S,Keerthana R,Pazhanimuthu A,et al. Overexpression of circulating miRNA - 21 and miRNA - 146a in plasma samples of breast cancer patients [J]. Indian J Biochem Biophys,2013,50(3):210 -214