ERCC1 表达水平与以铂类药物为基础的胃癌新辅助化疗疗效相关性研究
2014-01-16梁美霞冯道夫
李 涛 梁美霞 冯道夫 李 婷 陈 凛
胃癌是严重威胁我国人民健康的恶性肿瘤性疾病,高发病率和病死率是本病主要特点。根治性、规范化外科手术已经达到前所未有的高度,仍无法显著提高胃癌患者5 年生存率。术前采取新辅助化疗使进展期胃癌病变缩小、减少肿瘤及所属淋巴结对周围脏器的侵犯是提高胃癌治疗效果的一个方向。随着胃癌新辅助化疗受到越来越多的重视,如何预测胃癌化疗敏感度的问题日渐突出。在临床工作中发现部分患者经化疗后仍然出现肿瘤进展,原因在于肿瘤细胞对化疗药物不敏感[1,2]。通过药物基因组学对患者的基因进行检测,进而发现对特定药物具敏感度或抵抗性的患者人群的一些疾病相关基因的单核苷酸多态性(SNP)差异,预测该化疗药物的疗效,选择合适的药物进行化疗,已成为提高疗效,减少无效治疗的合理选择。随着对肿瘤药物耐药性研究的深入,相继发现了许多和耐药有关的基因,如与铂类相关的切除修复交叉互补基因1(excision repair cross complementation 1,ERCC1)。ERCC1 是核苷酸外切修复家族中的重要成员,参与DNA 链的切割和损伤修复过程。临床研究已证实ERCC1 表达水平与多种肿瘤铂类药物化疗的疗效和生存期呈负相关,即表达水平低的患者对铂类药物敏感,反之表达水平高的患者则耐药[3~5]。以此为理论依据,本研究拟分析进展期胃癌患者术前应用氟尿嘧啶类和铂类药物后标本组织中ERCC1 水平变化,探讨其与化疗疗效之间的关系,分析ERCC1 作为化疗疗效生物学标志物可能性,以此来实现胃癌患者个体化治疗,必将对提高胃癌患者总体生存率具有重要意义[6]。
资料与方法
1.研究对象:入组标准:①经胃镜活检病理活检确诊为胃癌患者;②所有患者治疗前均需经过超声胃镜(EUS)、CT(或PET-CT)和腹腔镜探查进行治疗前分期评估(TNM),按照第7 版AJCC 分期为Ⅱ~Ⅲ期患者;③患者无手术相关禁忌证,预计能够进行根治性外科切除;④KPS >60;ECOG 评分:0 ~2;⑤年龄20 ~75 岁;⑥过去未曾进行过化疗;⑦根据RECIST 1.1 标准[7]要求具有可测量病灶;⑧血液检查和身体状况能够耐受化疗药物。筛选前7 天内(包括7 天)时,基线实验室数据要求:白细胞计数(4 ~10)×109/L、血小板计数≥100×109/L、血红蛋白≥100g/L、肝功能<3 倍正常上限值、总胆红素≤1.5mg/dl、血清肌酐≤1.2mg/dl;⑨签署知情同意书。
2.术前化疗:入组患者均严格按照SOX 方案进行。具体方案:替吉奥胶囊(S-1)80mg/m2,第1 ~14 天,口服;注射用奥沙利铂130mg/m2第1 天,静脉滴注,每3 周重复。如果患者血液学毒性达到3 或4 级或非血液毒性达2、3 或4 级,调整每日S -1 剂量由120mg 减为100mg,100mg 减为80mg,80mg 减为60mg,或由于毒性而停止给药。随后的剂量根据结果进行调整。注射用奥沙利铂剂量调整如下:由130mg/m2调整为100mg/m2或85mg/m2。安全性分析依据NCI-CTC 4.0版本进行评估。
3.手术和病理:在患者完成最后1 次化疗后至少4 周才可行手术治疗。手术按照JGCA(Japanese Gastric Cancer Association)标准[8]行D1/D2淋巴结清扫。术中标本送检后均由专业的病理学专家进行检查,本研究病理报告相关要求:①WHO 和Lauren 分类;②肿瘤浸润层次;③切缘是否癌残留(R0:无残存肿瘤/R1:镜下可见残存肿瘤/R2:肉眼可见残存肿瘤);④分组淋巴结中肿瘤细胞残留;⑤脉管癌栓;⑥免疫组化;⑦病理学评价(按照日本标准记录):0 级(无疗效):无证据显示有效。1 级(轻微疗效):1a 级(疗效极轻微):存活肿瘤细胞占肿瘤区2/3 以上。1b 级(疗效轻微):存活肿瘤细胞占据肿瘤区1/3 以上,但<2/3。2 级(疗效明显):存活肿瘤细胞占据肿瘤区<1/3。3 级(完全缓解):无存活肿瘤细胞,建议追加切片检查证实结果。术中留取胃癌新辅助化疗患者新鲜组织标本(正常组织与肿瘤组织),新鲜组织标本收集要求精确取材部位、足量,并能够在离断血管后30min 内进行,-80℃保存。
4.代谢酶活性测定:术中留取胃癌新辅助化疗患者新鲜组织标本(正常组织与肿瘤组织),采用RT-PCR 方法对其进行ERCC1 水平测定。(1)组织总RNA 提取:取组织样本100mg 左右,在液氮保护下进行研磨,待研磨完全后,加入1ml Trizol,并提取RNA(详见Invitrogen 公司Trizol 说明书,简单描述如下):①加入1ml Trizol 试剂后,室温孵育5 ~10min;②将其转移至1.5ml Ep 管中,加入200μl 氯仿,混匀,室温放置5min,4℃×12000r/min×15min 离心;③可见分为两层,上层为水相、下层为有机相,将上层液体转移至一新的Ep 管中,加入500μl 异丙醇,室温放置10min,4℃×12000r/min ×10min离心;④弃上清,加入新鲜配制的75%乙醇重悬沉淀,4℃×7500r/min×5min 离心;⑤弃上清,沉淀晾干后,用DEPC 处理的无菌水溶解,至于-70℃保存;⑥紫外吸光光度法检测RNA浓度和纯度(纯度1.9 ~2.1,浓度>200μg/ml 为合格产品,可用于下一步实验)。(2)cDNA 合成:采用cDNA 第1 链合成试剂盒合成cDNA:①按照以下体系加样:上述提取的总RNA:2.0μg;Oligod T:4.0μl;DEPC 处理水:补至14.0μl,共计14.0μl 反应体系,将其混匀后置于70℃水浴放置5min;②取出后立即放入冰中冷却2 ~3min,简单离心,加入下列成分:5×MMLV buffer:5.0μl;M -MLV RT:1.0μl;dNTPs:5.0μl;iRNasin:0.5μl,将总计25.0μl 反应体系混匀后,置于37℃水浴放置5min;③反应结束后,将产物置于-20℃保存。
5. Real - time PCR 检测:反应条件:50℃ 2min;95℃5min;95℃5s,60℃1min,读板;41 循环。(1)每一样本需要检测的指标有两个,分别为β -actin,ERCC1,每一指标做3复孔。(2)记录每一指标的CT值,分别记为CTactin,CTERCC1。ΔCTERCC1 = CTERCC1 -CTactin。(3)每一患者有正常组织和癌组织,其ΔCT记为:ΔCTERCC1 正常和ΔCTERCC1 癌组织,ΔΔCTERCC1 =ΔCTERCC1 癌组织-ΔCTERCC1正常,该指标的相对定量值计算公式为2 -ΔΔCT,计算的结果表示为相对表达量:即癌组织相对于正常组织的相对表达量,<1 为表达降低,>1 为表达升高。
4.统计学方法:利用计算机SPSS 15.0 软件包进行,统计描述时计数资料采用率,计量资料采用均数±标准差(±s)表示;两组比较时计量数据采用t 检验,计数资料分析采用Chi-square 检验,P <0.05 为差异有统计学意义。
结 果
1.患者基线特点:2012 年6 月~2013 年3 月共入组32 例Ⅱ/Ⅲ期胃癌患者,其中男性23 例,女性9例,患者平均年龄为60 岁(表1)。
2.有效性和安全性:所有入组患者均完成了至少2 个周期SOX 方案化疗,4 例(12.5%)Ⅲ期患者疗效达到完全缓解(CR),17 例(53.2%)患者疗效达到部分缓解(PR),化疗有效率为65.7%。9 例(28%)患者病情稳定(SD),2 例(6.3%)患者病情进展(PD)。3/4 级毒性不良反应主要为呕吐(10.8%),肝功能异常(8.1%),贫血(5.4%),中性粒细胞减少(5.4%),食欲减退(5.4%)。
3. 手术和病理结果:32 例手术患者中,29 例(90.6%)患者完成D2淋巴结清扫,3 例(9.4%)患者因肿瘤较晚而只行D1淋巴结清扫。所有手术标本均由经验丰富的病理学专家认真进行病理检查,30例(93. 8%)患者术后标本切缘阴性(R0),2 例(6.2%)患者切缘阳性(R1),10 例(31.3%)患者达到病理学缓解。
4.RT-PCR 结果:32 对新鲜的肿瘤和正常组织标本通过RT-PCR 检测ERCC1 mRNA 表达水平(表2)。结果显示,ERCC1 mRNA 在组织学敏感胃癌组织中的表达低于非敏感患者(P <0.01,图1)。
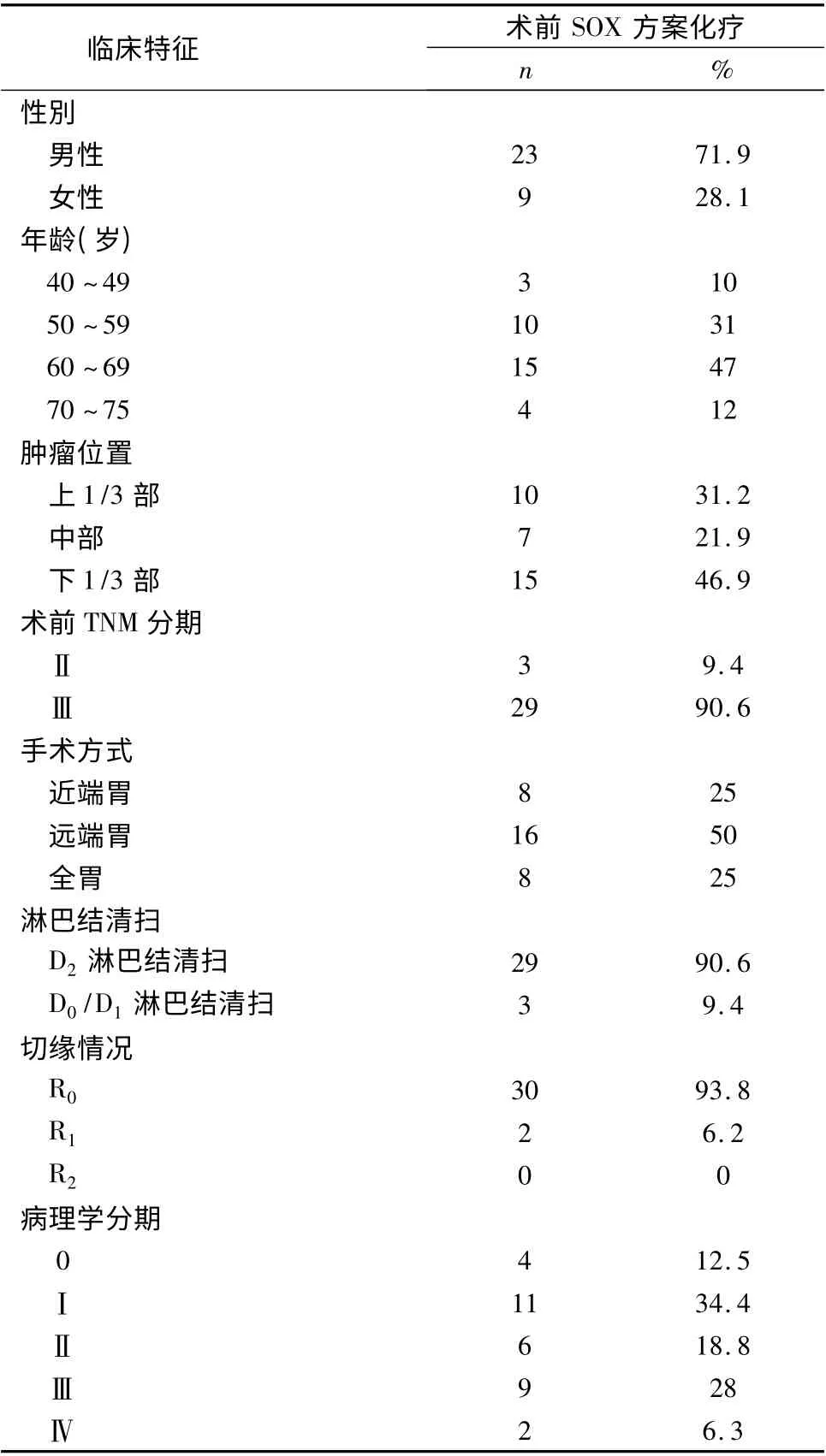
表1 入组患者基线特点

表2 PCR 引物和探针

图1 ERCC-1 mRNA 在组织学敏感胃癌组织中的表达低于非敏感者
讨 论
胃癌是严重威胁我国人民健康的恶性肿瘤性疾病。外科手术结合化疗是目前进展期胃癌治疗的主要方法,但总体生存率仍需提高。新型化疗药物的出现能够提高化疗有效率,S -1 是一种口服氟尿嘧啶类药物,其组成主要由替加氟、吉美嘧啶和奥替拉西钾,按照1∶0.4∶1 比例结合而成,是目前单药治疗晚期胃癌有效率最高的化疗药物,文献报道其有效率可达44%。注射用奥沙利铂属第3 代铂类,相比较顺铂具有有效性更好,安全性更好的优势[9]。近期研究结果显示S -1 联合奥沙利铂(SOX 方案)能够显着延长中位总生存期和无进展生存期,总体有效率为59%,疾病控制率为84%,显示出此方案的良好疗效[10]。但是,临床工作发现部分患者经化疗后仍然出现肿瘤进展,原因在于肿瘤细胞对化疗药物敏感度差、特异性不高。因此,如何筛查对药物敏感的患者,选择特异性高的化疗方案将是提高胃癌总体治疗效果的关键。
本研究中32 例进展期胃癌患者经2 ~4 个SOX方案新辅助化疗后,21 例患者肿瘤降期,化疗有效率为65.6%,疾病控制率为93.7%。10 例患者达病理学缓解(2 + 3 级),其中4 例患者更达完全缓解(pCR);30 例患者术后标本切缘阴性(R0),2 例(6.2%)患者切缘阳性(R1),R0根治率为93.8%。此外,所有患者基本可耐受化疗,并没有出现4 级毒性不良反应。可见进展期胃癌新辅助化疗不仅是可耐受的、有效的治疗方法,同时未增加手术风险及术后并发症,还可以降低肿瘤分期,从而提高无残存肿瘤(D2/R0)手术切除率,显著提高病理缓解率,并降低局部区域复发率,显著延长生存期。
本研究结果显示ERCC1 mRNA 在病理学缓解胃癌组织中的表达低于非缓解者。铂类药物的药理学机制主要是形成铂-DNA 复合物,通过引起肿瘤细胞内DNA 的交联,阻碍DNA 合成与复制,从而抑制肿瘤细胞的生长。DNA 修复是铂类药物耐药性产生的主要原因。DNA 损伤修复能力存在以下5 种途径:核苷酸切除修复(NER)、同源重组修复(HRR)、非同源末端连接(NHEJ)、碱基切除修复(BER)和错配修复(MRR)。DNA 损伤主要通过NER 的途径修复,切除修复交叉互补基因1(excision repair cross complementation 1,ERCC1)是核苷酸外切修复家族中的重要成员,参与DNA 链的切割和损伤修复过程。ERCC1 表达量直接影响DNA 的修复,其mRNA 表达水平与铂类药物的敏感度密切相关。本研究中ERCC1 低表达患者使用铂类药物效果明显优于ERCC1高表达患者。可见,ERCC1 表达水平与化疗效果呈现相关性,显示出ERCC1 在铂类药物代谢相关因子中可能占重要地位,具有成为预测化疗疗效生物标志物的潜能。但仍需大样本试验研究对于ERCC1 在胃癌化疗中的作用进行充分论证,从而实现进展期胃癌个体化治疗。
1 Ichikawa W,Sasaki Y. Challenges in predicting the clinical outcome in S-1 - based chemotherapy for gastric cancer patients[J]. Int J Clin Oncol,2008,13(3):206 -211
2 Al-Batran SE,Atmaca A,Hegewisch-Becker S,et al. Phase II trial of biweekly infusional fluorouracil,folinic acid,and oxaliplatin in patients with advanced gastric cancer[J]. J Clin Oncol,2004,22(4):658 -663
3 Bepler G,Kusmartseva I,Sharma S.RRM1 modulated in vitro and in vivo efficacy of gemcitabine and platinum in non - small - cell lung cancer[J].Clin Oncol,2006,24(29):4731 -4737
4 Olaussen KA,Dunant A,Fouret P. DNA repair by ERCC1 in nonsmall-cell lung cancer and cisplatin -based adjuvant chemotherapy[J].N Engl J Med,2006,355(10):983 -991
5 Lord RV,Brabender J,Gandara D.Low ERCC1 expression correlates with prolonged survival after cisplatin plus gemcitabine chemotherapy in non- small cell lung cancer[J]. Clin Cancer Res,2002,8(7):2286 -2291
6 Dikken JL,van Sandick JW,Maurits Swellengrebel H,et al. Neoadjuvant chemotherapy followed by surgery and chemotherapy or by surgery and chemoradiotherapy for patients with resectable gastric cancer (CRITICS)[J]. BMC Cancer,2011,11:329
7 Sakata Y,Ohtsu A,Horikoshi N,et al. Late phase II study of novel oral fluoropyrimidine anticancer drug S-1 (1 M tegafur-0.4 M gimestat -1 M otastat potassium)in advanced gastric cancer patients[J].Eur J Cancer,1998,34(11):1715 -1720
8 Yoshikawa T,Omura K,Kobayashi O,et al. A phase II study of preoperative chemotherapy with S -1 plus cisplatin followed by D2/D3gastrectomy for clinically serosa - positive gastric cancer (JACCRO GC-01 study)[J]. Eur J Surg Oncol,2010,36(6):546 -551
9 Sumpter K,Harper-Wynne C,Cunningham D,et al. Report of two protocol planned interim analyses in a randomized multicentre phase III study comparing capecitabine with fluorouracil and oxaliplatin with cisplatin in patients with advanced oesophagogastric cancer receiving ECF[J]. Br J Cancer,2005,92(11):1976 -1978
10 Koizumi W,Narahara H,Hara T,et al. S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer (SPIRITS trial):A phase III trial[J]. Lancet Oncol,2008,9(3):215 -221