创伤后应激障碍大鼠杏仁核神经元Akt和mTOR磷酸化降低*
2014-01-14王海涛徐爱军卢鹤翔
耿 菲,刘 昊,王海涛△,徐爱军,卢鹤翔,阚 泉
(1.河北联合大学基础医学院组织学与胚胎学系,河北唐山 063000;2.河北联合大学附属医院神经内科)
(基础医学栏目编辑:陈志宏)
随着战争、社会暴力事件、重大交通事故和自然灾害等创伤意外不断增多,创伤后应激障碍(posttraumatic stress disorder,PTSD)的发生率越来越高,成为目前研究的热点之一[1]。动物实验研究表明,PTSD大鼠海马、杏仁核部位存在明显的神经元凋亡现象[2-3]。磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)信号转导途径是介导细胞凋亡的重要信号转导途径,能抑制细胞凋亡,促进细胞生存和增殖[4-5]。但该通路在PTSD杏仁核神经元中的作用尚未见报道。在大鼠接受SPS后立即给予不可逃避的足底电击(single inescapable electric foot shock after SPS procedures, SPS & S),是 研 究PTSD较好的动物模型[6]。本研究利用SPS & S诱导的大鼠PTSD动物模型,观察了PTSD大鼠杏仁核PI3K/Akt/mTOR信号通路的变化情况,以探讨PI3K/Akt/mTOR信号通路在PTSD发病过程中的作用。
1 材料与方法
1.1 实验动物与试剂 健康成年雄性Wistar大鼠40只,体重(180±10)g,由河北联合大学实验动物中心提供(动物合格证编号:SCXK京2009-0004)。兔抗鼠p-Akt多克隆抗体、羊抗鼠p-mTOR多克隆抗体,购自Santz Cruz公司;免疫印迹相关试剂购自武汉博士德生物工程有限公司。
1.2 动物分组、PTSD模型的建立及取材 随机将大鼠分为对照组和模型组,每组20只。模型组采用SPS & S应激制备PTSD大鼠模型,造模后22-25℃、昼夜节律、自由饮水、摄食饲养7d。对照组不做处理。两组大鼠分别于静养结束后处死,行免疫组化染色和Western blot分析。
1.3 免疫组化染色 每组随机选取10只大鼠,2%戊巴比妥钠(35mg/kg)腹腔注射麻醉,4%多聚甲醛心脏灌流固定,取脑组织常规石蜡包埋,5 μ m切片。行SABC免疫组织化学染色,一抗工作液浓度1:200,4℃冰箱过夜,二抗室温孵育1小时,DAB显色。用Motic Med 6.0数码医学图像分析系统对阳性细胞进行半定量分析,测定平均光密度(OD)值。
1.4 Western blot检测 取两组剩余的10只大鼠,2%戊巴比妥钠(35mg/kg)腹腔注射,断头取脑。根据图谱,在体视显微镜下快速分离杏仁核,提取总蛋白。定量后蛋白上样量30μ g,行120g/L SDS-PAGE电泳,PVDF膜电转印,脱脂奶粉封闭,一抗(p-Akt,1:500;p-mTOR,1:350)4℃孵育过夜,二抗IgG(1:5000)室温孵育1h,ECL显色。同样方法进行内参照β-actin的Western blot分析。以目的条带与内参照的光密度比值表示目的蛋白的相对表达量。
2 结果
2.1 免疫组化染色结果 p-Akt和p-mTOR免疫阳性产物均为棕黄色颗粒,定位于神经元胞浆。对照组p-Akt、p-mTOR免疫反应阳性细胞较多、模型组阳性细胞数量明显减少,定量分析结果显示,模型组p-Akt、p-mTOR的表达明显低于对照组(P<0.05)。见附表:
附表 杏仁核神经元p-Akt和p-mTOR的表达(±s,n=10)
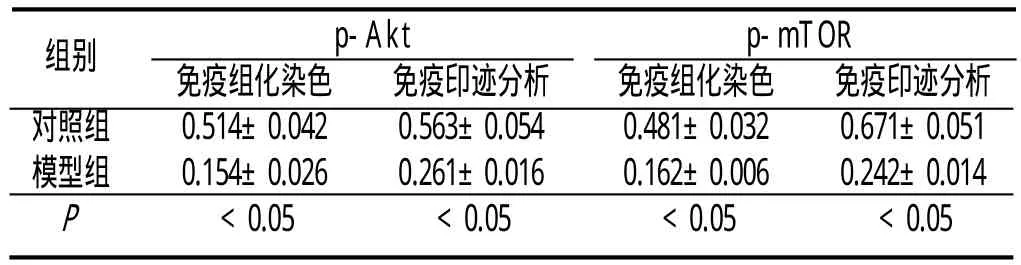
附表 杏仁核神经元p-Akt和p-mTOR的表达(±s,n=10)
组别 p-Akt p-mTOR免疫组化染色 免疫印迹分析 免疫组化染色 免疫印迹分析对照组 0.514±0.042 0.563±0.054 0.481±0.032 0.671±0.051模型组 0.154±0.026 0.261±0.016 0.162±0.006 0.242±0.014 P <0.05 <0.05 <0.05 <0.05
2.2 Western blot结果 模型组杏仁核p-Akt、p-mTOR的相对表达水平显著低于对照组,组间比较差异具有统计学意义(P<0.05,附图、附表)。表明模型组大鼠杏仁核Akt和mTOR蛋白磷酸化水平降低。

附图 杏仁核p-Akt和p-mTOR蛋白的表达(Western blot法)
3 讨论
目前,PTSD发病率增高给社会造成沉重负担,探讨其发病机制成为当今的热点研究内容。临床资料和动物实验均表明,PTSD时杏仁核体积缩小、神经元凋亡明显增加[7-9]。本研究在前期实验的基础上[9-12],探讨了PTSD时杏仁核神经元Akt/mTOR信号通路的变化。
Akt和mTOR是Akt/mTOR信号通路的关键分子,该通路活化可以抑制多种刺激诱发的细胞凋亡。Akt又称蛋白激酶B(PKB),是PTEN/PI3K/Akt信号通路的效应因子,其磷酸化可导致下游磷酸化级联反应,包括激活其下游的mTOR以及与靶蛋白之间的相互作用,参与调控细胞的生长与存活、增殖与凋亡等多种生物学效应。本研究发现,PTSD模型大鼠杏仁核p-Akt和p-mTOR蛋白的表达明显降低。提示,在PTSD发病过程中杏仁核神经元Akt和mTOR的磷酸化程度较正常情况降低,因此减弱了对凋亡的调控作用,从而导致神经元凋亡增加。在Akt/mTOR信号通路中,激活后的p-mTOR有两条不同的下游通路,核糖体S6蛋白激酶(S6 kinase,S6K)和真核生物始动因子4E结合蛋白l(4E binding protein 1,4E-BPl)。在PTSD时杏仁核神经元信号调控中,p-mTOR具体通过哪条途径控制细胞的生存和凋亡,值得进一步深入研究。
[1] North CS, Pfefferbaum B, Kawasaki A, et al. Psychosocial adjustment of directly exposed survivors 7 years after the Oklahoma City bombing[J]. Compr Psychiatry, 2011, 52(1):1-8.
[2] Liu H, Wang HT, Han F, et al. Activity of 5-HT1A receptor is involved in neuronal apoptosis of the amygdala in a rat model of post-traumatic stress disorder[J]. Mol Med Rep, 2011,4(2):291-295.
[3] Xiao B, Yu B, Wang HT, et al. Single-prolonged stress induces apoptosis by activating cytochrome C/caspase-9 pathway in a rat model of posttraumatic stress disorder[J]. Cell Mol Neurobiol,2011, 31(1): 37-43.
[4] Kang S, Dong SM, Kim BR, et al. Thioridazine induces apoptosis by targeting the PI3K/Akt/mTOR pathway in cervical and endometrial cancer cells[J]. Apoptosis, 2012, 17(9): 989-997.
[5] Saiki S, Sasazawa Y, Imamichi Y, et al. Caffeine induces apoptosis by enhancement of autophagy via PI3K/Akt/mTOR/p70S6K inhibition[J]. Autophagy, 2011, 7(2):176-187.
[6] Wang W, Liu Y, Zheng H, et al. A modified single-prolonged stress model for post-traumatic stress disorder[J]. Neurosci Lett,2008, 441(2):237-241.
[7] Morey RA, Gold AL, LaBar KS, et al. Amygdala volume changes in posttraumatic stress disorder in a large case-controlled veterans group[J]. Arch Gen Psychiatry, 2012, 69(11):1169-1178.
[8] Kuo JR, Kaloupek DG, Woodward SH. Amygdala volume in combat-exposed veterans with and without posttraumatic stress disorder: a cross-sectional study[J]. Arch Gen Psychiatry, 2012,69(10):1080-1086.
[9] 王海涛,刘昊,徐爱军,等.创伤后应激障碍大鼠海马和杏仁核中神经元凋亡及Caspase-9的表达及其意义[J].吉林大学学报(医学版),2013,39(3):427-431.
[10] 隋竹欣,刘昊,朱玉英,等.创伤后应激障碍大鼠海马神经元自噬增强[J].神经解剖学杂志,2013,29(3):325-328.
[11] 徐爱军,李冉,王海涛,等.创伤后应激障碍大鼠海马组织5-HT1A受体mRNA的表达[J].中风与神经疾病杂志,2012,29(2):137-139.
[12] 徐爱军,耿菲,王海涛.单一连续应激对大鼠行为学和海马Bcl-2、Bax的影响[J].中风与神经疾病杂志,2012,29(4):312-314
