猪细小病毒HLJ-DN株分离鉴定
2014-01-14刘秀芬姜艳平唐丽杰李一经
刘秀芬,姜艳平,唐丽杰,李一经*
(1.东北农业大学动物医学学院,哈尔滨 150030;2.湖北科技学院医药研究院,湖北咸宁 437100)
猪细小病毒HLJ-DN株分离鉴定
刘秀芬1,2,姜艳平1,唐丽杰1,李一经1*
(1.东北农业大学动物医学学院,哈尔滨 150030;2.湖北科技学院医药研究院,湖北咸宁 437100)
按照常规病毒分离方法,从黑龙江省某猪场怀孕母猪所产死胎的肝脏中分离到一株病毒。利用ST细胞进行培养,通过血细胞凝集试验、间接免疫荧光试验及电镜观察等对新分离毒株进行鉴定。结果表明,该病毒能在ST细胞上生长并引起明显拉网状细胞病变,按Reed-Muench法计算出TCID50为10-4.6·0.1 mL-1;通过电镜观察可见直径约为20 nm无囊膜的病毒粒子,该病毒能凝集0.5%的豚鼠红细胞,免疫荧光试验显示在细胞上出现明显荧光,能与特异性抗体发生反应。对VP2基因进行扩增及测序并与GenBank已发表PPV毒株序列进行比对分析,结果显示该毒株与WB-143株在同一个分支里,同源性高达到99.8%,说明分离的病毒为猪细小病毒,命名为HLJ-DN,该病毒的分离为研究当地猪细小病毒的流行、预防和治疗奠定。
猪细小病毒;ST细胞;分离鉴定;VP2基因
猪细小病毒(Porcine parvovirus,PPV)是引起母猪繁殖障碍的重要病原之一,可导致怀孕母猪,特别是初产母猪感染后产生流产、死胎、木乃伊胎及新生仔猪死亡[1]。PPV是Mary等进行猪瘟病毒(CSFV)组织培养时发现并从母猪流产胎儿脏器中分离得到[2]。随后,各国分离到病毒和抗体[3-5]。
PPV有3种结构蛋白VP1、VP2和VP3,其中VP3是VP2水解后的产物,而VP2完全重叠于VP1中。VP2是构成病毒核衣壳的主要成分,含有猪细小病毒最主要的中和抗原决定簇,能够诱导产生中和抗体,是主要免疫保护性抗原[6]。VP 2的C端暴露在蛋白的表面,C段完整性是保持该蛋白二级结构关键,而N端位于二级结构内部,利用VP 2自我包装成空壳粒子的特性,将外源基因片段插入到N末端,用以表达外源基因,作为一种抗原的载体使用。Sedlik证实VP2暴露在外的几个氨基酸残基(378、383、436等)是决定病毒趋向性和毒力关键位点[7],这些位点是通过与宿主的多种细胞因子而不是通过宿主细胞表面受体起作用。VP1、VP2和VP3均有免疫原性,其中VP2免疫原性最高,VP1最差[8]。
近年来猪细小病毒弱毒疫苗和灭活疫苗的广泛使用,对于控制猪细小病毒的感染和流行起积极作用。本研究从黑龙江省某发病猪场所产死胎中,采取常规病毒分离的方法,分离到一株疑似猪细小病毒,对该毒株进行分离培养与鉴定,命名为HLJ-DN,并对该病毒的VP2基因进行克隆和测序,可为研究当地猪细小病毒的流行情况及病原特征提供理论依据。
1 材料与方法
1.1 病料的收集与处理
采集黑龙江某规模猪场的怀孕母猪所产死胎的脑、肾、肝等脏器病料,按照常规方法[9]进行处理,过滤除菌后,保存备用。
1.2 试剂及动物
鼠抗PPV血清由东北农业大学微生物免疫实验室保存;豚鼠购自哈尔滨兽医研究所实验动物中心;引物由北京奥科生物技术有限责任公司合成。
1.3 病毒的分离培养
采用传代细胞ST进行病毒培养,细胞传代同时将1.1的滤液接种到ST细胞上,接种量为原培养液1/10体积,设ST细胞对照。于37℃、5%CO2培养箱内培养,观察,待细胞病变(CPE)量达80%以上,收获病毒。如5~6 d无病变出现,再盲传5代,若无病变,进行PCR检测,阴性则丢弃。
1.4 病毒的血凝试验(HA)
将第12代病毒培养物反复冻融三次离心取上清作为病毒液进行血凝试验,方法参照文献[10],在血凝板的第一排1~12孔内各加入50 μL生理盐水,在第一孔内加入50 μL病毒抗原,然后依次倍比稀释至第11孔,最后一孔弃掉50 μL,然后每孔加入0.5%的豚鼠红细胞,轻轻振荡均匀,后放入37℃静止30 min,以50%红细胞凝集为判定终点,样品出现凝集终点的最高稀释度为该病毒的血凝价。
1.5 病毒TCID50的测定
将在ST细胞上盲传至第12代的病毒液,用不含血清的DMEM培养基从10-1~10-10进行梯度稀释,按照100 μL的量接种到96孔细胞板上,ST传代同时进行接毒,每个稀释度接种8个孔,并作阴性对照(未接毒的ST细胞)逐日观察记录CPE孔数。
1.6 病毒的免疫电镜观察
将病毒细胞培养液反复冻融3次,采用液相免疫电镜法-离心法[10],取含病毒的待检样品0.2 mL、生理盐水0.7 mL和稀释的已知抗血清(血清为鼠抗PPV血清)0.1 mL,充分混合(抗血清用连续10倍倍比稀释法确定适合的抗原、抗体比例);置37℃作用1 h,然后4℃过夜;10 000~15 000 r·min-1离心30 min;去上清,最后取沉淀负染,电镜检查。
1.7 免疫荧光试验
按文献[9]报道的方法进行。取接种病毒和未接种病毒60 h的细胞培养物,倒去培养上清液,刮取单层细胞培养物,制成细胞涂片,同鼠抗PPV血清37℃作用1 h,进行免疫荧光染色,镜检观测,并拍照记录。
1.8 病毒的PCR鉴定
本试验根据GenBank发表的猪细小病毒参考毒株NADL-2株VP2基因核苷酸序列,应用Oligo 6.0及Primer5.0等软件,设计出一对引物,进行VP2基因的扩增,将扩增目的基因回收后送宝生物工程有限公司(大连)进行序列测定,测序结果与GenBank已发表PPV毒株序列进行比对分析。引物扩增VP2基因长度为1 740 bp。引物序列如下:

2 结果与分析
2.1 病毒的分离
病料接种ST细胞,前五代未有病变,盲传至6代时,细胞接种病毒72 h后有明显的细胞病变,细胞随培养时间的加长先后呈现圆缩、融合、拉网等明显有规律的病变,最后病变细胞开始崩解脱落,未接种病毒的的ST细胞培养72 h后仅见有圆缩、脱落(见图1)。
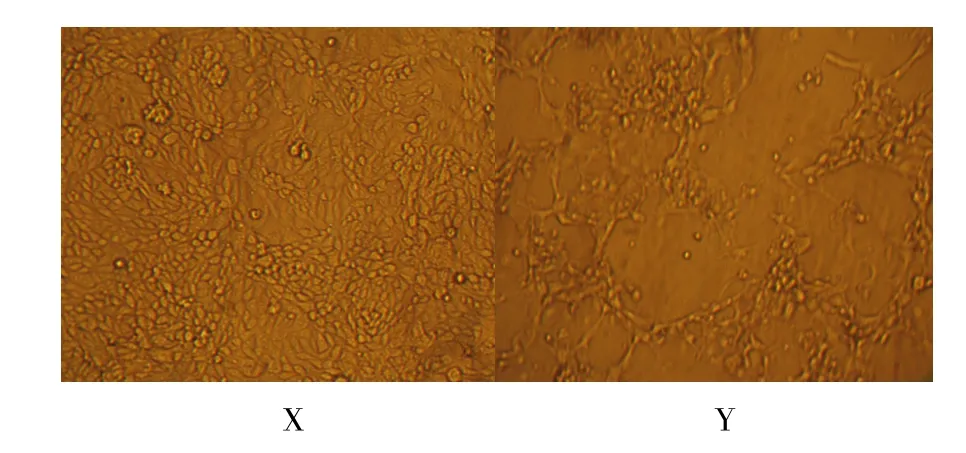
图1 正常ST细胞X和病变后的ST细胞YFig.1 Normal ST cells X and CPE of virus on ST cells Y
2.2 病毒的血凝试验结果
ST细胞培养的第12代毒能够凝集0.7%豚鼠红血球,对该病毒液进行倍比稀释,按常规微量法进行血凝试验,检测血凝效价为1∶256,如表1所示,结果表明,该培养液中有能够凝集红细胞病毒存在,且有较高血凝价。
2.3 病毒TCID50检测结果
将HLJ-DN第12代细胞培养物接种于含ST细胞悬液96孔细胞培养板,37℃培养72~80 h,计算出CPE孔数,按Reed-Muench法得出TCID50为10-4.6·mL-1,说明该病毒已经适应传代细胞培养且有较高病毒滴度。
2.4 病毒的免疫电镜结果
HLJ-DN株经2%磷钨酸染色在电镜下可见聚集成团的病毒粒子,无囊膜,呈球形或近似六角形,直径约为20 nm,能清晰的看到病毒粒子有空壳和实心两种(见图2),结果显示与猪细小病毒正常形态相符。

表1 血凝试验结果Table 1 Result of HAT

图2 HLJ-DN分离株免疫电镜结果Fig.2 Result of immunity electron microscope of isolated virus
2.5 免疫荧光试验
应用鼠抗PPV的免疫血清对接种病毒的细胞培养物和未接种病毒的对照细胞培养物进行间接免疫荧光试验,结果表明,接种病毒的细胞培养物多数细胞在其胞浆和细胞膜上出现绿色闪亮荧光;正常的细胞未见有绿色荧光(见图3)。
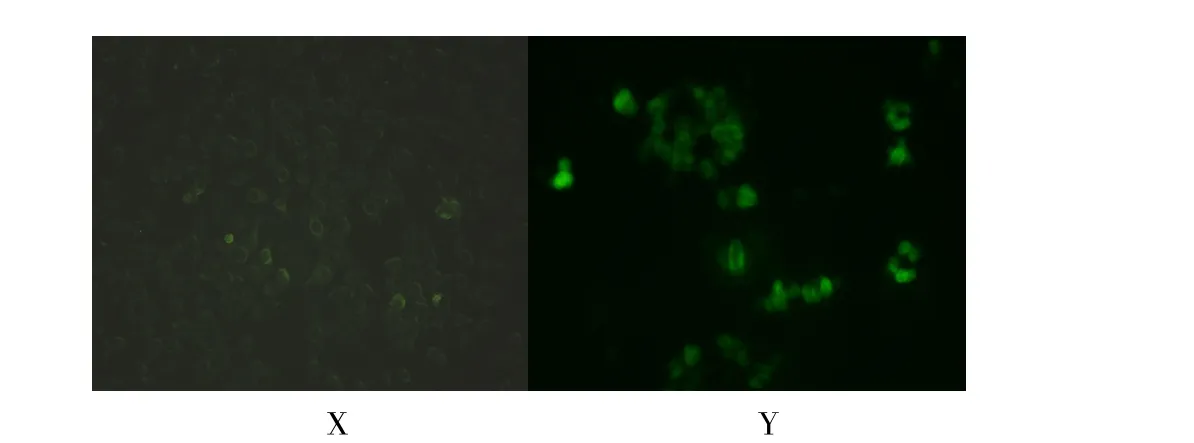
图3 接种病毒的ST细胞X和正常的ST细胞YFig.3 nocuLated virus ST cells X and normal ST cells Y
2.6 PCR鉴定及测序
提取HLJ-DN病毒基因组,以YVP2、ZVP2为引物,进行PCR鉴定,结果显示,在约1 740 bp处有一条特异目的带,该扩增与预期设计VP2基因大小相符。将获得的基因测序,与NCBI发布的其他25株PPV VP2基因序列进行比对,结果表明,该毒株与其他25株毒株的VP2基因存在6处核苷酸位点(Polymorphic site)差异,这些差异碱基散在的分布在整个VP2基因。利用DNAStar对VP2基因进行系统进化树分析(见图4),HLJ-DN与WB-143株在同一个分支里,同源性高达99.8%,与亲缘关系最远的WB-773同源性也达98.8%。
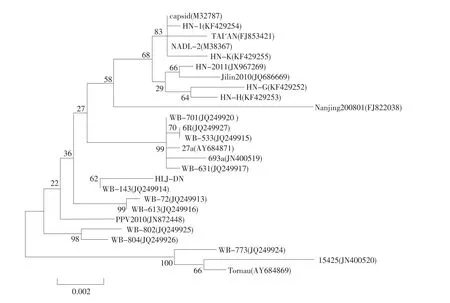
图4 HLJ-DN VP2基因遗传进化分析结果Fig.4 Phylogenetic analysis of VP2 gene of PPV
3 讨论与结论
猪细小病毒的各类疫苗使猪繁殖障碍疾病得到一定控制,但近年来又陆续出现该病报道[11-14],常与其他病原如猪圆环病毒、繁殖与呼吸障碍综合征病毒及蓝耳病等混合感染而致病,不同毒株有不同毒力和临床表现。对黑龙江省种猪群PPV感染研究,并分离到一株猪细小病毒,针对该病毒进行分子生物学和免疫学的鉴定,为下一步研究黑龙江流行毒株与其他流行毒株在基因结构或抗原性上是否有差异提供物质基础。
猪细小病毒增殖需要细胞源性DNA聚合酶用于自我复制[15],并需与细胞同步接种或仅当细胞长至30%~50%单层时接毒。此时细胞正处在分裂期,大多数细胞处在细胞周期的S期(即DNA合成期),最适合病毒对细胞的感染,本试验在病毒分离培养时采用同步接种,接毒量和细胞密度的比例必须适合,才能达到大量繁殖病毒和提高病毒滴度目的,需要多次试验才能摸索出最佳接种比例。朱绍辉等建议将ST细胞作为增殖PPV首选细胞[16],本研究采用ST细胞对HLJ-DN进行分离和传代,Coackley等发现[17],有些胎牛或成年牛血清中含有猪细小病毒生长抑制因子,含有该血清的细胞培养液会影响猪细小病毒的分离,所以在病毒的分离过程中本研究采用有别与其他病毒的接毒和培养方法,即在ST细胞传代同时按培养液量的1/10进行同步接毒,37℃培养1 h使病毒充分吸附和穿入细胞之后加入胎牛血清使终浓度至10%,24 h后换为含有较低浓度血清(2%)的DMEM维持液继续维持培养,从而减少血清对猪细小病毒生长的抑制。
在对HLJ-DN分离培养的过程中,本研究采用观察细胞病变、血凝试验及PCR试验对每代ST细胞培养物进行监测。前5代细胞培养物的监测结果显示,前5代细胞培养物没有明显的病变,对豚鼠的红细胞也没有血凝作用,但PCR检测有结果。第6代接毒细胞随培养时间后移先后呈现圆缩、融合、拉网等明显有规律的病变,病变细胞开始崩解脱落,有明显的细胞病变,血凝试验无结果,PCR检测有结果;第12代细胞培养物对豚鼠红细胞开始有血凝作用。这种现象与血凝试验的敏感性低及细小病毒形成病毒样空壳粒子干扰颗粒的特性有关,或与不同毒株本身的毒力、适应性等特性有关。
本试验利用血凝试验、免疫电镜观察、免疫荧光检测等方法对培养的第十二代病毒进行鉴定,其中血凝试验结果显示该毒株对豚鼠的红细胞有很好的血凝性,说明有病毒存在;免疫荧光试验结果显示该病毒能与猪细小病毒的特异性抗体发生结合,具有良好的反应原性;又通过免疫电镜形象直观地对该病毒进行观察,从形态上可明显看出有实心和空壳两种病毒粒子,外形特征也与猪细小病毒相符,对VP2基因进行扩增及测序,序列比对正确。对此分离毒株进行滴度测定,第十二代病毒的TCID50为10-4.6·mL-1,结果表明,滴度较高。后续研究将进一步研究其生物学特性、免疫原性及病毒的全基因核苷酸序列,以期为猪细小病毒的流行病学调查、诊断及防控提供指导和理论依据。
[1]Carwright S F,Huck R A.Viruses isolated in association with herd infertility,abortions and stillbirths in pigs[J].Vet Rec,1967, 81:196-197.
[2]殷震,刘景华.动物病毒学[M].北京:科学出版社,1997:681-688.
[3]潘雪珠.猪细小病毒S-1株的分离和鉴定[J].上海畜牧兽医, 1983(1):1-3.
[4]李刚明,姜天童,方雨玲,等.湖北省猪细小病毒感染的血清学调查报告[J].中国动物检疫,1995,12(1):27-29.
[5]程道祥,徐斯良,雷瑶,等.福建省猪细小病毒感染血清学调查及病毒分离[J].中国畜禽传染病,1991(1):34-36.
[6]Adriaan F G,Christianne J M,et al.A novel recombinant viruslike particle vaccine for prevention of porcine parvovirus-in⁃duced reproductive failure[J].Vaccine,2006,24(26):5481-5490. [7]Sedlik C,Saron M,Sarraseca J,et al.Recombinant parvoviruslike particles as an antigen carrier:A novel nonreplicative exoge⁃nous antigen to elicit protective antiviral cytotoxic T cells[J].Proc Natl Acad Sci,USA,1997,94:7503-7508.
[8]Bergeron J,Hebert,B Tijssen P.Genome organization of the Kres⁃se strain of porcine parvovirus:Identification of the allotropic de⁃terminant and comparison with those of NADL-2 andfield isolates [J].Virol,1996,70,2508-2515.
[9]连科迅,赵丽丽,张琳琳,等.传染性胰腺坏死病毒VP2 COE蛋白单克隆抗体的制备与初步应用[J].水产学报,2013(8):13. [10]胡桂学.兽医微生物学实验教程[M].北京:中国农业大学出版社,2006:131-140.
[11]王金良等.猪细小病毒PPV-SD1株VP2基因重组腺病毒表达载体的构建[J].东北农业大学学报,2008,39(8):100-103.
[12]赵浩军,王先炜,姜平,等.PMW S患病猪群中PCV2与CS⁃FV、PPV、PRRSV混合感染的调查[J].畜牧与兽医,2007,39 (3):32-34.
[13]贾赟,芦银华,张素芳,等.猪圆环病毒2型、猪繁殖与呼吸综合征病毒及猪细小病毒混合感染的流行病学调查[J].中国病毒学,2004(5):39-42
[14]刘业兵,张万林,范运峰,等.猪细小病毒SX株的分离鉴定[J].中国兽药杂志,2007,41(12):13-15
[15]Bachmann P A.Porcine parvovirus infection in vitro:A study mod⁃el for the replication of parvoviruses.I.Replication at different temperatures[J].Proc Soc Exp Biol Med,1972,140:1369-1374.
[16]朱绍辉,张述智,单虎,等.猪细小病毒X株在不同细胞上增殖效果比较[J].东北农业大学学报,2012,43(6):6-10.
[17]Coackley W,Smith V W.Porcine parvovirus in Western Australia [J].Aust Vet,1972,48:536-540.
Isolation and characterization of porcine parvovirous strain HLJ-DN/
LIUXiufen1,2,JIANG Yanping1,TANG Lijie1,LI Yijing1(1.School of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China;2.Medicine Research Institute of Hubei University of Science and Technology,Xianning Hubei 437100,China)
This research separates a virus from the liver of natural infection pregnant sows stillbirth from a farm in Heilongjiang Province,this virus can grow in the ST cells and lead to an obvious pathological changes in reticuLar cell.According to the Reed Muench method we can calculated the TCID50is 10-4.6·0.1 mL-1;By electron microscope we can observe some virus particles without posterior capsuLe and their diameter is about 20 nm,the virus can agglutinate 0.5%RBC of guinea pig,immunofluorescence test showed a significant fluorescence in the cells,they can react with specific antibody,at the same time we do theVP2 gene amplification and sequencing,we find the sequence alignment is correct.The results show the strain and WB-143 strain are the same branch,up to 99.8%homology.These results illustrated that the separation virus is porcine parvovirus,it named HLJ-DN.
porcine parvovirus;ST cell line;isolation and characterization;VP2 gene
S823
A
1005-9369(2014)06-0074-05
时间 2014-6-11 16:15:07 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20140613.0948.001.html
刘秀芬,姜艳平,唐丽杰,等.猪细小病毒HLJ-DN株分离鉴定[J].东北农业大学学报,2014,45(6):74-78.
Liu Xiufen,Jiang Yanping,Tang Lijie,et al.Isolation and characterization of porcine parvovirous strain HLJ-DN[J].Journal of Northeast Agricultural University,2014,45(6):74-78.(in Chinese with English abstract)
2014-01-20
黑龙江省高校创新团队项目(2011TD001)
刘秀芬(1981-),女,讲师,硕士,研究方向为兽医微生物与免疫学。E-mail:lxf915@163.com
*通讯作者:李一经,教授,博士,博士生导师,研究方向为兽医微生物与免疫学。E-mail:yijingli@163.com
