猪传染性胃肠炎和流行性腹泻病毒二联RT-PCR检测方法的建立
2014-01-14郑世民周首龙赵良友刘超男高雪丽吕晓萍
郑世民,周首龙,赵良友,刘超男,高雪丽,吕晓萍
(1.东北农业大学动物医学学院,哈尔滨 150030;2.黑龙江中医药大学药物安全性评价中心,哈尔滨 150040)
猪传染性胃肠炎和流行性腹泻病毒二联RT-PCR检测方法的建立
郑世民1,周首龙1,赵良友2,刘超男1,高雪丽1,吕晓萍1
(1.东北农业大学动物医学学院,哈尔滨 150030;2.黑龙江中医药大学药物安全性评价中心,哈尔滨 150040)
为建立猪传染性胃肠炎病毒(TGEV)和猪流行性腹泻病毒(PEDV)的快速检测方法,参照GenBank已发表序列,根据TGEV和PEDV的S蛋白基因结构各设计1套特异性通用引物,扩增目的带分别为426和583 bp。扩增产物经琼脂糖凝胶电泳,紫外光下于500 bp上、下各有一条电泳带,达到区分和鉴别目的。经优化确立最佳反应体系:引物、MgCl2和dNTP浓度分别为8、9和14 μmol·L-1,退火温度54℃。该方法在捕获信息和复杂基因分析方面具有快速、敏感、特异、低成本等优点,可为TGEV和PEDV检测及TGE和PED流行病学调查等提供技术支持。
猪传染性胃肠炎病毒;猪流行性腹泻病毒;反转录聚合酶链式反应;反应条件
猪传染性胃肠炎(Transmissible gastroenteritis,TGE)和猪流行性腹泻(Porcine epidemic diarrhea,PED)是由套式病毒目冠状病毒科冠状病毒属的传染性胃肠炎病毒(TGEV)和猪流行性腹泻病毒(PEDV)引起的猪急性、高发性、高度接触性肠道疾病[1-4]。两种疾病均以患病猪呕吐、腹泻和脱水为特征,临诊症状极其相似,经常出现二者混合感染现象,根据流行病学和临诊症状只能作出初步诊断,确诊需进行实验室检查,鉴别诊断工作较为困难[5]。因此,建立一种快速、敏感、特异、准确的诊断方法是监测猪传染性胃肠炎和猪流行性腹泻的关键。本试验建立TGEV和PEDV二联RT-PCR检测方法,可提高检测效率,减少成本,为鉴别诊断、病原检测等工作提供理论基础和技术支持。
1 材料和方法
1.1 病毒与细胞
TGEV(H株)、PEDV(CV777)、猪瘟病毒(HCV)、伪狂犬病病毒(PRV)、猪呼吸与繁殖障碍综合征病毒(PRRSV)、猪细小病毒(PPV)及PK-15细胞均由中国农业科学院哈尔滨兽医研究所提供。
1.2 主要试剂与仪器
总RNA提取试剂盒(Trizol Reagent),购自Invit⁃rogen公司;反转录酶(M-MLV Reverse Transcrip⁃tase),购自Promega公司;Taq DNA Polymerase,购自Fermentas公司;PTC-200 PCR仪,购自美国BIO-RAD公司。
1.3 引物设计与合成
参考GenBank上已发表的TGEV和PEDV全基因序列,比较分析二者S蛋白基因的保守区域,按照多重RT-PCR引物设计原则[6-7],利用Primer 5.0软件设计TGEV和PEDV特异性引物:TGEV(P1)5′TTGTCAACACACAAGGGCAAGC 3′,TGEV(P2)5′CAAGTCCAAAAGTGCGATCACC 3′,目的片段长度为426 bp;PEDV(P3)5′TCGTTTTGGGTGGTTA CCTACC 3′,PEDV(P4)5′AGTGGCAAATACATTG GCAGCG 3′,目的片段长度为583 bp。引物由北京英骏生物工程有限公司合成。
1.4 病毒培养与收集
分别将TGEV和PEDV接种于生长良好的单层PK-15细胞,盲传数代并收集细胞培养液,置于-80℃冰箱中储存备用。
1.5 PCR模板制备
参照Invitrogen公司提供的产品说明书,利用Trizol试剂盒提取细胞培养病毒悬液总RNA并鉴定提取质量;参照Promega公司反转录酶说明书,分别将所提取的TGEV和PEDV总RNA反转录合成cDNA,同时设无模板对照和阴性对照。
1.6 单项PCR扩增
1.6.1 目的片段扩增
分别以TGEV和PEDV的cDNA为模板,相应P1/P2、P3/P4为引物,建立50 μL的PCR反应体系:10.0 μL 10×PCRBuffer,8.0 μL dNTP Mixture(2.5 mmol·L-1),0.25 μL rTaq(5 U·μL-1),2.0 μL MgCl2(25 mmol·L-1),上、下游引物(10 mmol·L-1)各1.0 μL,4.0 μL cDNA,ddH2O补至50 μL,最后加入30 μL液体石蜡。反应条件分别为:94℃预变性5 min,94℃变性45 s,52℃退火45 s,72℃延伸45 s,共30个循环,72℃终延伸10 min(引物为P1/P2);94℃预变性5 min,94℃变性45 s,54℃退火45 s,72℃延伸30 s,共30个循环,72℃终延伸5 min(引物为P3/P4)。设阴性和无模板对照。扩增产物上样1%琼脂糖凝胶电泳(DNA Marker DL2000作为参比对照),经紫外检测仪观察结果。
1.6.2 目的片段的评价
将上述含目的片段的琼脂糖凝胶分别切下,应用小量胶回收试剂盒纯化PCR扩增产物后,连接pMD-18T载体并转化JM109感受态细胞(T-A克隆),Amp+-LB平板筛选阳性克隆后以Amp+-LB液体培养基增菌,采用质粒小提试剂盒提取质粒DNA,经质粒PCR扩增、酶切后电泳鉴定,并测序分析,测序工作由北京英骏生物工程有限公司完成,测定结果以DNAStar软件进行基因序列分析。
1.7 二联RT-PCR检测方法的建立
1.7.1 二联PT-PCR扩增
建立25 μL二联RT-PCR反应体系:7.87 μL ddH2O,5.0 μL 10×PCR Buffer,4.0 μL dNTP Mix⁃ture(2.5 μmol·L-1),4种引物(10 μmol·L-1)各0.5 μL,2种病毒cDNA各2.0 μL,2.0 μL MgCl2(25 μmol·L-1),0.13 μL rTaq(5 U·μL-1);反应条件: 94℃预变性5 min,94℃变性45 s,54℃退火45 s,72℃延伸45 s,共30个循环,72℃终延伸10 min。扩增产物及阴性对照产物同DL2000 Marker上样1%琼脂糖凝胶,电泳后经紫外检测仪检测并摄片。
1.7.2 反应体系及条件优化
在建立的二联RT-PCR检测方法的基础上,逐一对反应体系dNTP浓度、引物浓度、MgCl2及退火温度进行优化,确立反应体系与最适反应条件。
1.8 二联RT-PCR检测方法的评价
1.8.1 特异性检验
分别取TGEV cDNA模板、PEDV cDNA模板、TGEV和PEDV cDNA模板及对照病毒(HCV、PRV、PRRSV、PCV、PPV)反转录产物执行已建立的二联RT-PCR反应,产物经1%琼脂糖凝胶电泳后紫外检测仪观察。
1.8.2 敏感性检验
将TGEV和PEDV病毒cDNA模板分别做10倍梯度稀释,执行优化后二联RT-PCR反应,产物经1%琼脂糖凝胶电泳后紫外检测仪观察,以呈现阳性反应条带的模板用量,推算检出病毒TCID50值。
2 结果与分析
2.1 目的片段的PCR扩增
以设计的2对引物,分别与试验中制备的2种病毒PCR模板DNA进行扩增,扩增产物经琼脂糖凝胶电泳后利用紫外检测仪观察结果(见图1)。
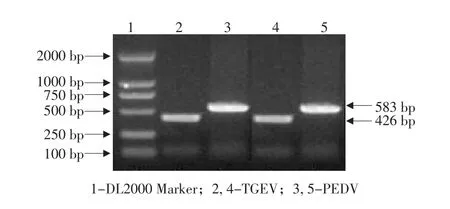
图1 单项PCR扩增产物电泳Fig.1 Electropherogram of production from monomial RT-PCR
由图1可见,在DL2000 Marker的500 bp标准指示条带上、下各有一条清晰、完整的特异性条带。目的片段经基因测序,TGEV P1/P2引物扩增产物长度426 bp,PEDV P3/P4引物扩增产物长度583 bp,达到预期效果。DNAStar软件分析发现,2条目的片段核苷酸序列与相应病毒基因组序列同源性达99%以上。
2.2 二联PCR反应体系与条件优化
以试验建立的二联PCR程序,分别对反应体系引物浓度、dNTP浓度、MgCl2及退火温度进行优化,各变量项扩增产物经琼脂糖凝胶电泳后利用紫外检测仪观察结果,可见反应体系TGEV引物(P1/P2)浓度在8~10 μmol·L-1范围内,PEDV引物(P3/P4)浓度在6~10 μmol·L-1范围内均可扩增出明亮条带,且2者浓度均为8 μmol·L-1时,目的条带最明亮(见图2);dNTP浓度在14~18 μmol·L-1范围内均可扩增出明亮条带(见图3);MgCl2浓度在6~9 μmol·L-1范围内均可扩增出明亮条带,且浓度为9 μmol·L-1时目的条带最为明亮(见图4);退火温度在44~58℃范围内,均可得到较好且完整的目的片段条带,但54℃时条带形状最佳(见图5)。
2.3 二联PCR方法特异性与敏感性检测
用建立的方法对TGEV和PEDV混合物、TGEV、PEDV、HCV、PRV、PPV、PRRSV 7个核酸样品进行扩增,结果含有TGEV和PEDV的核酸均扩增出与试验设计相符的目的片段条带,其他样品未见扩增(见图6)。敏感性检测发现,该方法可检出10-7稀释的TGEV和10-5稀释的PEDV cDNA模板(见图7),据此计算出可分别检出7.3 TCID50/0.1 mL的TGEV和9.6 TCID50/0.1 mL PEDV。

图2 引物浓度优化电泳Fig.2 Electropherogram of concentration optimization for primers
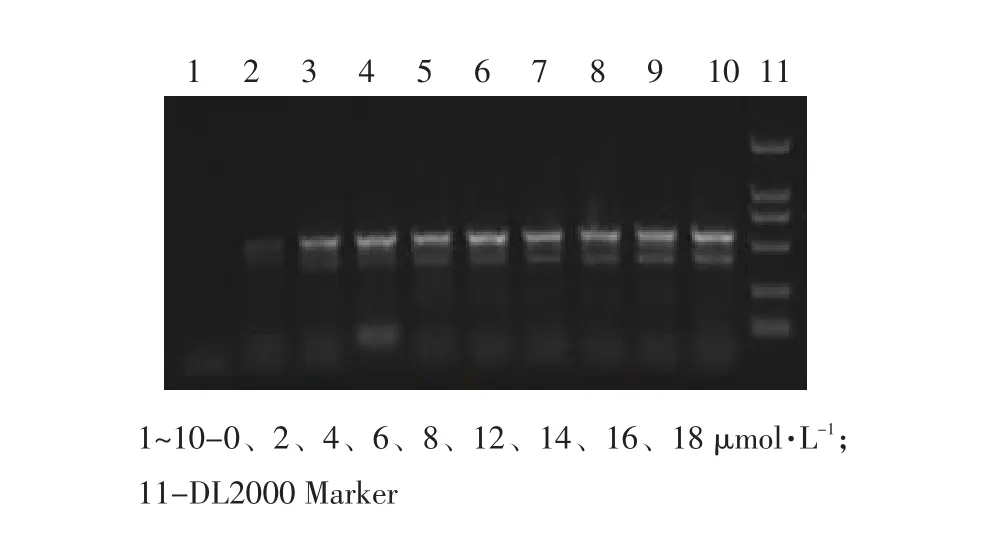
图3 dNTP浓度优化电泳Fig.3 Electropherogram of concentration optimization for dNTP

图4 MgCl2浓度优化电泳Fig.4 Electropherogram of MgCl2concentration optimization
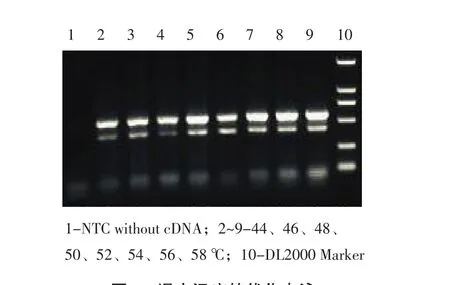
图5 退火温度的优化电泳Fig.5 Electropherogram of optimization of annealing temperature

图6 特异性检测电泳Fig.6 Electropherogram of specificity detection

图7 敏感性检测电泳Fig.7 Electropherogram of sensitivity detection
3 讨论与结论
TGEV与PEDV引起动物疾病(TGE、PED)在临诊症状上极为相似,常出现合并感染,基因组结构上与PRCV具有较高的同源性[1,8-10];传统诊断方法很难甄别。传统TGE和PED诊断方法主要有病毒中和试验、免疫荧光法、免疫电镜法、ELISA和RT-PCR法等,随分子生物学技术发展,荧光定量PCR和RT-LAMP等方法被用于病原检测和病毒性疾病诊断,但其操作成本较高,难于推广[11-12]。相比于上述方法,ELISA和RT-PCR法具有敏感性高、特异性强、重复性好、不易造成误诊或漏诊等优点[5-6]。
本试验根据TGEV和PEDV基因组自身特点,针对PRCV缺失的672 bp C抗原位点设计引物,成功建立同时检测TGEV和PEDV二联RT-PCR方法。优化过程中发现,该方法对反应条件要求较低、重复性极好。结合扩增效果和操作成本,确立最佳反应体系为:引物浓度为8 μmol·L-1、MgCl2浓度为9 μmol·L-1、dNTP浓度为14 μmol·L-1、退火温度为54℃。
由于该方法敏感性和特异性较高,短时间(5 h)内可做出准确诊断,可为疾病有效控制提供技术支持。尽管试验未对临床病料进行检测,但试验得出理论检出水平分别为TGEV 7.3 TCID50/0.1 mL、PEDV 9.6 TCID50/0.1 mL已远低于临床样品病毒含量。因此,该方法用于临诊病料检测可行。
[1]Costantini V,Lewis P,Alsop J,et al.Respiratory and fecal shed⁃ding of porcine respiratory coronavirus(PRCV)in sentinel weaned pigs and sequence of the partial S-gene of the PRCV isolates [J].Arch Virol,2004,149(5):957-974.
[2]Hälli O,Ala-Kurikka E,Nokireki T,et al.Prevalence of and risk factors associated with viral and bacterial pathogens in farmed Eu⁃ropean wild boar[J].Article The Veterinary Journal,2012,194(1): 98-101.
[3]Puranaveja S,Poolperm P,Lertwatcharasarakul P,et al.Chineselike strain of porcine epidemic diarrhea virus[J].Thailand Emerg Infect Dis,2009,15:1112-1115.
[4]Usami Y,Fukai K,Ichikawa Y,et al.Virological and serological studies of porcine respiratory coronavirus infection on a Japanese farm[J].J Vet Med Sci,2008,70(9):929-936.
[5]Sozzi E,Luppi A,Lelli D,et al.Comparison of enzyme-linked immunosorbent assay and RT-PCR for the detection of porcine epidemic diarrhoeavirus[J].Research in Veterinary Science, 2010,88(1):166-168.
[6]由超,赵大球,梁乘榜,等.PCR引物设计方法综述[J].现代农业科学,2011,17:48-51.
[7]Chen Y F,Chen R C,Chan Y K,et al.Design of multiplex PCR primers using heuristic algorithm for sequential deletion applica⁃tions[J].Computational Biology and Chemistry,2009,33(2):181-188.
[8]Lee D K,Park C K,Kim S H,et al.Heterogeneity in spike protein genes of porcine epidemic diarrhea viruses isolated in Korea[J]. Virus Research,2010,149(2):175-182.
[9]Zhang X S,Hasoksuz M,Spiro D,et al.Complete genomic se⁃quences,a key residue in the spike protein and deletions in non-structural protein 3b of US strains of the virulent and attenu⁃ated coronaviruses,transmissible gastroenteritis virus and por⁃cine respiratorycoronavirus[J].Virology,2007,358(2):424-435.
[10]Ba I,Jackwood D J,Benfield D A,et al.Differentiation of trans⁃missible gastroenteritis virus from porcine respiratory coronavirus and other antigenic ally related coronaviruses by using cDNA probes specific for the 5′region of the S glycoprotein gene[J].J Clin Microbiol,1991,29(1):215-218.
[11]张雷.猪传染性胃肠炎病毒的诊断研究进展[J].现代畜牧兽医,2010(5):59-62.
[12]庄金秋,梅建国,王金良,等.猪流行性腹泻病毒检测方法研究进展[J].中国兽药杂志,2013,47(4):65-67.
Establishment of duplex RT-PCR assay for detection of transmissible gastroenteritis virus and porcine epidemic diarrhea virus/
ZHENG Shimin1,ZHOU Shoulong1,ZHAO Liangyou2,LIU Chaonan1,GAO Xueli1,LV Xiaoping1(1.School of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China;2.Center for Safety Evaluation of Drugs,Heilongjiang University of Chinese Medicine,Harbin 150040,China)
Arapidduplex RT-PCR assay was developed for simultaneous detection and discrimination of transmissible gastroenteritis virus(TGEV)and porcine epidemic diarrhea virus(PEDV)using the primers designed basing on their S protein gene reported in GenBank.The producedemonstrated after agarose gels electrophoresis stained with ethidium bromide that one specific cDNA band of 426 bp for TGEV and another specific cDNA band of 583 bp for PEDV up and down the 500bp indicating band.Optimization reaction system:concentration of primers,MgCl2and dNTP were 8,9 and 14 μmol·L-1,respectively,and renaturation temperature was 54℃.This method took the advantages of rapid,sensitive,specific,andlow cost,in capturing information,analyzing the complexity of gene,which could provide technical support for detection of TGEV and PEDV,and epidemiological investigation of TGE and PED,etc.
transmissible gastroenteritis virus;porcine epidemic diarrhea virus;duplex RT-PCR; reaction condition
S852.65+1
A
1005-9369(2014)06-0057-04
时间 2014-6-11 16:03:36 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20140611.1603.001.html
郑世民,周首龙,赵良友,等.猪传染性胃肠炎和流行性腹泻病毒二联RT-PCR检测方法的建立[J].东北农业大学学报,2014,45 (6):57-60.
Zheng Shimin,Zhou Shoulong,Zhao Liangyou,et al.Establishment of duplex RT-PCR assay for detection of transmissible gastroenteritis virus and porcine epidemic diarrhea virus[J].Journal of Northeast Agricultural University,2014,45(6):57-60. (in Chinese with English abstract)
2013-12-12
黑龙江省教育厅面上项目(12531015)
郑世民(1959-),男,教授,博士,博士生导师,研究方向为畜禽病理学。E-mail:zhengshiminbl@sohu.com
