金樱子总黄酮体外抗氧化活性的研究
2014-01-10文红波曹运长吴玉兰张秋菊冷超群
文红波,曹运长,吴玉兰,张秋菊,冷超群
南华大学药学与生物科学学院,生化与分子生物学教研室,衡阳 421001
金樱子又名糖桔子、蜂糖罐、刺梨子、山石榴等,属蔷薇科蔷微属,其成熟果实可以入药[1]。通过对金樱子果实的化学成分分析表明其主要的药效成分有维生素、氨基酸、多糖,黄酮类物质、三萜类及其衍生物[2]。目前对金樱子多糖的药效研究已有报道,如赵云涛等[3]提取金樱子多糖进行动物小鼠试验,发现金樱子多糖能显著清除超氧阴离子自由基、抑制羟自由基,有显著的抗氧化作用。而对金樱子另一重要的药效成分黄酮类化合物的研究较少,黄云祥等[4]通过高效色谱法分析了金樱子黄酮化合物中分别含槲皮素、山萘酚、木犀草素、芹菜素等成分;陈乃富等[5]从金樱子中分离得到了黄酮类物质,并以亚油酸为底物,初步测定金樱子黄酮类化合物的抗氧化能力。但对金樱子黄酮化合物系统的体外抗氧化作用、药效研究还未见报道。本研究分析评价了金樱子总黄酮体外直接清除自由基的能力,并利用体外细胞培养方法,用过氧化氢诱导人脐静脉内皮细胞(HUVEC)损伤,研究金樱子总黄酮对HUVEC 抗氧化作用的影响,并初步探讨其可能的作用机制。
1 材料与仪器
1.1 药品与试剂
HUVEC 购自中国科学院细胞生物学研究所上海细胞库;芦丁标准品购自中国药品生物制品检定所;DMEM 培养基和胰蛋白酶干粉购自美国Gibco公司;胎牛血清购自杭州四季青;MTT 购自AMRESCO 公司;超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒购自南京建成生物工程研究所;其余试剂均为国产分析纯产品。
1.2 仪器
CO2培养箱,美国Shell-lab 公司;倒置显微镜,日本Nikon 公司;倒置显荧光显微镜,日本Olympus公司;酶标仪,美国Bio-Tek 公司;UV2450 紫外可见分光光度计,日本岛津公司。
2 实验方法
2.1 金樱子黄酮类化合物的制备
以乙醇为溶剂浸提法提取金樱子总黄酮(Rosa laevigata Michx total flavonoids,RLTF),优化的提取条件为:乙醇浓度40%、水浴温度90 ℃、固液比1∶20,浸提时间2 h。以芦丁为对照品,采用分光光度法对RLTF 进行定量。RLTF 干预处理细胞时过滤除菌,临用前用DMEM 培养液配成不同浓度。
2.2 RLTF 对、·OH、DPPH·自由基体外清除作用的测定
2.3 HUVEC 的培养
采用含10%胎牛血清的DMEM 培养基进行培养,根据细胞生长情况,给予换液;待细胞融合至70%,用0.25%胰蛋白酶进行消化,按1∶3 或1∶4 传代。
2.4 Hoechst33258 染色观察细胞凋亡
将细胞以2 ×104个/mL 接种在6 孔培养板中,每孔2.5 mL。待细胞生长铺满培养板70%时,加入含1%血清的DMEM 培养液同步12 h。实验分组为:(1)正常组;(2)200 μmol/L H2O2处理组;(3)400 μmol/L H2O2处理组;(4)600 μmol/L H2O2处理组;(5)800 μmol/L H2O2处理组;(6)1000 μmol/L H2O2处理组;(7)RLTF +600 μmol/L H2O2处理组;(8)RLTF+800 μmol/L H2O2处理组。第(7)与第(8)组先用0.24 mg/mL RLTF 预处理24 h 后再用相应浓度的H2O2处理24 h。将原培养液吸干,每孔加1 mL 4%多聚甲醛于4℃固定20 min,固定完用PBS 洗3 次,每次5 min;每孔加1 mL 染色液于37℃染色20 min;染色后用PBS 洗3 次,每次5 min。荧光显微镜观察拍照。
2.5 MTT 法检测RLTF 对细胞活力的影响
将细胞以2 ×104个/mL 的密度接种于96 孔培养板中,每孔200 μL;待细胞融合率为70%时,加入含1%胎牛血清的DMEM 培养液继续培养24 h;根据细胞存活率确定600 μmol/L H2O2作用细胞24 h为施加条件[7]。实验分组为:(1)正常组;(2)H2O2损伤组:加600 μmol/L H2O2处理24 h;(3)Vc 阳性对照组:0.2 mg/ml Vc 预处理24 h,再加600 μmol/L H2O2处理24 h;(4)RLTF 处理组:以0.12 mg/mL、0.24 mg/mL、0.48 mg/mL RLTF 预处理24 h后,再加600 μmol/L H2O2处理24 h。各组细胞每孔均加入20 μL MTT 溶液继续培养4 h,弃培养液,各组细胞每孔加入150 μL DMSO;放入摇床摇10 min,充分反应,酶标仪490 nm 处测吸光值(OD)。
2.6 细胞SOD、CAT、GSH-Px 酶活性测定
按2.5 分组要求处理后,收集细胞,加入细胞裂解液,随后4 ℃,12000 rpm 离心10 min。取上清按照试剂盒说明测定各组细胞SOD、CAT、GSH-Px 活性。
2.7 统计学处理
3 实验结果
3.1 RLTF 对、·OH、DPPH·的清除作用
结果见图1。实验表明:在20~200 μg 范围内,随着待测样品加入量的增大,RLTF 和Vc 对O-·2 的清除作用先增大后减小;芦丁对的清除作用则随着加入量的增大而逐渐减小;与芦丁和Vc 比较,RLTF 对O-·2 的清除作用偏低。随着待测溶液加入量的增大,RLTF 和Vc 对·OH 的清除作用逐渐增大,芦丁对·OH 的清除作用则先增大后减小,RLTF对·OH 的清除能力与芦丁相当。RLTF、芦丁和Vc对DPPH·的清除能力随着加入量的增加而逐渐增强,RLTF 对DPPH·的清除率强于芦丁,但Vc 对DPPH·的清除能力要远高于RLTF 和芦丁。
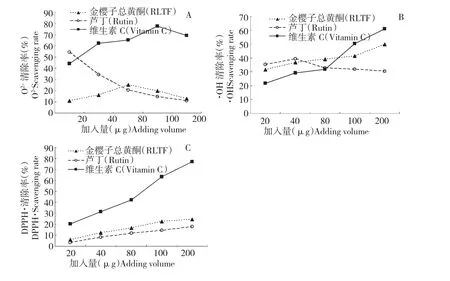
图1 RLTF 对(A)、·OH(B)、DPPH·(C)的清除作用Fig.1 Scavenging capacities of RLTF on superoxide anion (A),·OH (B)and DPPH· (C)
3.2 Hoechst 33258 染色观察细胞凋亡
经Hoechst33258 染色后,在荧光显微镜下观察,发现正常细胞的细胞核会呈现正常的蓝色,而凋亡细胞的细胞核则会呈致密浓染,或呈碎块状致密浓染,颜色发亮。如图2 所示,正常组HUVEC 细胞呈浅蓝色荧光,浅染;200 μmol/L H2O2损伤组细胞有几个强度很亮的蓝色亮点(即凋亡小体,箭头所示);400、600 μmol/L H2O2损伤组与正常组比较细胞数量开始减少,部分细胞的核呈致密浓染,且蓝色亮点数目逐渐增多。800、1000 μmol/L H2O2损伤组与正常组相比细胞数目显著减少,且有大量高强度蓝色亮点。经过RLTF 预处理24 h 后的600、800 μmol/L H2O2损伤组与600、800 μmol/L H2O2损伤组比较,细胞数目虽都表现明显较少,但高强度蓝色亮点的细胞数比未经RLTF 预处理的要少,表明RLTF 对内皮细胞具有一定的保护作用,减少了H2O2对细胞的损伤,增强了内皮细胞的抗凋亡作用。
3.3 RLTF 对HUVEC 细胞活力的影响
从表1 可看出,用H2O2诱导细胞损伤后,细胞活力显著降低,正常细胞组与Vc 阳性对照组细胞活力均高于H2O2损伤组。不同浓度RLTF 预处理组与H2O2损伤组比较,各组细胞活力均高于H2O2损伤组,差异均有统计学意义(P<0.01=,且随着RLTF 浓度的增加,细胞的活力逐渐增大。
3.4 RLTF 对受损内皮细胞SOD、CAT、GSH-Px 酶活力的影响

图2 不同处理组凋亡细胞形态(Hoechst33258 染色,×100)Fig.2 The apoptosis cell morphology of different treatment groups (Hoechst33258 staining,×100)
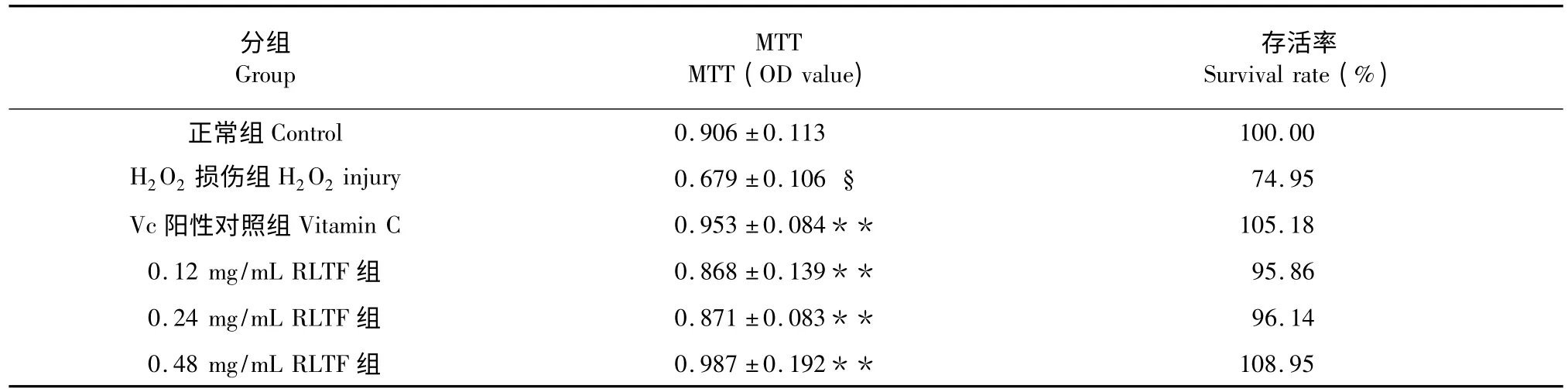
表1 RLTF 对氧化损伤HUVEC 细胞活力的影响Table 1 Effect of RLTF on the viability of HUVECs injured by hydrogen peroxide
结果见表2。实验结果表明,用H2O2诱导细胞损伤后,细胞内的SOD、CAT、GSH-Px 酶活性与正常组比较显著降低(P<0.01)。与H2O2损伤组比较,不同浓度的RLTF 预处理组细胞中的SOD、CAT、GSH-Px 酶活性均出现升高,除0.12 mg/mL RLTF处理组细胞SOD 活性与H2O2损伤组差异无统计学意义外,其余各组与H2O2损伤组比较差异均有统计学意义(P<0.01)。且随着RLTF 浓度的增大,三种酶活性呈剂量依赖性的升高。

表2 RLTF 对氧化损伤HUVEC 中SOD、CAT、GSH-Px 活性的影响Table 2 Effect of RLTF on SOD,CAT and GSH-Px activity of HUVECs injured by hydrogen peroxide
4 分析与讨论
自由基是人体在进行生命活动时产生的一种活性分子,自由基的生成和清除处于动态平衡之中。如果自由基产生过多或未及时清除会导致细胞内自由基的积累,其会严重损害生物膜、核酸、蛋白质、酶及活细胞的功能,继而导致细胞和组织器官损伤、诱发各种疾病、加速机体衰老。目前研究表明许多心血管疾病或炎症,都与自由基有关,如细胞内的过量的自由基会导致低密度脂蛋白(LDL)过氧化成为ox-LDL,过量的ox-LDL 被巨噬细胞摄取后转化为泡沫细胞并黏附在血管内壁,而后发展为动脉粥样硬化。因此人工化学合成或寻找天然的抗氧化剂对预防和治疗心血管疾病具有重大的现实意义。目前人们先后从植物中提取了许多具有自由基清除能力的天然产物,其中黄酮类化合物是活性较强的一类。本实验结果表明金樱子总黄酮体外对·OH 自由基、DPPH·自由基具有较强的直接清除作用,但对自由基的直接清除能力较弱。
内皮细胞损伤在多种心血管疾病发生和发展过程中起关键作用,而活性氧则是众多诱导内皮细胞损伤的原因之一[8]。活性氧过氧化氢对细胞的损伤作用近年来一直是研究的热点。有研究表明过氧化氢能诱导细胞凋亡,当将内皮细胞暴露于适度低浓度H2O2时,细胞会发生凋亡[9]。本研究中发现,低浓度的H2O2处理组,细胞形态发生改变,细胞存活率也有所下降,少数细胞的细胞核出现致密浓染,随着H2O2浓度的增加,细胞存活率显著下降,核出现致密浓染的比例明显增高,当H2O2达到1000 μmol/L 时,几乎所有细胞出现核致密浓染,同时大部分细胞已坏死或凋亡。而经过金樱子总黄酮预处理之后的细胞其抗凋亡能力在一定程度上得到增强,并能有效提高细胞的存活率。机体对自由基的清除主要是通过体内的抗氧化酶系,已有研究证实黄酮类化合物能提高机体的抗氧化酶活性[10]。本研究中过氧化氢损伤组与正常组比较,细胞内的SOD、CAT、GSH-Px 三种酶的活性均有所下降,但经过不同浓度的金樱子总黄酮预处理之后,三种抗氧化酶的活性显著升高,表明金樱子总黄酮能明显提高细胞内SOD、CAT、GSH-Px 酶活力。
金樱子果肉中黄酮含量较高,其所含有的黄酮类化合物是具有很大开发价值的天然抗氧化剂。金樱子总黄酮对氧化损伤的人脐静脉内皮细胞具有一定的保护作用,其抗氧化机制可能通过直接清除自由基,抑制细胞凋亡,提高体内抗氧化酶活性有关,但其具体的作用机制还有待进一步研究。
1 Lin FH(林芳花),Peng YH(彭永宏),Zeng LD(曾令达).Research status of quality standards of Rosa laevigata Michx.Guangzhou Chem Ind(广州化工),2010,38(4):5-8.
2 Min J(闵俊),Li YY(李燕燕),Yu H(余华).Chemical composition,pharmacological effects and advances in Clinical application research of Rose laevigata Michx.Glob Trad Chin Med(环球中医药),2008,1(2):16-18.
3 Zhao YT(赵云涛),Guo XM(国兴明),Li FZ(李付振).Anti-oxidative activity of polysaccharide from Rosa Laevigata Michx.J Biol(生物学杂志),2003,20(2):23-24.
4 Huang YX(黄云祥),Wang JJ(王锦军),Zhang XM(张秀梅).Simultaneous determination of quercetin,luteolin and apigenin in Rosa laevigata by HPLC.Res Pract Chin Med(现代中药研究与实践),2009,23:32-35.
5 Chen NF(陈乃富),Zhang L(张莉).Study on the antioxidant property of flavonoid compound in Rosa laevigata Michx.Forest By-Prod Specy Chin(中国林副特产),2005,19(5):2-4.
6 Zou JB(邹江冰),Yuan J(袁进),Jiang LL(蒋琳兰).Study on antioxidant activity of flavonoid from the leave of 2 Kinds of Passiflora edulis.Chin Pharm(中国药房),2010,21:3280-3282.
7 Cao YC(曹运长),Wen HB(文红波),Wu YL(吴玉兰),et al.Protective effect of Rosa laevigata Michx total flavonoids on vascular endothelial cells injury induced by hydrogen peroxide.Lishizhen Med Mat Med Res(时珍国医国药),2013,24:1159-1161.
8 Pawlak K,Naumnik B,Brzosko S,et al.Oxidative stress-a link between endothelial injury,coagulation activation,and atherosclerosis in haemodialysis patients.Am J Nephrol,2004,24:154-161.
9 Middleton J,Americh L,Gayon R,et al.Endothelial cell phenotypes in the rheumatoid synovium:activated,angiogenic,apoptotic and leaky.Arthritis Res Ther,2004,6(2):60-72.
10 Ai G,Liu Q,Hua W,et al.Hepatoprotective evaluation of the total flavonoids extracted from flowers of Abelmoschus manihot(L.)Medic:In vitro and in vivo studies.J Ethnopharmacol,2013,146:794-802.
