两种湿地植物枯落物还田分解速率对典型气候环境因子变化的响应
2014-01-09张艳楠
张 宁,张艳楠
(1.上海市政工程设计研究总院(集团)有限公司,上海市 200092;2.同济大学环境科学与工程学院,上海市 200092)
0 前言
土壤碳库是地球表层系统中最大的碳储库,其中土壤有机碳储量的变化对全球碳循环具有重要的意义[1]。植被通过光合作用固定大气中的CO2,其植物枯落物是土壤有机碳库的主要碳输入途径,而枯落物的分解过程则是土壤释放CO2的主要方式,所以植物枯落物的降解是全球碳循环的一个关键过程[2]。深入研究枯落物还土的降解性质,以及环境因素对枯落物分解的影响对于人们更好地保护土壤碳库及其生态功能具有重要的指导意义。
湿地生态系统一方面具有较高的初级生产力,另一方面,由于长期处于水淹状态,所以导致其中微生物活性相对较弱,来自土壤呼吸的CO2释放量较少,因此通常被认为是一个“碳汇”[3]。唐玉姝的研究发现,长江口地区芦苇和互花米草具有较高的生物量,但是芦苇湿地的土壤呼吸较互花米草更低,这可能是由于在原位芦苇秸秆比米草秸秆更难降解[4]。但是由于气候环境的日益变化,其对湿地生态系统也会带来不可忽略的影响。大气CO2浓度增加将引起温室效应,影响地球表面其它环境因子如温度升高等;同时,城市工业废水和生活污水大量排入海中,使营养物质在水体中富集,导致沿海水域富营养化加剧[5]。这些气候/环境因素的变化将导致湿地水土环境质量问题,并可能直接或间接影响植物枯落物的分解速率。所以有必要分析湿地植物枯落物分解对于气候环境变化的响应,确定未来气候环境变化下的高碳汇植物类型,优化湿地系统的“碳汇”功能。
因此,在研究中,采用人工气候室调控气候环境变化因子,包括温度升高、大气中CO2浓度增加、海水富营养化等,选取了九段沙湿地生态系统的两种典型植物芦苇和互花米草作为研究对象,分析温度升高、大气中CO2浓度增加、海水富营养化等因子单独作用和共同作用下对植物枯落物还田后分解过程的影响,以期预测未来气候环境变化背景下九段沙湿地生态系统中典型植被的分解特性,为提高土壤有机碳保留能力提供理论依据。
1 材料与方法
1.1 实验设计
因温度升高与CO2浓度增加引起的温室效用往往相互关联,因此将两者作为一因素,加上海水富营养化带来的N、P浓度增加因素,设计2因素2水平试验如表1所列。
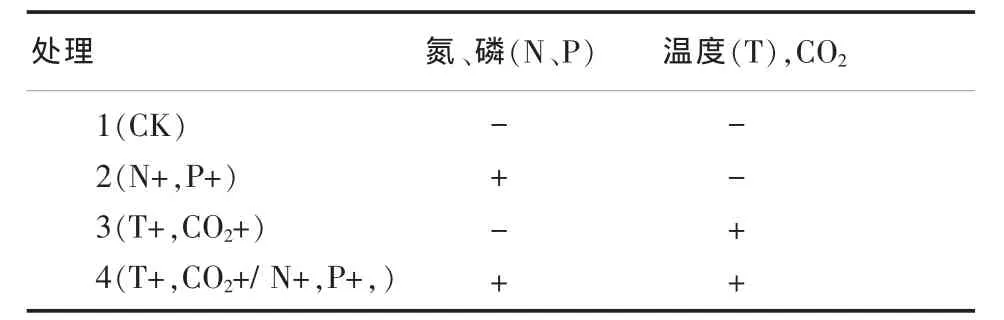
表1 试验设计一览表
根据该设计,在室内控制条件下进行模拟九段沙生态系统植物枯落物还田后的分解试验,设置施氮、磷营养元素和增温、CO2倍增2种单因素处理。其中,增施氮、磷模拟九段沙湿地系统中水体富营养化加剧因子,增温、CO2倍增模拟全球气候变化因子。同时,设置对照CK及两因素共同作用处理。
采用2台宁波海曙赛福仪器厂生产CO2人工培养箱PRX-1000C对温度、湿度、CO2浓度、光照、昼夜时间等环境条件进行控制。且根据实验需要,将人工气候室内分成2个小格,在每个小格中放入一个48 cm×48 cm×30 cm的 P VC箱,其隔板上有渗水孔25个(直径2 cm),侧面有通气孔和排水孔各1个(直径3 cm)。每个箱中分别装入近100 kg混合均匀的土壤,箱底隔板上层铺有砂石混合物1 cm。图1为PVC箱示意图。
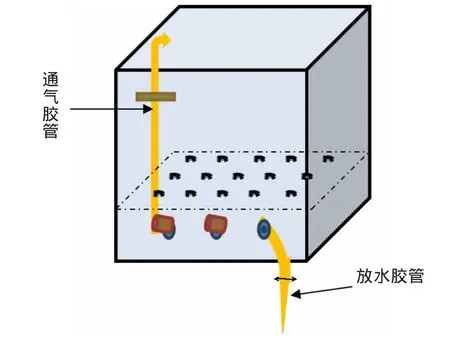
图1 PVC箱示意图
于2010年11月,在九段沙湿地各植被为优势群落的样点,分别采集芦苇和互花米草两种枯落物,经清洗、70℃烘干至恒量,剪切成20 cm左右,分装等量于分解袋中。并于2011年11月,将预处理后的分解袋埋入各PVC箱内,每个PVC箱内两种植物各两袋共4袋,具体布置见图2所示。
图中N代表无机氮;P代表无机磷;T代表温度;+代表因素高水平处理;-代表因素低水平处理。
1.2 运行设置
按照上海市近十年来的气象资料,核算每季度的平均气温,昼夜温差设定为5℃,温度增高组设定增高幅度为4℃(见表2);CO2低水平设定为350 ppm,高水平设定为倍增的700 ppm。
各PVC箱内每天加入人工配置海水模拟九段沙湿地系统中的潮汐海水冲刷,其中低N、P水平按照九段沙附近海域中海水中的数据为参考,测得其各项指标分别为:pH为7.78,含盐量为3.40 g/L,无机氮的含量为0.401 mg/L,速效磷的含量为0.048 mg/L。人工配置海水为65 g海水盐加入15L自来水中,经测定pH为7.61,含盐量为3.03 g/L,无机氮含量为0.404 mg/L,速效磷的含量为0.054 mg/L。经方差检验LSD多重比较,两者并无显著性差异(P>0.05)。为模拟海水富营养化,向配置的人工海水中加入无机氮、无机磷,按照海水水质标准中四类水水质,往16 L人工配置海水中(无机氮污染低水平)分别加入硝酸钠0.91 g,氯化铵0.57 g和磷酸二氢钾0.1 g作污染源,经测定此时海水中无机氮的含量为1.309 mg/L,速效磷的含量为0.236 mg/L,远超过了海洋四类水标准,海水富营养化标准[6]。
人工气候室于2011年4月开始,进行条件控制与调整,待稳定后,11月正式运行,并将两种植物枯落物分解袋埋入土壤。记录人工气候室条件,调控各参数;每天向各PVC箱内加入人工配置海水和富营养化海水,并定时放水,保持各箱内滞水时间一致。此外,按照季节变化调控各时间段的人工气候室运行参数(见表2)。
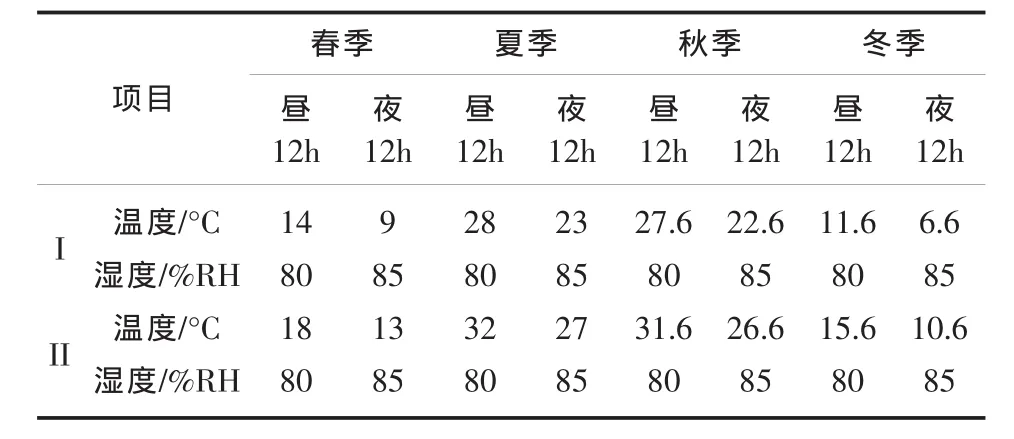
表2 人工气候室运行参数一览表
1.3 样品采集与分析
于2011年11月将植物枯落物分解袋埋入土壤,并保留部分初始枯落物作为背景值分析,在分解30 d,90 d,180 d,270 d后,取出各植物枯落物分解袋,平行样品两袋。用自来水清洗,再用蒸馏水洗净,置于70℃烘箱内24 h后,称重并粉碎、过60目筛。
植物枯落物C、N元素含量采用德国Elementar公司Vario EL III元素分析测定。称取5-10 mg过60目筛植物颗粒进行包样后直接上样检测。碳的分析精度为±2%,氮的为±8%。
1.4 数据分析
采用SPSS 16.0统计软件对所测数据进行单因素方差分析(ANOVA),Pearson相关性分析,确定不同因子之间的相关性。Ducan多重比较(P=0.05或0.01)分析不同植物枯落物分解过程中相关指标的显著差异。
采用NAI值来表示枯落物分解过程中各主要元素的积累或释放,计算方法如下式[7]:

式中,Mt为枯落物在t时刻的干物质重量,g;Xt为t时刻枯落物中元素的浓度;M0为枯落物的初始干物质重量,g;X0为枯落物中元素的初始浓度。NAI<100%,说明枯落物分解过程中元素发生了净释放;NAI>100%,说明枯落物分解过程中元素发生了净积累。此方法较为直观地描述了枯落物分解过程中营养元素的变化动态。
2 结果与讨论
2.1 CO2浓度增加(温度升高)和海水富营养化单独作用下对两种湿地植物枯落物分解过程的影响
CO2浓度增加往往引起温室效应,导致气候变暖,因此将两者合并,作为气候影响因子,加上海水水体富营养化,分析两个单因子升高对植物枯落物还土后分解过程的影响(见图3)。由图3可以看出,两种植物枯落物的分解过程均受到了单因子变化的影响,总体而言,温度和CO2浓度升高单因子作用和海水富营养化单因子作用均促进了枯落物的分解,在分解前期(0~180d)海水富营养化的促进效应更为明显,但是在180 d后,温度和CO2浓度升高因子对枯落物分解过程的促进效应更为强烈。尤其是对于互花米草的分解过程,单因子升高在分解后期(180d后)更为显著,明显地促进了它们的分解,经过270d的分解后,较对照组(CK)质量损失率提高了27.02%~40.62%。
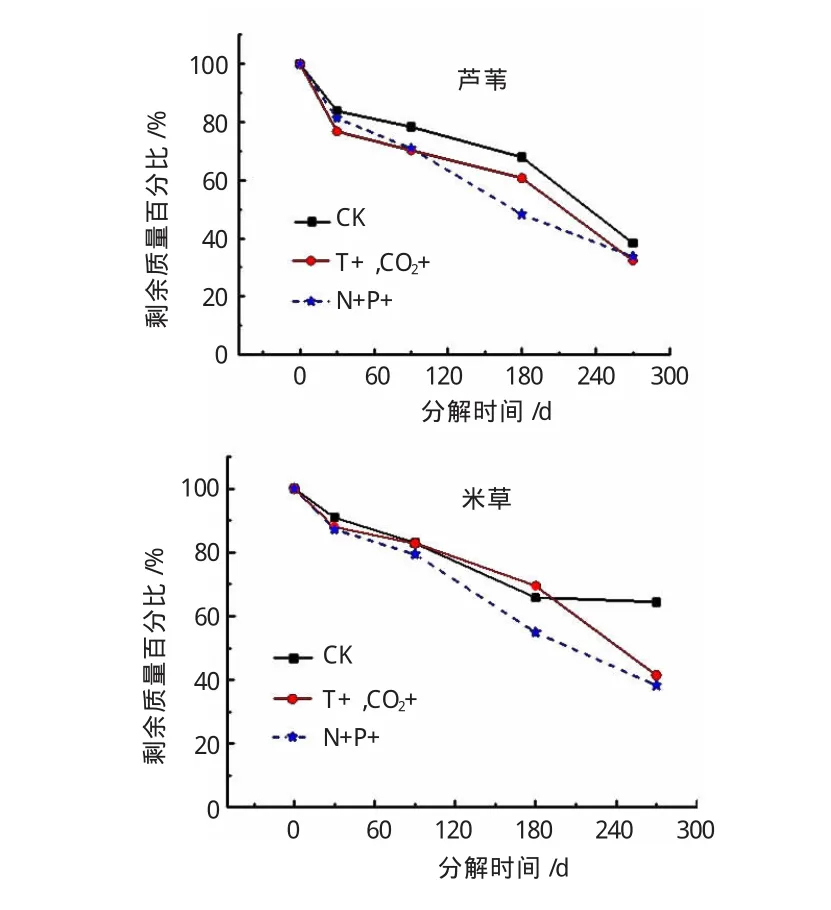
图3 单因素变化对湿地植物枯落物分解过程的影响曲线图
多数研究结果表明,温度升高促进了枯落物的分解过程,因为枯落物的分解是一系列物理、化学和生物作用过程的综合结果,温度升高一般促进了这些过程的进行。Jenny等分析不同温带和热带地区,因纬度不同带来的温度差异,对于枯落物分解过程的影响,发现热带地区植物枯落物分解速率明显快于温带地区[8]。温度升高促进了营养元素的矿化,提高了土壤养分有效性及微生物的活性,又促进了枯落物的分解,但是温度对于枯落物分解过程的各种直接和间接作用并不都表现为正效应,温度升高改变了系统的水热条件,使得地面蒸散作用增加,土壤含水率减少,过于干燥的环境反而抑制了枯落物的分解。因此,温度升高对于枯落物的分解过程影响,因气候环境、枯落物基质的不同,作用效应也会存在差异性,而这必将会引起植物群落格局的变化。
海水的潮汐作用,不仅对于滨海湿地地貌形成具有重要意义,而且海水中的营养元素也是湿地系统主要的外源营养元素来源。富营养化的海水中,N、P元素浓度普遍较高,营养元素的输入一般促进了枯落物的分解,这可能是因为营养元素增加,一方面改变了分解生物有机体的组成,促进了蔗糖酶、淀粉酶等和有机质分解利用有关的各种酶活活性[9];另一方面,提高土壤轻组分有机碳的输入比例,从而间接调控微生物群落组成,影响枯落物分解[10]。Szumigalski and Bayley通过对加拿大泥炭地的研究发现分解速率与水中铵态氮浓度和可溶性磷含量有关,增加氮磷输入可以增加枯落物分解速率[11],其结果与本文所介绍的研究结果一致。
植物枯落物中的碳元素动态变化与系统中的碳循环过程有关,氮元素是枯落物分解过程中重要的影响因子,因此分析枯落物分解过程中这两元素的动态变化(见图4)。由图4可知,环境因子的变化,对于湿地植物枯落物还土后分解过程中C、N元素的动态变化过程存在影响。不同的环境因素对于植物枯落物分解过程的影响随着枯落物类型的不同而有所差异,对于芦苇植物枯落物,温度升高和N、P元素浓度增加均促进了其中C元素的流失,且影响效果基本一致,温度升高和N、P元素浓度增加作用下的枯落物经过270 d的分解后,C的NAI值分别为10.7%和10.8%,而显著低于CK组中植物枯落物中C的NAI值30.2%。对于米草植物枯落物,N、P元素浓度增加因素的作用加速了其中C元素的释放,但是温度和CO2浓度升高作用却减缓了其中C元素的释放,这是否会影响未来气候环境下其成为高碳汇植物的潜力,有待进一步验证。
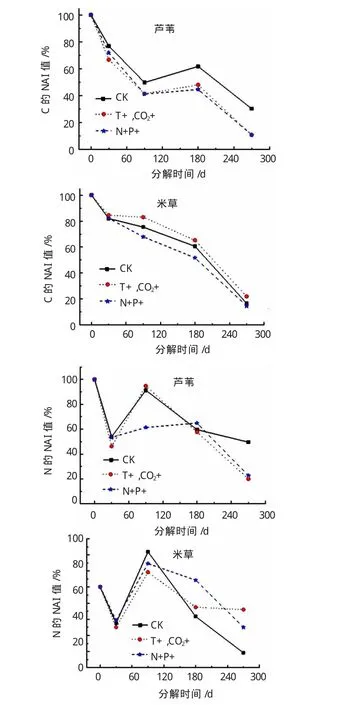
图4 单因素变化对湿地植物枯落物中C、N元素含量的影响曲线图
虽然无论何种环境条件下,两种植物枯落物中N元素均呈现前期释放,中期积累之后又释放的趋势,但是不同的环境因子作用下,枯落物中N元素的变化幅度存在差异。N、P元素浓度增加作用对于N元素动态变化趋势影响更为显著,温度升高对于植物枯落物分解前期作用并不显著,后期(180 d后)N元素的变化作用较为明显。对于不同植物枯落物,影响效应也有差异,温度升高和N、P元素浓度增加作用促进了芦苇枯落物分解后期的N元素释放,但是却促进了米草分解后期的N元素积累。根据前期研究结果,枯落物中N元素含量与其分解速率存在正相关性[12],所以米草后期枯落物中N元素的积累可能会促进枯落物的进一步分解。
2.2 双因子共同作用对九段沙湿地植物枯落物分解过程的影响
实际环境中,环境因子的变化并不是独立作用于枯落物分解,而是表现为综合作用,因此研究温度及CO2浓度升高气候因子和海水富营养化因子共同作用,对枯落物分解过程的影响(见图5)。由图5得出,温度及CO2浓度升高和海水富营养化,对于植物枯落物的分解存在交互作用,与对照组比较,两因子复合作用促进了还土植物枯落物的分解,但是与单因子作用结果比较,经过270 d的处理后,虽然对分解的中间过程有明显的增强效果,但最终复合作用的促进效果小于单因子作用结果。这说明了各因子综合作用对于枯落物分解过程影响的复杂性。不同植物枯落物对于双因子的反馈效应不同,互花米草最为明显,经过270 d的分解后,剩余质量显著少于对照样,仅为对照样剩余量的75.9%。
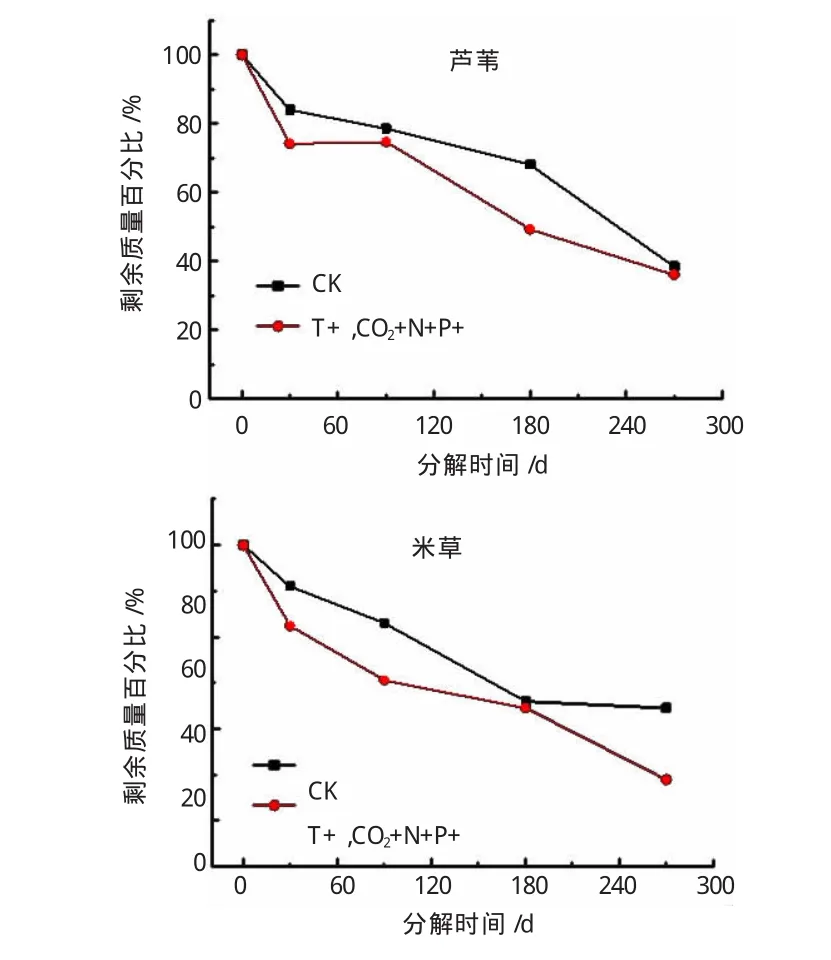
图5 双因素对湿地植物枯落物分解过程的影响曲线图
在大气中CO2浓度升高的背景下,有必要了解在未来气候环境变化作用下四种植物枯落还土后,释放的C元素动态,以期确定各植物在“碳汇”能力中的排序。有研究表明,枯落物中的N元素变化对于其分解过程有重要影响[13],因此需要分析芦苇和互花米草中碳、氮元素动态变化对于双因子作用的响应。研究结果发现与单因素作用结果基本类似,温度及CO2浓度升高和海水富营养化两因子升高的交互作用,对于植物枯落物中C、N元素的动态变化过程存在影响(见表3)。两因子升高的交互作用,促进了还土后芦苇枯落物中C元素的释放,经过270 d分解后,芦苇中C元素剩余量仅为对照组中剩余量的48.5%,但是却减缓了互花米草后期C元素的释放,使得经过270 d分解后,双因子升高作用下互花米草枯落物中C元素含量超过了对照组。双因子升高共同作用对枯落物中N元素的变化过程影响较为复杂,整体而言,双因子交互作用促进了芦苇秸秆中N元素的释放,虽促进了互花米草分解前期的N元素释放,却促进了后期N元素的积累。N元素在枯落物的分解过程中起着重要的作用[14],N含量的积累可能会使得互花米草后期的分解过程加快。
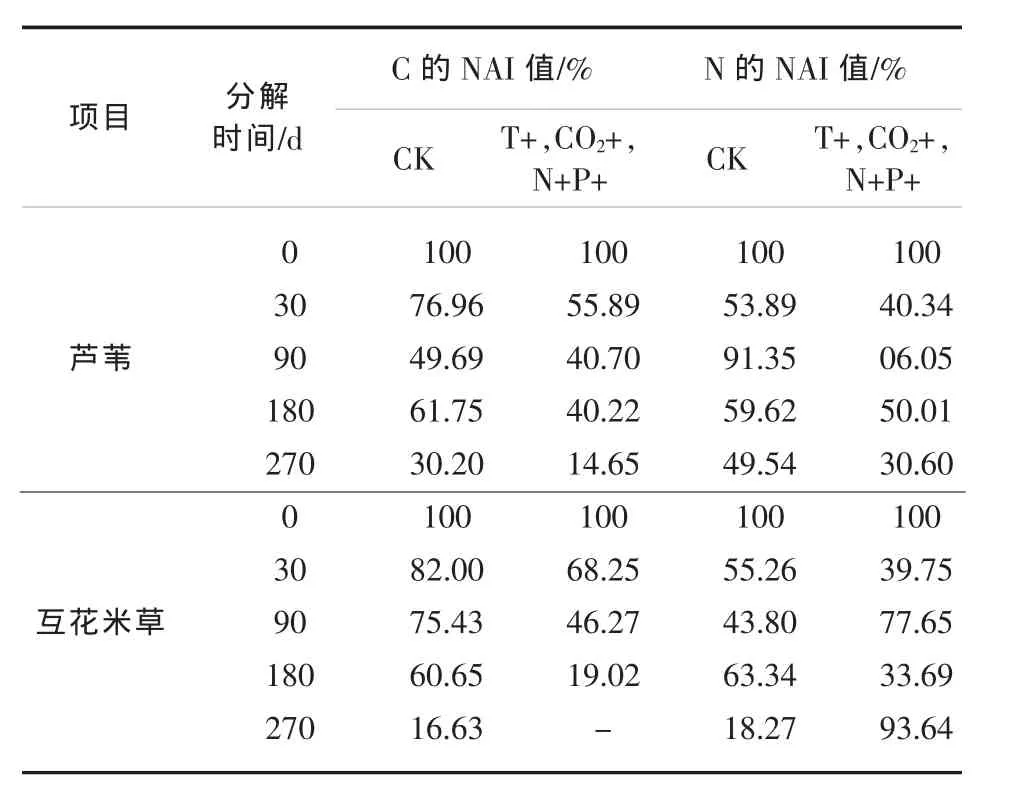
表3 双因素变化对湿地植物枯落物中C、N元素含量的影响一览表
因此,温度及CO2浓度升高和海水富营养化等单因子作用均不同程度地促进了湿地植物枯落物的分解,加快了枯落物中C元素的流失。双因子共同作用效应小于单因子作用结果,这说明了枯落物分解过程的复杂性。互花米草相较芦苇对于气候变化的响应更为明显,虽然质量损失在温度及CO2浓度升高单因子作用下显著加快,其中的C元素损失速率却有所减缓,可是另一方面,互花米草枯落物中N元素后期出现积累,这又有可能会促进其之后的分解。所以不同植物类型枯落物在气候环境变化的影响下,其分解过程有无显著变化,是否会影响未来高碳汇植物的类型,有待更为深入的研究和分析。
3 结论
通过人工气候室调控气候环境变化因子,包括温度及大气中CO2浓度升高、海水富营养化等,分析气候与环境单因子作用及双因子共同作用对植物枯落物还田后分解过程的影响,结果发现:
(1)在温度及CO2浓度升高单因子和海水富营养化单因子作用下,均不同程度地促进了两种植物枯落物的分解,加快了枯落物中C元素的流失;在分解前期(0~180 d)海水富营养化的促进效应更为明显,但是在180 d后,温度和CO2浓度升高因子对枯落物分解过程的促进效应更为强烈。
(2)与单因子作用结果比较,经过270 d的处理后,复合作用效果小于单因子作用结果,这说明了各因子综合作用对于枯落物分解过程影响的复杂性。
(3)不同湿地植物类型枯落物在气候环境变化的影响下,其质量损失率有所升高,其中碳元素损失率也有加快,但是互花米草枯落物中的碳后期损失速率有所降低,N含量有所升高,这是否会影响高碳汇植物的类型,有待更为深入的研究和分析。
[1] Lal R,2004.Soil carbon sequestration impacts on global climate change and food security.Science,304(5677):1623-1627.
[2] Davidson E A,Janssens I A,2006.Temperature sensitivity of soil carbon decomposition and feedbacks to climate change.Nature,440(7081):165-173.
[3] Hu,Y,Wang,L,Tang,Y S,et al,2014.Variability in soil microbial community and activity between coastal and riparian wetlands in the Yangtze River estuary-Potential impacts on carbon sequestration.Soil Biology and Biochemistry 70,221-228.
[4] 唐玉姝.九段沙湿地土壤/水体系统碳汇聚能力的空间异质性及其影响因素[D].上海:同济大学,2011.
[5] 席雪飞.环境变化对九段沙湿地土壤微生物呼吸影响的模拟研究[D].上海:同济大学,2011.
[6] 刘成,王兆印,何耘,等.上海污水排放口水域水质和底质分析[J].中国水利水电科学研究院学报,2003,1(4):275-280.
[7] 杨继松,刘景双,于君宝,等.三江平原沼泽湿地枯落物分解及其营养动态[J].生态学报,2006,26(5):1297-1302.
[8] Jenny,H,Gessel,S P,Bingham,F T,1949.Comparative study of decomposition rates of organic matter in temperate and tropical regions.Soil Sciences 68,419-432.
[9] 万忠梅,宋长春,刘德燕.氮输入对沼泽湿地小叶章枯落物分解过程中酶活性的影响[J].环境科学学报,2009,29(9):1830-1835.
[10] Mack M C,Schuur E A G,Bret-Harte,M S,et al.Ecosystem carbon storage in arctic tundra reduced by long-term nutrient fertilization.Nature,2004,431(7007):440-443.
[11] Szumigalski A R,Bayley S E.Decomposition along a moderate-rich fen-marsh peatland gradient in boreal Alberta,Canada.Wetlands,1997,17:123-137.
[12] 张艳楠.不同植物枯落物在土壤中的分解特性及其对气候环境变化的响应[D].上海:同济大学,2013.
[13] Torreta N K,Takeda H.Carbon and nitrogen dynamics of decomposing leaf litter in a tropical hill evergreen forest.Eur.J.Soil Biol.,1999,35:57-63.
[14] Corteaux M M,Bottner P,Berg B.Litter decomposition,climate and litter quality.Tree,1995,10:63-66.
