不同染色方法在脱落细胞学检查中的应用比较
2014-01-08蒙松年
蒙松年
(邵阳医学高等专科学校,湖南 邵阳 422000)
自Papanicoloau报道对阴道脱落细胞进行固定着色,进行女性生殖器恶性肿瘤的诊断,脱落细胞学检查便逐步在临床推广应用。
由于脱落细胞脱落后得不到氧气和养分,加上酶的作用,易发生退化变性;若固定不及时,各种细胞成分自溶破坏,固定不好或过多的人为挤压,也会影响细胞形态;此外,不同的染色方法,细胞的镜下表现差别较大,染色操作不当,往往造成人为假象,这些因素,均可干扰影响结果的判断。
我们通过对2104例脱落细胞(包括细针吸取细胞)标本进行巴氏染色、HE染色和瑞氏染色结果对比分析,为各种标本选择合适的染色方法及在操作中应特别注意的技术因素,进行了有益的探讨。
1 材料与方法
1.1 2104例脱落细胞标本来自附属医院门诊及住院病人,其中宫颈涂片722例,浆膜腔积液涂片276例,甲状腺穿刺涂片312例,淋巴结穿刺涂片416例,乳腺穿刺涂片202例,痰液涂片176例。
1.2 对甲状腺、淋巴结、乳腺的细针吸取细胞涂片、浆膜腔积液涂片进行瑞氏染色,另做HE染色对照,对宫颈涂片、痰液涂片进行巴氏染色,另做HE染色对照。
1.3 巴氏染色、HE染色和瑞氏染色按《脱落细胞学检验》操作规程进行[1]。
2 结果
2.1 巴氏染色、HE染色和瑞氏染色的各自结果,见表1。
2.2 巴氏染色、HE染色和瑞氏染色的各自特点,见表2。
2.3 巴氏染色、HE染色和瑞氏染色的质量控制,见表3。
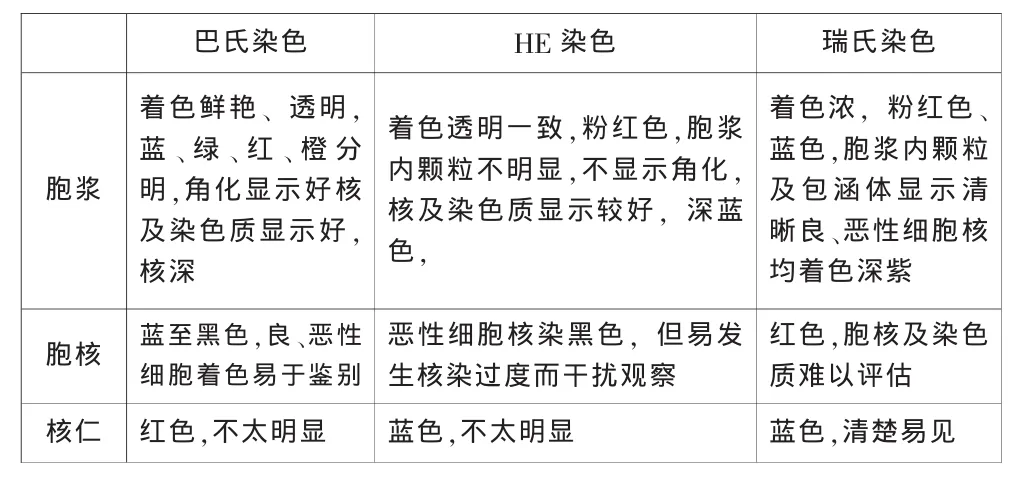
表1 三种染色方法结果比较

表2 三种染色方法特点比较
3 讨论
3.1 细胞涂片的适时固定对保证染色质量具有重要意义
放置过久而未进行固定处理的涂片会使细胞胀大变形,甚至自溶腐败,从而导致细胞着色差,结构不清,影响观察。当涂片水分过多时,易引起涂片中细胞脱落。脱水不当,易造成细胞过渡收缩和浓染,同样无法显示其清晰结构。因此,为了保证染色效果,瑞氏染色应在涂片晾干后及时进行固定染色,HE染色及巴氏染色时涂片后应及时浸入乙醇固定液中固定,如遇水分过多的涂片,可晾至涂片边缘廓及涂片内开始出现点状干燥区域时立即浸入乙醇固定液中进行固定、染色。
3.2 染色的目的
是将细胞在染液中染上不同深浅的颜色,产生不同的折射率以利于在显微镜下辨别各种细胞类别,正确的操作是保证染色效果的关键。三种染色方法中,瑞氏染色较为容易掌握,应注意在加染液固定后,及时追加缓冲液,以防染液挥发产生沉渣附着在细胞上,影响效果。巴氏染色步骤较多,EA 36染液的PH值、在稀盐酸中的分色,对巴氏染色的成功与否非常重要,应严格按要求操作,同时,要经常注意细胞着色的变化,及时更换染液,否则较难获得理想的染色效果。HE染色时,要特别注意掌握分化的时间,一旦分化完成,必须立即用水洗去盐酸酒精,否则细胞核的着色将被褪去。此外,启用新的苏木素染液时,应添加一些老的染液使之混合,及时用滤纸吸去染液表层的金属色泽膜,伊红染液中不染太久,都是保证染色质量的重要因素。
3.3 细胞学染色方法较多
HE染色、巴氏染色及瑞氏染色三种方法各有其优缺点。对不同的标本可选择不同的染色方法,以满足操作简便、结构清新、易于判断的要求。许多医院习惯应用操作简便的HE染色,巴氏染色并不很普及,巴氏染色和HE染色的涂片,在诊断价值上无根本区别,均能提供清楚的细胞核结构,良恶性细胞核的显色差异明显,细胞核的形态及染色改变是细胞学上诊断癌的重要依据。巴氏染色细胞核细微结构清晰,能辨认染色质的模式,胞浆透明、多彩,显示细胞的分化程度[2],应用液基细胞学检验技术[LCT],染色过程由电脑全自动控制,简化了繁杂的染色过程,唯费用较高,在宫颈涂片检查时国内外推荐使用巴氏染色[3]。HE染色操作简便,虽对胞浆着色单一,但对胞核着色深浅有层次,恶性肿瘤细胞核深染明显,有助于判断,各种涂片均可采用此染色。瑞氏染色结果清晰,核浆分明,核的形态、核仁、包涵物明显,虽良恶性细胞核颜色一致,从着色深浅上不能区别,但综合涂片细胞胞体,特别是细胞核的大小、形态等改变,仍能对被检细胞作出较正确的判断,且其操作简便,质控容易,尤其适用于穿刺细胞、浆膜腔积液细胞的检查,若同时配合以HE染色,则对涂片细胞的评估及诊断更具帮助。
[1]梁英锐.脱落细胞学检验[M].北京:人民卫生出版社,1991:32-37.
[2]舒仪经,阚秀.细针吸取细胞病理学[M].北京:人民卫生出版社,2000:4-6.
[3]田玉旺,朱红艳,邢宜,等.提高细胞学标本阳性检出率的制片技术探讨[J].中国组织化学与细胞化学杂志,2012,21(4):426.
