油桐烯脂酰CoA还原酶的克隆与表达模式分析
2014-01-02刘美兰谭晓风龙洪旭
刘美兰,谭晓风,龙洪旭
(中南林业科技大学 经济林培育与保护省部共建教育部重点实验室,湖南 长沙 410004)
油桐烯脂酰CoA还原酶的克隆与表达模式分析
刘美兰,谭晓风,龙洪旭
(中南林业科技大学 经济林培育与保护省部共建教育部重点实验室,湖南 长沙 410004)
以葡萄桐近成熟种子为材料,根据油桐转录组数据库中已知部分烯脂酰CoA还原酶(enoyl-CoA reductase,ECR)序列,利用RACE克隆技术,克隆得油桐烯脂酰CoA还原酶的全长cDNA序列,命名为VfECR,并对该基因的核苷酸序列及其相应氨基酸序列的理化性质、疏水性/亲水性、跨膜结构域、蛋白质的二、三级结构、亲缘关系进行分析。结果表明:该基因全长1 154 bp,含有一个933 bp的开放阅读框,编码310个氨基酸,属于不稳定的亲水性蛋白,含有6个明显的跨膜结构域,且与陆地棉ECR蛋白的同源性最高,亲缘关系最为接近。同时利用RT-qPCR对VfECR基因的组织特异性和种子发育过程中的表达模式进行了分析,发现油桐VfECR基因主要在种仁中表达,在根、茎、叶等组织中表达量较少;在种子发育过程中,近成熟(8月、9月)到成熟种子(10月)中的表达量要明显高于未成熟种子(6月、7月)。
生物信息学;油桐;超长链脂肪酸;烯脂酰CoA还原酶;克隆技术;表达模式
超长链脂肪酸(very long chain fatty acids,VLCFAs)是生物体内脂肪酸碳原子数超过18 C 的脂类,该类脂肪酸在生物体中具有广泛的生理功能,它们与种子甘油酯、鞘脂及生物膜膜脂的合成有关,更为重要的是它们为角质层蜡质的生物合成提供前体物质[1]。同时,VLCFAs 还可以通过调控极性生长素载体PIN1的定位而影响极性生长素的运输,进而影响植物根的横向形成及胚胎发育[2]。VLCFAs的生物合成主要可分为3个步骤:饱和脂肪酸的从头合成、脂肪酸碳链的延长和不饱和键的形成。脂肪酸碳链的延伸主要发生于内质网,以脂酰CoA作为起点,通过缩合、还原、脱水、再还原4个步骤循环完成碳链的延伸进而合成VLCFAs[3]。参与脂肪酰-CoA延长的酶属于膜绑定多酶复合体,包括β- 酮脂酰-CoA合酶(β-ketoacyl-CoA synthase, KCS)、β- 酮 脂 酰 -CoA还原酶 (β-ketoacyl-CoA re-ductase, KCR)、β- 羟脂酰 -CoA 脱 水 酶 (β-hydroxacyl- CoA dehydratase,HCD) 和反式烯脂酰-CoA还原酶(trans-2, 3-enoyl-CoA reductase,ECR),是影响超长链脂肪酸合成的主要酶类体[4]。
ECR是超长链脂肪酸合成中的关键酶,它催化最后一步还原反应,将反式烯脂酰-CoA 催化成酰基-CoA[5]。Kohlwein等[6]首次从一个温度敏感且鞘脂合成缺陷型的酵母突变体tsc13 中分离出编码ECR的基因TSC13,研究表明该基因编码的蛋白与酵母中编码KCS的基因Elo2p和Elo3p相互作用催化合成VLCFAs。目前的研究表明,鞘脂参与细胞的生长、分化、衰老、凋亡以及应急反应等都有着非常密切关系。在酵母中,催化VLCFAs合成的延长酶基因发生突变,积累的鞘脂将大幅度减少,进而使酵母的生长受到抑制[5-7]。拟南芥At3g55360(AtTSC13) 功能互补于酵母突变体tsc13实验发现可在拟南芥植株中普遍表达[8]。在拟南芥cer10突变体中,将T-DNA 插入At3g55360基因内,植株中鞘脂、角质层蜡与种子的VLCFAs 合成受到阻碍,抑制了细胞扩增,从而导致植株形态改变[9]。抑制烟草中的ECR基因功能,会影响膜的结构,导致叶表皮细胞受损[10]。Song等[11]也通过定量 RT-PCR 分析发现棉花的GhECR在纤维延长的过程中表达量提高。根据上述研究表ECR基因产物参与VLCFAs的合成,影响由VLCFAs 参与合成的鞘脂、角质层蜡与种子甘油酯的积累,从而影响植物的正常生长。
油桐Vernicia fordii为落叶乔木,在我国已有上千年栽培历史,与油茶、核桃、乌桕并称为我国四大木本油料树种之一[12-13]。桐油是重要工业用油,不仅是制造优质油漆和油墨的基本原料,还是制造生物柴油和优质复合功能新材料的原料,具有非常高的经济利用价值[14]。随着能源缺乏和桐油加工综合利用技术的提高,发展油桐产业已迫在眉睫,油桐的种质资源保护、良种选育以及高产栽培技术受到了关注[15-16]。ECR是超长链脂肪酸合成酶之一,它通过影响VLCFAs的合成进而影响植物的正常生长以及种子甘油酯的积累。目前,由于对油桐相关的分子研究比较少,有关油桐超长链脂肪酸合成代谢相关基因的研究只有KCS被克隆出来[17],其它基因的研究尚未见有报导。该研究在本实验室油桐转录组数据库的基础上,首次克隆获得了ECR基因,并对该基因进行了序列特征和生物信息学分析;同时还对该基因的组织特异性和种子不同发育时期的表达模式进行了分析,为今后进一步深入开展揭示油桐超长链脂肪酸合成代谢与油桐生长发育等生理过程的相关研究奠定了基础,同时也为油桐分子改良育种提供了理论依据。
1 材料与方法
1.1 实验材料
以湖南省永顺县青坪镇中南林业科技大学油桐试验基地(国家油桐种质资源保存库)油桐品种‘葡萄桐’的不同组织(根、茎、叶、叶柄、种仁、种皮、种柄、雄蕊、萼片、柱头、花瓣、子房)和不同发育时期种子(6月到10月)为实验材料,-80℃的超低温冰箱贮存。实验的主要试剂有:购自全式金公司的大肠杆菌Trans-T1、2×EasyTaq PCR SuperMix、pEASYBlunt Simple Cloning Kit;购自Invitrogen公司的PureLinkTM RNA Mini Kit、3'RACE 试剂盒、5'RACE 试剂盒;购自Takara公司的PrimeSTAR HS DNA Polymerase、2×SYBR Green qPCR Mix、PrimeScript® TR reagent Kit;购自 Fermentas公司RrevertAid First Stand cDNA Synthesis Kit ;购自安比奥生物技术有限公司的Gel Extraction Kit;由华大基因完成引物合成,博尚公司完成测序结果,其他试剂均为分析纯。
1.2 方 法
1.2.1 油桐总RNA的提取与单链cDNA的合成
以油桐品种‘葡萄桐’8月份近成熟种子为试材,采用CTAB裂解法+试剂盒的方法[18]提取RNA,并用琼脂糖凝胶电脉检测RNA的完整性。利用普通反转录试剂盒和3′RACE、5′RACE试剂盒合成单链cDNA,具体方法见说明书。
1.2.2 油桐ECR的PCR扩增
根据本实验室转录组数据库ECR基因的部分片段704 bp,利用Primer Premier 5软件设计RACE扩增的引物,分别为5GSP:5'CCCATCACAGTAGTCATTAAGACTCT 3'和3GSP:5' GTGGAGGGTATCAAATCCCACGTG 3',以RACE试剂盒反转转录的单链cDNA为模板进行PCR扩增并测序,具体反应体系和程序见试剂盒说明书。将已有序列和RACE扩增得到序列进行拼接,设计ECR全长扩增引物,为F:5' CTTCTTGATGAATCTTTGAGCAC 3'和R:5'CGTAACCACAATCTGGAACTCAT 3',以普通反转录的单链cDNA为模板进行PCR扩增并测序。
1.2.3 生物学信息分析
根据ECR的全长序列,用GeneDoc和Vector NTI软件查找出开放阅读框,并推出其编码的氨基酸序列;利用在线NCBI blastp对该基因进行比对分析及下载同源序,并用GeneDoc 软件进行多序列比对,用MEGA5.1 软件构建系统发育树。利用在线ProtParam、ProtScale、TMpred等软件对其进行理化性质、亲/疏水性和跨膜结构域分析;采用在线工具SOPMA 和SWISS-MODE分别进行二维结构和三维结构的预测,并利用本地软件UCSF Chimera对三维结构进行分析。
1.2.4 实时荧光定量PCR
以油桐品种‘葡萄桐’12个组织(根、茎、叶、叶柄、雄蕊、萼片、柱头、花瓣、子房、种仁、种皮和种柄)和9个时期(6月1日、6月15日、7月1日、7月15日、8月1日、8月15日、9月1日、9月15日和10月1日)种子为材料,总RNA的提取采用Invitrogen公司的RNA提取试剂盒和CTAB裂解法抽提[17],并用1.0%琼脂糖凝胶电泳检测总RNA的完整性,用紫外可见光分光光度计检测核酸的纯度。单链cDNA的合成按照Takara公司的荧光定量逆转录试剂盒合成,具体方法见说明书。以油桐的持家基因EF1α[19]为内参,清水模板为阴性对照,ECR基因的定量引物为E-F:5' ACGCAGTGGTAGAGAGC 3'和E-R: 5' GGAAGAGGAAGGGTCAG 3'(引物经检测验证),RT-qPCR的具体反应体系和反应程序见Takara公司的2×SYBR Green qPCR Mix说明书,每个反应重复3次。本实验使用BIO-RAD公司的定量PCR仪,采用96孔板完成PCR反应。
2 结果与分析
2.1 油桐ECR基因全长cDNA的克隆
将油桐转录组数据库中得到的704 bp片段进行NCBI在线blast,初步确定此序列为油桐ECR基因的部分序列。为了更好的确定该基因,本研究通过5′RACE扩增技术获得此序列5′端的365 bp,3′RACE扩增获得3’端的459 bp(见图1),用Vector NTI软件将已知序列与5’RACE和3’RACE序进行拼接,得到一条长为1 308 bp的cDNA。为了一步确定拼接序列的正确性,在该序列5’端和3’端再次设计引物进行PCR扩增并测序验证,测序结果获得一条长为1 154 bp的cDNA序列,经比对分析与拼接序完全一致。将获得的1 154 bp片段进行在线同源搜所发现,该序列与不同的物种的ECR基因序列有较高的相似性,因此可初步推测此序列为油桐ECR基因的cDNA。
2.2 油桐ECR基因全长cDNA 及氨基酸的序列特征分析
利用在线NCBI ORF Finder和GeneDoc软件分析获得的cDNA序列发现,此序列存在一个编码310个氨基酸的开放阅读框,全长为933 bp(170~1 103),起始密码是ATG,终止密码是TAG(见图2红色部分)。将推导出的油桐ECR基因氨基酸序列与GenBank中已注册的其它植物ECR基因的氨基酸序列进行比对分析,从表1可看出油桐ECR基因与其它16种植物的ECR基因都有较高的相似性,相似度都在80%以上,且与陆地棉的相似性最高为90%,由此可判断本研究获得的序列确实为油桐ECR基因,命名为VfECR。

图1 油桐ECR基因全长cDNA的PCR扩增Fig.1 PCR amplif i cation results of ECR gene’s full length cDNA in V. fordii

图2 油桐ECR基因全长cDNA序列及氨基酸序列Fig.2 Full length cDNA and amino acid sequence of VfECR in V. fordii

表1 ECR基因的氨基酸序列比较Table 1 Alignment of ECR amino acid sequence
2.3 油桐ECR与不同物种ECR的同源性比对和亲缘关系分析
在NCBI中下载不同物种ECR基因的蛋白质序,利用本地软件GeneDoc进行同源比对发现,油桐ECR与不同物种ECR的蛋白质序列之间有较高的同源性,整个蛋白质序仅在第50~80 aa之间特异性较强,而靠近N端和C端的序列保守性最高(见图3黑色区域)。利用MEGA5.1中的Neighbor-joining法对各物种间的亲缘关系进行分析表明,油桐ECR与陆地棉的亲缘关系最为接近,它们同属于同一树枝,且遗传距离也相同,如图4所示,图中数字为遗传距离。
2.4 油桐ECR蛋白的理化性质预测与分析

图3 油桐ECR与不同物种ECR蛋白的同源序列比对Fig.3 Homologous sequence alignments between of V. fordiiECR and different species

图4 油桐ECR与不同物种ECR蛋白的聚类分析Fig.4 Cluster analyses of V. fordiiECR and different species
油桐ECR基因CDS长为933 bp,编码310个氨基酸,由20种氨基酸组成,如图5所示,其中最多的是亮氨酸(Leu)占11%,其次是苯丙氨酸(Phe)和酪氨酸(Tyr),分别都占8.1%,最少的是甲硫氨酸(Met)仅占1.6%。该蛋白的相对分子量为36.21 kDa,原子组成为C1704H2543N427O426S12,理论等电点9.55,不稳定系数为47.71,总平均疏水指数是-0.015,是一种不稳定的亲水性蛋白。

图5 油桐ECR蛋白的氨基酸组成Fig.5 Amino acid composition of V. fordiiECR protein
2.5 油桐ECR蛋白亲水性/疏水性和跨膜结构的预测分析
根据在线软件ProtScale的分析结果表明,油桐ECR蛋白氨基酸残基中以A270疏水性最强(3.411),以A289亲水性最强(-2.867),且整个蛋白质序列中亲水性氨基酸残基数明显多于疏水性氨基酸残基(见图6A),因此油桐ECR蛋白是亲水性蛋白,与上述的预测结果相一致。通过在线TMpred和TMHMM工具预测油桐ECR蛋白的跨膜结构域发现,该蛋白存在6个跨膜结构域(见图6B),最可能分布的位置分别是A94~A116、A126~ A143、A164~ A183、A198~ A220、A233~A255、A259~A281,N 端在细胞膜内的可能性为0.964 58。
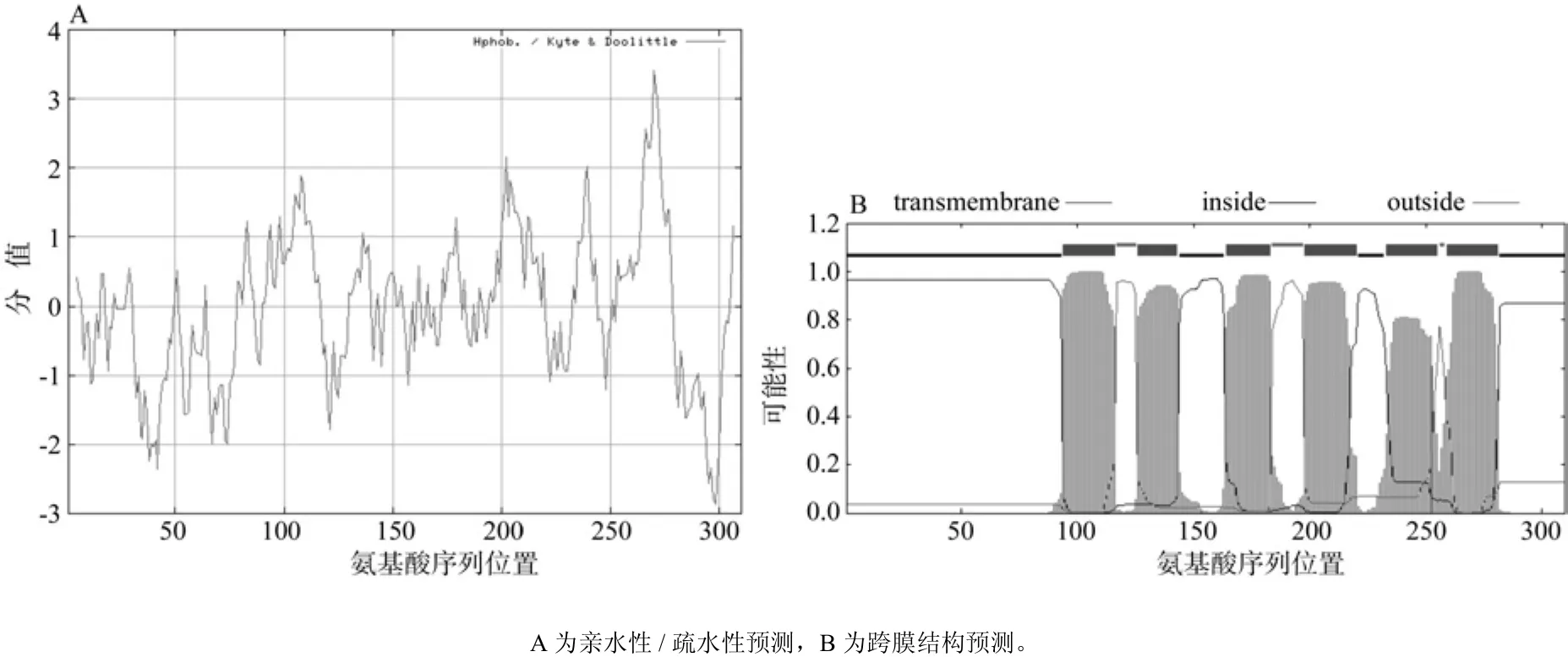
图6 油桐ECR蛋白亲水性/疏水性和跨膜结构的预测Fig.6 Predicted hydrophilicity prof i le and transmembrane domains of V. fordiiECR
2.6 油桐ECR蛋白的二级结构和三级结构预测分析
由图7可知,油桐ECR蛋白的二级结构主要由α- 螺旋和无规则卷曲2种主要结构元件构成,它们分别占整个序列的33.87%和37.42%,其次是延伸链占24.19%,最少的是β- 转角仅占4.52%。利用在线SWISS-MODE预测软件的auto mode 建模方式,以1c3t.1.A蛋白为模板对油桐ECR蛋白进行同源建模,图8为油桐ECR蛋白的三维空间模型。
2.7 油桐ECR基因的组织表达特异性和种子表达模式分析
2.7.1 油桐ECR基因的组织表达特异性分析

图7 油桐ECR蛋白二级结构预测Fig.7 Predicted secondary structure of V. fordiiECR protien

图8 油桐ECR蛋白三级结构模型预测Fig.8 Predicted tertiary structure of V. fordiiECR protien
根据RT-qPCR检测油桐ECR基因在12个组织(根、茎、叶、叶柄、雄蕊、萼片、柱头、花瓣、子房、种仁、种皮和种柄)的表达量发现,该基因在种仁中的表达量是最高的,且是根表达量的20多倍,其次是在花的5个组织(雄蕊、子房、萼片、柱头和花瓣),而在根、茎、叶、叶柄、种皮和种柄的表达量则非常少(见图9A)。
2.7.2 油桐ECR基因在种子中的表达模式分析
利用RT-qPCR对9个不同发育时期(6月1日、6月15日、7月1日、7月15日、8月1日、8月15日、9月1日、9月15日、10月1日)油桐种仁内ECR基因的表达量进行检测表明,从6月份到8月份,油桐种仁内ECR基因的表达量是随着种子的不断成熟而不断增加的,在9月份到10月份之间,ECR基因的表达量稍有减少,但总的表达量比6月份和7月份的要高很多。
3 结论与讨论
烯脂酰辅酶CoA 还原酶是超长链脂肪酸合成代谢中最后一个还原性酶,它将β-烯酯酰-CoA 还原生成延长了2个碳链的酯酰-CoA(20:1-CoA),它可以再次进入延长酶复合体中,生成更长链的脂肪酸,或被释放出来[20]。因此,生物体内超长链脂肪酸能否最终合成将由烯脂酰辅酶CoA还原酶决定。超长链肪酸不仅在生物体内具有重要的生理生化功能,还具有重要的工业用途。本研究在已构建的油桐转录组数据库的基础上[21],通过RACE 技术获得了油桐ECR基因的全长cDNA。该基因全长1 154 bp,含有1个933 bp的编码框,编码1个含有310个氨基酸的蛋白质。通过序列比对分析发现,油桐ECR基因与其它物种的ECR基因都有较高的相似性,相似度都在80%以上,且与陆地棉的相似度达90%;同时从油桐ECR蛋白与不同物种ECR蛋白的同源比对分析和系统进化树来看,不同物种的ECR蛋白序列之间同源性相当高,且有多个高度保守区域,不同物种之间系统进化树上的遗传距离相对较小,油桐ECR蛋白与陆地棉属于同一进化树枝,遗传距离相同。这表明油桐ECR与其它物种的ECR在进化上差异较小,保守性强。根据生物信息学分析表明,VfECR蛋白的分子量为36.21 kDa,等电点9.55,是一个含有6个比较明显跨膜结构域且不稳定的亲水性蛋白,该蛋白的二级结构中是以α- 螺旋和无规则卷曲2种主要结构元件构成为主,有少量的延伸链和β- 转角。

图9 油桐ECR基因的表达分析Fig.9 Expression analysis of V. fordiiECR
1997年Millar等[22]研究表明ECR基因为所有微粒体脂肪酸延长酶复合体所共有,呈泛组织表达,不具有底物特异性。2005年Qin等[23]通过RT-PCR发现棉花中的2个ECR基因都棉花纤维的延伸过程中优先表达,但在根、茎、叶中表达量较低。为了探讨油桐中ECR基因的组织特异表达情况,本研究利用RT-qPCR检测了油桐的12个组织(根、茎、叶、叶柄、雄蕊、萼片、柱头、花瓣、子房、种仁、种皮和种柄)中ECR的表达量,结果表明VfECR主要在种仁中表达,其表达量是根的20多倍,而在根、茎、叶、叶柄、种皮和种柄的表达量较低,这可能与油桐种仁中含油量相当高有关,大量的VLCFAs参与种子甘油酯的积累。进而本研究还对不同发育时期种子内VfECR基因的表达模式进行了分析,结果发现在油桐种子近成熟(8月)至成熟(10月)时期都有较高的表达。由此可推测VfECR基因在油桐超长链脂肪酸合成代谢中发挥着重要作用。
油桐作为世界上著名的木本工业油料树种,研究油桐超长链脂肪酸合成代谢的分子机理有助于对油桐进行定向的遗传改良及油桐生长发育相关生理代谢的探究,同时对其他油料作物的基础研究也有一定的参考价值。本研究对超长链脂肪酸合成相关的重要酶ECR进行了初步分析,并探讨分析了其在不同组织和不同发育过程中种子的表达量变化规律,这为今后对其蛋白进行活性分析,和进一步的研究其转基因植株生长发育相关重要的生理功能奠定了重要基础,进而为指导油桐遗传改良奠定重要的分子生物学基础。
[1] 倪 郁, 郭彦军.植物超长链脂肪酸及角质层蜡质生物合成相关酶基因研究现状[J].遗传,2008, 30(5):561-567.
[2] Roudier F. Very-long-chain fatty acids are involved in polar aux in transport and developmental patterning inArabidopsis[J].Plant Cell, 2010, 22:364-375.
[3] 唐 慧, 潘志雄, 卢立志, 等. 超长链脂肪酸延伸酶家族的功能及表达调控[J].生命化学, 2009, 29(6):898-901.
[4] Ohlrogge J B, Browse J A. Lipid biosynthesis[J]. Plant Cell,1995, 7:957-970.
[5] Kohlwein S D, Eder S, Oh CS,et al.Tsc13p is required for fatty acid elongation and localizes to a novel structure at the nuclearvacuolar interface inSaccharomyces cerevisiae[J]. Mol. Cell Biol., 2001, 21(1): 109-125.
[6] Oh C S, Toke D A, Mandala S,et al. ELO2 and ELO3,homologues of theSaccharomyces cerevisiaeELO1 gene,function in fatty acid elongation and are required for sphingolipid formation[J]. Journal of Biol. Chem., 1997, 272(28): 17376-17384.
[7] Han G, Gable K, Kohlwein S D,et al. TheSaccharomyces cerevisiaeYBR159w gene encodes the β-ketoreductase of the microsomal fatty acid elongase[J]. Journal of Biol. Chem., 2002,277(38): 35440-35449.
[8] Gable K, Garton S, Napier J A,et al.Functional characterization of theArabidopsis thalianaorthologue of Tsc13p, the enoyl reductase of the yeast microsomal fatty acid elongating system[J].Journal of Exp. Bot., 2004, 55(396): 543-545.
[9] Zheng H, Rowland O, Kunst L. Disruptions of theArabidopsisenoyl-coA reductase gene reveal an essential role for verylong-chain fatty acid synthesis in cell expansion during plant morphogenesis[J]. Plant Cell , 2005, 17(5): 1467-1481.
[10] Park J A, Kim T W, Kim S K,et al.Silencing of NbECR encoding a putative enoyl-CoA reductase results in disorganized membrane structures and epidermal cell ablation inNicotiana benthamiana[J]. FEBS Letters, 2005, 579: 4459- 4464.
[11] Song W Q, Qin Y M, Saito M,et al.Characterization of two cotton cDNAs encoding trans-2-enoyl-CoA reductase reveals a putative novel NADPH-binding motif[J]. Journal of Exp. Bot.,2009, 60(6): 1839-1848.
[12] 方嘉兴.中国油桐[M].北京:中国林业出版社, 1998: 22-45.
[13] 谭晓风.油桐的生产现状及其发展建议[J]. 经济林研究,2006,24(3): 62-64.
[14] 李永梅,魏远新,周大林,等.油桐的价值及其发展途径[J].现代农业科技,2008,16(8):113.
[15] 谭晓风,蒋桂雄,谭方友,等.我国油桐产业化发展战略调查研究报告[J].经济林研究,2011,29 (3):1-7.
[16] 黄瑞春,谭晓风,王承南,等.油桐种质资源库品比试验初步研究[J].中南林业科技大学学报,2011,31(9):108-110.
[17] 周俊琴,谭晓风,刘美兰,等.油桐β-酮脂酰-CoA合成酶(KCS)基因的克隆与序列分析[J].经济林研究, 2013,31(4):52-57.
[18] 龙洪旭,谭晓风,陈 洪,等.油桐油体蛋白基因的克隆及序列分析[J].中南林业科技大学学报,2010,30(4): 31-38.
[19] Han X, Lu M, Chen Y,et al.Selection of Reliable Reference Genes for Gene Expression Studies Using Real-Time PCR in Tung Tree during Seed Development[J]. PLoS ONE,2012,7(8):e43084.
[20] Fehling E, Mukherjee K D. Acyl-CoA elongase from a higher plant(Lunaria annua): Metabo licinter mediates of very long chain acyl-CoA products and substrate specificity[J]. Biochim.Biophys. Acta, 1991, 1082: 239-246.
[21] 陈 昊, 蒋桂雄, 龙洪旭,等.转录组测序揭示油桐脂肪酸的合成途径[J]. 植物生理学报, 2014, 50 (1): 37-44.
[22] Millar A A, Kunst L. Very-long-chain fatty acid biosynthesis is controlled through the expression and specificity of the condensing enzyme[J]. Plant Journal, 1997,12(1):121-131,
[23] Qin Y M, Pujol F M, Shi Y H,et al. Cloning and functional characterization of two cDNAs encoding NADPH-dependent β-ketoacyl-CoA reductased from developing cotton fi bers[J]. Cell Research, 2005, 15(6): 465-473.
Cloning and expression of enoyl-CoA reductase in Vernicia fordii
LIU Mei-lan, TAN Xiao-feng, LONG Hong-xu
(Key Laboratory of Cultivation and Protection for Non-Wood Forest Trees, China Ministry of Education, Central South University of Forestry & Technology, Changsha 410004, Hunan, China)
By taking PUPUTUNG tree seeds as the tested materials, according to the known part’s (enoyl-CoA reductase,ECR) sequence and by using RACE technology, PUPUTUNG tree seed’sECRgene was cloned and the gene’s full-length cDNA was obtained, namedVfECR. The physicochemical property, hydrophobicity or hydrophilicity, transmembrane structure, secondary and tertiary structure of protein, phylogenetic evolution and so on of the gene’s nucleotide sequence and the corresponding amino acid sequence were analyzed.The results show that full-length cDNA ofVfECRgene was 1 154 bp, and the CDS length 933 bp, encoded 310 aa; It is a hydrophilic protein which had 6 obvious transmembrane structures, this protein had the highest similarity and closest relationship withGossypium hirsutum; By the analysis of RT-qPCR in tung-oil tree different tissues and theirs development,VfECRgene mainly expressed in seed kernel, and there were little expression in root, stem, leaf and other tissues; During the development of seeds, the expression of close-tomaturity (August, September) and maturity (October) seeds were obviously higher than immature stage (June, July) seeds.
bioinformatic;Vernicia fordii; VLCFAs; enoyl-CoA reductase; cloning technology; expression pattern
S794.3;S603.2
A
1673-923X(2014)11-0009-09
2014-01-12
国家林业公益性行业科研专项重点项目(201204403)
刘美兰(1988-),女,广东韶关人,硕士研究生,主要从事经济林栽培育种研究;E-mail:1015626140@qq.com
谭晓风(1956-),男,湖南茶陵人,教授,博士研究生导师,主要从事经济林栽培育种和林业生物技术研究;
E-mail:tanxiaofengcn@126.com
[本文编校:吴 毅]
