阻断Notch信号通路抑制骨肉瘤MG-63细胞增殖的实验研究*
2014-01-01李明辉陈方舟郑先念
游 浩, 张 觅, 刘 洋, 李明辉, 陈方舟, 郑先念
武汉市第五医院骨科,武汉 430050
骨肉瘤是常见的原发于骨组织的恶性肿瘤,其恶性程度高,生长快,易转移,临床预后差,好发于儿童和青少年。虽然近年来新辅助化疗和手术治疗的应用使骨肉瘤的保肢率及生存率有了很大的提高,但临床治疗上仍有很多难点,探索新的、有效的化疗药物将有助于骨肉瘤的治疗。Notch基因最早发现于1917年[1],表达于无脊椎动物到脊椎动物的多个物种中,其家族成员的结构具有高度保守性。Notch是一个既简单又复杂的信号通路,其简单性体现在:当Notch受体与配体结合后,活化的Notch受体从胞膜脱落下来后无须第二信使,可直接转至核内,与转录调节子结合而激活靶基因[2];其复杂性体现在[3]:多种配体共同存在,激活Notch可引发多种信号,多种调节因素通过不同机制调节Notch信号。此外,Notch信号通路这种直接从胞膜到胞核的传递信号的方式,虽然放大效率低,但特异性强,可基本避免其他信号的干扰[4]。Notch信号通路在细胞增殖、分化及凋亡中均有重要的作用[5],而Notch的活化需要经过两步蛋白酶水解过程剪切全长的Notch受体,从而释放出Notch的胞内段结构域NICD,介导这一过程的蛋白酶之一为γ-分泌酶。DAPT作为Notch信号通路的阻断剂,能够特异地阻断γ-分泌酶的作用,从而阻止Notch信号通路的活化。本研究通过体外MG-63细胞培养技术,观察DAPT对人骨肉瘤细胞系MG-63增殖和凋亡的影响,为人骨肉瘤的治疗提供新的思路及更有效的治疗靶点。
1 材料与方法
1.1 材料
人骨肉瘤细胞 MG-63来自本实验室,DMEM培养液和PBS消化液购于杭州吉诺公司,培养板为美国YNMHLI公司产品,培养瓶为比利时Orange公司产品,胎牛血清购于杭州四季青生物工程和材料研究所,四甲基偶氮唑蓝(MTT)为美国Amresco公司产品,碘化丙啶为Sigma公司产品,二甲基亚砜(DMSO分析纯)为江苏鸿声化工厂产品,酶标仪为英国BIOTEK公司产品,流式细胞仪为美国Becton Dickinson公司产品,透射电镜为荷兰Philips公司产品。
1.2 细胞培养
用含10%胎牛血清、100U/mL青霉素、100 μg/mL链霉素的DMEM 培养液在37℃、饱和湿度、5%CO2培养箱中常规培养,每24小时换液,用含0.125%胰酶和0.02%EDTA消化液隔天消化、传代,取对数生长期的细胞进行后续实验。
1.3 MTT法检测DAPT对MG-63细胞增殖的影响
MG-63细胞生长至80%~90%融合,消化制成3×104/mL细胞悬液,接种于96孔板,每孔200 μL。贴壁后无血清培养24h,细胞同步化后,分别加入浓度为1.0、5.0、10.0μmol/L的 DAPT,每个剂量设5个复孔;对照组加正常培养液,继续培养24、48、72h后分别取出96孔板,每孔加入浓度为5 g/L的 MTT 20μL,吸弃上清液,每孔加入150μL DMSO,振荡10min,用酶标仪测定490nm波长处每孔的吸光度值(absorbance,A),实验重复3次。按下列公式计算细胞生长抑制率:生长抑制率=(1-药物组A490nm值/对照组A490nm值)×100%。
1.4 AnnexinⅤ-FITC/PI双染结合流式细胞术检测DAPT对MG-63细胞凋亡的影响
收集处于对数生长期的骨肉瘤MG-63细胞,制备单细胞悬液,计数后调整细胞密度为2×105/mL,按l mL/孔接种于6孔板,37℃、5%CO2、饱和湿度培养箱中常规培养24h,待细胞完全贴壁后吸弃原培养液,加入含有终浓度分别为1.0、5.0、10.0 μmol/L的DAPT的新鲜DMEM培养液,同时设立空白对照组。药物作用24~48h后,经胰酶消化,收集细胞于流式管内,1 200r/min 4℃离心5min,弃上清,4℃预冷的PBS洗细胞1次,用稀释好的结合缓冲液(结合缓冲液∶去离子水按1∶4稀释)500 μL重悬细胞。每管依次加AnnexinⅤ-FITC 5μL,再加入10μL PI染色液,轻轻混匀,室温下避光孵育5min,上流式细胞仪进行细胞凋亡检测。以AnnexinⅤ为横坐标,PI为纵坐标,左上象限代表坏死细胞碎片,左下象限代表活细胞(PI和Annexin-Ⅴ双阴性)、右下象限代表凋亡早期(Annexin-Ⅴ阳性,PI阴性)、右上象限代表凋亡晚期或坏死(PI和Annexin-Ⅴ双阳性)。
1.5 透视电镜观察细胞的超微结构变化
取对数生长期细胞,设置终浓度为1.0、5.0、10.0μmol/L的DAPT实验组及不添加DAPT的对照组,培养72h后收集细胞离心,以1×PBS洗涤2次,用2.5%的戊二醛于4℃冰箱固定24h后,按常规电镜样品制备技术操作。离心弃固定液,1×PBS涤2次后,用质量浓度为1%的锇酸固定1h后,预染,离心弃固定液,蒸馏水洗涤2次,用质量浓度为2%的醋酸铅预染,脱水,离心弃预染液,蒸馏水洗涤2次,依次用体积分数为35%、50%、75%和90%的乙醇梯度脱水,环氧树脂(Epon812)包埋,KLB超薄切片机切片,柠檬酸铅染色,置透射电镜观察并摄片。
1.6 RT-PCR检测不同浓度DAPT作用24h后MG-63细胞中 Notch 1、HES 1mRNA的表达
取对数生长期细胞,将消化的细胞配制为单细胞悬液,以2×106/瓶的密度接种于100mL培养瓶中,在37℃、5%CO2及饱和湿度条件下,培养18~24h细胞贴壁后加入含有终浓度分别为1.0、5.0、10.0μmol/L的DAPT新鲜DMEM 培养液,同时设立空白对照组继续培养24h。常规方法提取各组细胞总RNA,TIANGEN Quant一步法RT-PCR试剂盒进行RT-PCR实验;引物Notch l由上海生工生物工程有限公司合成,引物 HES 1、β-actin由上海俊生生物工程有限公司合成。
1.7 统计学分析
2 结果
2.1 DAPT对MG-63细胞增殖的影响
MTT检测发现,用不同浓度DAPT处理后,在24~72h时间范围MG-63细胞生长增殖均受到明显抑制(同对照组相比,P<0.05或P<0.01),并且抑制作用呈剂量依赖性,在浓度为1.0μmol/L时即出现抑制细胞生长的作用,在一定范围内随着DAPT剂量的增加和作用时间的延长抑制效果增加,各个剂量及作用时间对MG-63的抑制作用均有统计学差异。见表1、2。
表1 不同浓度DAPT对MG-63细胞作用后的A值(±s,n=15)Table 1 Avalues of MG-63cells treated with different concentrations of DAPT(±s,n=15)

表1 不同浓度DAPT对MG-63细胞作用后的A值(±s,n=15)Table 1 Avalues of MG-63cells treated with different concentrations of DAPT(±s,n=15)
与对照组比较,*P<0.05 **P<0.01
时间24h 48h 72h对照组 1.057±0.017 1.534±0.102 2.193±0.158组别DAPT组(μmol/L)1.0 0.927±0.049* 1.104±0.076* 1.162±0.081*5.0 0.804±0.104** 0.898±0.086** 0.542±0.011**10.0 0.627±0.084** 0.741±0.045** 0.485±0.046**
表2 不同浓度DAPT对MG-63细胞增殖的影响(±s,n=15)Table 2 Effect of different concentrations of DAPT on the proliferation of MG-63cells(±s,n=15)
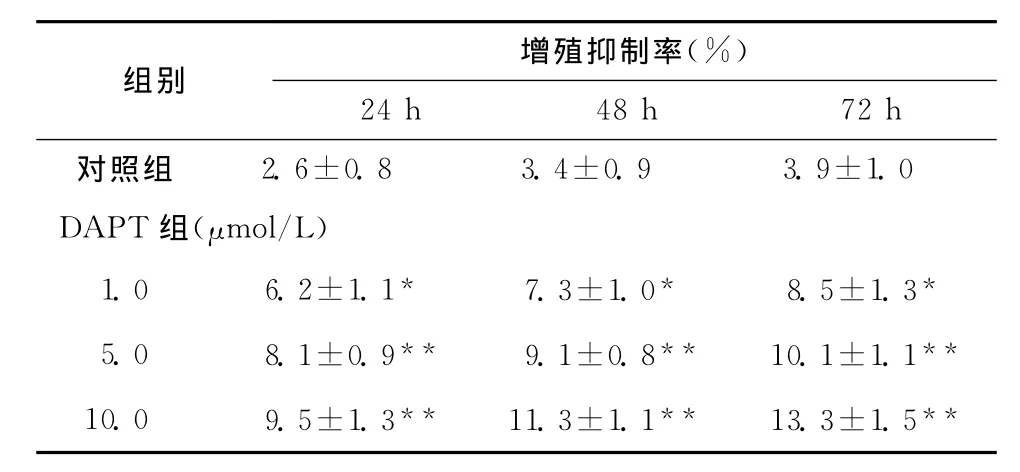
表2 不同浓度DAPT对MG-63细胞增殖的影响(±s,n=15)Table 2 Effect of different concentrations of DAPT on the proliferation of MG-63cells(±s,n=15)
与对照组比较,*P<0.05**P<0.01
组别 增殖抑制率(%)24h 48h 72h对照组 2.6±0.8 3.4±0.9 3.9±1.0 DAPT组(μmol/L)1.0 6.2±1.17.3±1.08.5±1.3 5.0 8.1±0.9** 9.1±0.8** 10.1±1.1**10.0 9.5±1.3** 11.3±1.1** 13.3±1.5*** * *
2.2 DAPT对MG-63细胞凋亡的影响
通过AnnexinⅤ-FITC和PI双标记法检测,结果显示,随着DAPT浓度的增加,凋亡率逐渐升高,24h凋亡率 DAPT 1.0、5.0、10.0μmol/L浓度组分别为 (6.6±1.1)%、(13.0±1.9)%、(18.3±3.3)%,与空白对照组(2.6±0.2)%比较,差异均有统计学意义(均P<0.01),见图1。
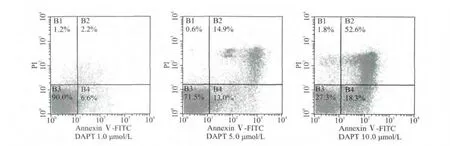
图1 AnnexinⅤ-FITC和PI双标记法检测结果Fig.1 Results of AnnexinⅤ-FITC and PI double staining
2.3 DAPT对MG-63细胞形态的影响
按上述分组,药物作用24h后,透射电镜下观察细胞的形态变化。对照组MG-63细胞生长状态良好,胞体较大,细胞贴壁生长,透明,表面光滑,折光性好,细胞增殖旺盛,可见多数分裂相细胞。DAPT浓度在1.0μmol/L组可见少数早期凋亡细胞,表现为细胞变小,变圆,胞质回缩,折光性差,边缘不整,胞质中出现颗粒状物质,胞核固缩。DAPT浓度5.0μmol/L组可见明显早期凋亡细胞,而10.0 μmol/L组细胞形态渐圆,漂浮细胞增多。见图2。

图2 透射电镜下观察不同浓度DAPT对MG-63细胞形态的影响(×3 700)Fig.2 Effect of different concentrations of DAPT on the morphology of MG-63cells under the transmission electron microscope(×3 700)
2.4 DAPT对 MG-63细胞Notch 1、HES 1mRNA表达的影响
应用 RT-PCR技术检测发现,经不同浓度DAPT处理24h后,随着DAPT浓度的增高,MG-63细 胞 Notch 1、HES 1mRNA 表 达 减 弱,各DAPT组与对照组之间、各DAPT组之间的差异均具有统计学意义(均P<0.05,表3)。
表3 DAPT对 MG-63细胞 Notch 1、HES 1mRNA表达的影响(±s,n=15)Table 3 Effect of DAPT on the expression of Notch 1 and HES 1mRNA in MG-63cells(±s,n=15)

表3 DAPT对 MG-63细胞 Notch 1、HES 1mRNA表达的影响(±s,n=15)Table 3 Effect of DAPT on the expression of Notch 1 and HES 1mRNA in MG-63cells(±s,n=15)
相对含量即目的条带灰度值/β-actin灰度值;与对照组比较,*P<0.05**P<0.01
相对含量组别0.793±0.103 0.859±0.112 DAPT组(μmol/L)Notch 1mRimages/BZ_21_736_1069_737_1073.pngNA HES 1mRNA对照组1.0 0.659±0.089* 0.714±0.073*5.0 0.432±0.107** 0.412±0.154**10.0 0.307±0.094** 0.283±0.125**
3 讨论
Notch是脊椎动物和无脊椎动物发育过程中一类十分重要的信号受体蛋白家族,它通过邻近细胞间的相互作用来精确调控各谱系细胞的分化,近年来发现其在个体系统发育、模式形成、肿瘤发生以及神经退行性疾病等生理病理过程中起着重要的作用[6]。Notch的活化需要经过三步蛋白酶水解过程剪切全长的Notch受体,从而释放出Notch的胞内段结构域NICD,介导这一过程的蛋白酶之一为γ-分泌酶[7]。DAPT是一种人工合成的γ-分泌酶抑制剂,可阻断由γ-分泌酶介导的Notch受体第三步酶切过程,使Notch受体分子无法转变成有效的活性片段,从而抑制Notch信号通路的激活,阻止Notch的活化[8]。且DAPT细胞毒性低,即使阻断γ-分泌酶而引起底物堆积也不会产生副作用。这一特性,为抗肿瘤新药物的研发提供了新的思路。
异常增殖是恶性肿瘤细胞生物学特性之一,有效抑制肿瘤细胞的增殖、生长是对抗肿瘤药物的基本要求。增殖细胞线粒体的NADPH相关脱氢酶类可将MTT还原为不溶于水的蓝紫色甲瓒[9],并且沉积于细胞中,甲瓒形成的量与存活细胞数目成正比,而死亡细胞由于该酶活性丧失,MTT不被还原[10]。以DMSO溶解甲瓒后,用酶标仪于一定波长检测吸光度A值,即可间接反映存活细胞的变化。
本实验将 DAPT 分为1.0、5.0、10.0μmol/L等3个浓度梯度,选取24、48、72h等3个时间点测定药物对MG-63细胞活力的抑制作用。结果显示,不同浓度的DAPT在体外均可抑制MG-63细胞的增殖,在浓度为1.0μmol/L时即出现抑制细胞生长的作用,且随浓度增加对细胞增殖的抑制作用更加明显,作用24h抑制率分别为(6.2±1.1)%、(8.1±0.9)%、(9.5±1.3)%。随药物作用时间延长,以1.0μmol/L浓度DAPT为例,24、48、72h抑制率分别是(6.2±1.1)%、(7.3±1.0)%、(8.5±1.3)%,呈时间依赖性。这表明,本实验所选取的剂量、时间范围内,阻断Notch信号可以抑制 MG-63细胞增殖,并呈剂量、时间依赖性。
近年来研究证实,凋亡与肿瘤的发生、发展和消退存在密切的联系。细胞凋亡取决于局部环境的基因调控,调控基因失控则影响细胞凋亡发生,导致增殖细胞数量剧增,不正常的细胞难以被清除,进而促使某些癌基因活化使细胞发生癌变,是肿瘤发生的原因之一。随着细胞凋亡机制逐渐阐明,细胞凋亡与肿瘤治疗的关系日益受到重视,人们发现肿瘤发生是细胞增殖过度与凋亡减少导致过量蓄积的结果。肿瘤治疗新方法应从能否诱导细胞凋亡着手。因此诱导肿瘤细胞凋亡已经成为肿瘤治疗的新靶点[11-12]。许多具有细胞毒性的抗肿瘤药物都可以诱导凋亡,而且肿瘤发生过程中出现抑制凋亡的变异相关基因,会减弱肿瘤对药物的敏感性,因此,任何能够促进骨肉瘤细胞发生凋亡的治疗措施都是有意义的,也可以增加骨肉瘤细胞对其它治疗手段的敏感性[13]。正常细胞的细胞膜上磷脂酞丝氨酸(PS)位于细胞膜的胞质侧,当细胞发生凋亡时,此基团则转向细胞膜外侧。AnnexinⅤ是一种35.36kD的钙离子依赖的磷脂结合蛋白,与PS有较高亲和力,是检测早期凋亡的指标。PS转移到细胞膜外不是细胞凋亡特有的,也可发生在坏死细胞中[14]。但在凋亡的早期细胞膜是完整的,而细胞坏死时细胞膜的完整性被破坏。由于碘化丙啶(PI)对细胞膜完整的活细胞和早期凋亡细胞拒染,而对膜完整性被破坏的晚期凋亡细胞或坏死细胞可以染色,所以正常活细胞不会被染色,凋亡细胞可被标记上AnnexinⅤ,而坏死和晚期凋亡细胞可被AnnexinⅤ和PI同时着色[15]。利用AnnexinⅤ结合PI进行双染色可以用于检测活细胞、凋亡细胞和坏死细胞的分布。本实验利用AnnexinⅤ-FITC和PI双标记法检测结果显示,在选取的1.0、5.0、10.0μmol/L浓度范围内,DAPT作用24h后均能够诱导MG-63细胞发生凋亡,MG-63细胞有明显的PS的外化现象,即右下象限(AnnexinⅤ高染而PI低染区)的早期凋亡细胞明显增多;右上象限(AnnexinⅤ与PI均为高染区)的晚期凋亡及继发性坏死细胞增多;而左下象限(AnnexinⅤ与PI均为低染区)的正常活细胞数量有所减少。随着DAPT浓度的增加,凋亡率逐渐升高,DAPT具有诱导骨肉瘤MG-63细胞凋亡的作用。
Notchl受体是高度保守的Ⅰ型跨膜糖蛋白。正常的Notchl信号途径由配体诱导的蛋白水解触发,从而释放Notchl的胞内段NICD,NICD转移入核内,形成 NICD.Su(H)/CBFl复合物,进而上调下游Su(H)/CBFl家族转录因子的活性,NICDCBFl复合物直接诱导转录的靶基因是HES1,HESl是碱性螺旋-环-螺旋(bHLH)类转录因子[16],它又调节其它与细胞分化直接相关的基因的转录。HESl是Notch受体蛋白的靶基因之一,HESl蛋白能通过抑制Cyclin依赖性激酶抑制因子p27Kipl的转录而促进细胞增殖。Stockhausen等[17]研究表明,活化的Notchl及其下游基因HESl在卵巢腺癌中的表达明显高于在卵巢腺瘤及正常卵巢组织中的表达。Santagata等[18]在研究多发性骨髓瘤时还发现,初期多发性骨髓瘤细胞以及骨髓间质细胞中均高表达Jaggedl,当Jaggedl激活Notch通路时,下游基因HES 1表达明显增加。其近期研究表明[1],γ-分泌酶抑制剂DAPT能抑制多发性骨髓瘤细胞的生长并且使得HESl表达下调。
Notchl在骨肉瘤中高表达已被证实[19]。DAPT对 MG-63细胞中Notch信号通路Notchl、HES 1mRNA表达的影响目前国内未见报道。本实验采取了RT-PCR的方法,对凝胶电泳条带进行灰度分析结果显示,γ-分泌酶抑制剂DAPT处理MG-63细胞后,可以检测到 MG-63细胞中Notchl mRNA及其下游靶基因HESl mRNA表达水平下调。此次研究结果表明,DAPT对MG-63细胞具有明显的抑制增殖和促进凋亡的作用,其机制可能与Notchl、HESl下调有关,在以后的研究中,我们仍需进一步明确DAPT通过下调Notchl、HESl影响MG-63细胞增殖及凋亡的具体作用机制,为DAPT应用于骨肉瘤的临床治疗打下坚实基础。
[1] Haruki N,Kawaguchi K S,Eichenberger S,et al.Dominantnegative Notch3receptor inhibits mitogen-activated protein kinase pathway and the growth of human lung cancels[J].Cancer Res,2005,65(9):3555-3561.
[2] Purow B W,Haque R M,Noel M W,et al.Expression of Notch-1and its ligands,Delta-Like-1and Jagged-1,us critical for glioma cell survival and proliferation[J].Cancer Res,2005,65(6):2353-2363.
[3] Balint K,Xiao M,Pinnix C C,et al.Activation of Notchl signaling is required for 13-catenin-mediated human primary melanoma progression[J].Clin Invest,2005,115(11):3166-3176.
[4] Wang Z,Zhang Y,Li Y,et al.Down-regulation of Notch-1 contributes to cell growth inhibition and apoptosis in pancreatic cancer cells[J].Mol Cancer Ther,2006,5(3):483-493.
[5] Zhang Y,Wang Z,Ahmed F,et al.Down-regulation of Jagged-1induces cell growth inhibition and S phase arrest in prostate cancel cells[J].Int J Cancer,2006,11(9):2071-2077.
[6] Ansieau S,Strobll J,Leutz A.Activation of the Notch-regulated transcription factor CBFI/RBP-J kappa through the 13 SEIA oncoprotein[J].Genes Dev,2001,15(4):380-385.
[7] Artavanis-Tsakonas S,Rand M D,Lake R J et al.Notch signaling:cell fate control and signal integration in development[J].Science,1999,284(5415):770-776.
[8] Daudet N,Ariza-McNaughton L,Lewis J.Notch signaling is needed to maintain,but not to initiate,the formation of prosensory patches in the chick inner ear[J].Development,2007,134(12):2369-2378.
[9] Rieger L,Weller M,Bomemann M,et al.BCL-2family protein expression in human malignant glioma—a clinical-pathological correlative study[J].Neurol Sci,1998,155(1):68-75.
[10] Lowe S W,Lin A W .Apoptosis in cancer[J].Carcinogenesis,2000,21(3):485-495.
[11] Hopfer O,Zwahlen D,Fey M F,et al.The Notch pathway in ovarian carcinomas and adenomas[J].Br J Cancer,2005,93(6):709-718.
[12] Jundt F,Pröbsting K S,Anagnostopoulos I,et al.Jaggedl-induced Notch signalling drives proliferation of multiple myeloma cells[J].Blood,2004,103(9):3511-3515.
[13] Wilson H,Huelsmeyer M,Chun R,et al.Isolation and characterisation of cancer stem cells from canine osteosarcoma[J].Vet J,2008,175(1):69-75.
[14] Dirks P B.Brain tumor stem cells,bringing order to the chaos of brain cancer[J].Clin Oncol,2008,26(17):2916-2924.
[15] Nicolis S K.Cancer stem cells and“stemness”genes in neurooncology[J].Neurobiol Dis,2007,25(2):217-229.
[16] Rangarajan A,Syal R,Selvarajah S.Activated Notchl signaling cooperates with papillomavirus oncogenes in trangformation and generrates resistances to apotosis onmatrix withdrawal though PKB/Akt[J].Virology,2001,286(1):23-30.
[17] Stockhausen M T,Sjölund J,Axelson H.Regulation of the Notch target gene Hes-l by TGF alpha induced Ras/MAPK signaling in human endothelial cells[J].Exp Cell Res,2005,310(1):218-228.
[18] Santagata S,Demichelis F,Riva A,et al.Jaggedl expression is associated with prostate cancer metastasis and recurrence[J].Cancer Res,2004,64(19):6854-6857.
[19] 许自力,邓展生,许宇霞.Notch1、Dll4蛋白在骨肉瘤的表达及临床意义[J].中国骨肿瘤骨病,2009,8(1):28-31.
