白桦酸及其衍生物的生物效应和制取方法
2013-12-29岳喜腾
摘要:白桦酸及其衍生物在抗HIV、抗肿瘤、抗炎等方面表现出多种生物活性以及与以往药物不同的作用机制, 已成为当今一个研究热点。查阅了国、内外近几年来有关白桦酸及其衍生物的近20篇文献,阐述了白桦酸及其衍生物的生物活性、白桦酸的制取及其结构修饰方法,并对其研究前景进行了展望。
关键词:白桦酸及其衍生物;生物活性;白桦酸的制备
文章编号:1005–6629(2013)11–0075–03 中图分类号:G633.8 文献标识码:B
1 问题的提出
艾滋病(AIDS)和肿瘤(tumor)已成为威胁人类健康的两大重要疾病,且发病人数呈逐年上升趋势。目前,临床用于艾滋病和肿瘤治疗的药物大都存有毒副作用以及耐药性等问题。因此探索抗艾滋病病毒(HIV)和抗肿瘤机制、研制新的抗艾滋病病毒(HIV)和抗肿瘤药物是十分迫切的任务。
白桦树在我国分布很广,从东北、华东到西北、西南都有(国外则主要生长在北欧和北美北部),其树皮、树叶、嫩芽作为草药早已广泛用于民间。如将白桦树皮在常温下蒸煮,至水分全部蒸发后,剩下的残留物可用来治疗皮肤疣、湿疹等皮肤病。嫩芽泡茶可用来利尿、镇静、治疗风湿病、痛风和肾结石。桦木叶可用来治疗脱发和配合其他药物去头皮屑。一个有趣的例子是在一具5300年前冻结于瑞士阿尔卑斯山上尸体的个人财物中找到了医用树皮,经验证,此树皮取自白桦树。
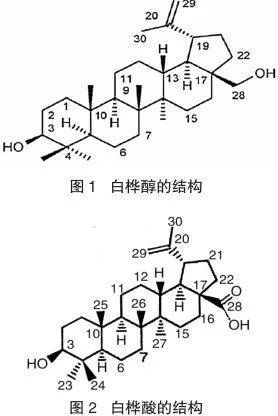
科学研究发现,白桦醇(又名桦木醇、桦木酯醇)——从白桦树皮提取的一种羽扇烷类五环三萜类化合物(见图1),具有抗炎、抗病毒、抗肿瘤活性[1],并且显示出了与以往药物不同的作用机制,但是由于受到水溶性差的限制(37℃条件下,白桦醇在水中溶解度<0.001 mg·mL-1 [2]),生物利用率低,阻碍了其在临床的应用研究。为了寻找更多、更好的抗HIV和抗肿瘤药物,研究者以白桦醇为底物合成了白桦酸(又名桦木酸、桦木酯酸,见图2),并对其结构进行修饰,制得了一系列白桦酸的衍生物,不仅增强了水溶性,且生物活性增强、不良反应降低。
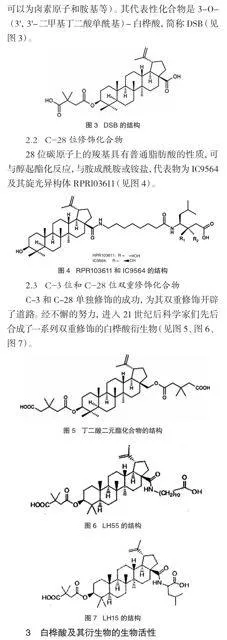
2 白桦酸衍生物
对白桦酸的修饰,主要部位集中在活性较强的C-3位、C-28位和C-20位。迄今,对C-20位的修饰虽已获得了成功,但结果还不令人满意,而对C-3位和C-28位的修饰已制得了的一些活性很高的化合物。
2.1 C-3位修饰化合物
3位碳原子上的官能团羟基,可发生取代反应和氧化反应,因此可用OR、NR、=NR、=O等基团修饰(R可以为相同或不同的各类烷基或环烷基、烯基、炔基;还
3.1 抗肿瘤活性
目前,化疗仍是药物治疗肿瘤的有效方法之一。众所周知,传统的化疗药物是通过影响DNA合成和细胞有丝分裂而发挥作用的,药物作用虽然较强,但因缺乏选择性,在杀死肿瘤细胞的同时,也同样杀死正常细胞,对机体造成损害,毒副作用较大。
1995年美国伊利诺伊大学的Pisha等人[3],报道了白桦酸通过诱导细胞凋亡可以完全抑制移植在裸鼠身上的人黑色素瘤的生长。后来人们发现,除黑色素瘤外,白桦酸对一些儿童常见的,诸如神经外胚层肿瘤、颅内脑瘤、恶性骨髓瘤;对乳腺癌、结肠癌、肝癌、卵巢癌、宫颈癌、血癌等具有广泛的抑制活性,且选择性好,对正常细胞几乎不显示毒性。
白桦酸之所以有这样的功能是因为它引起细胞凋亡的机制不同于传统药物,它直接作用于细胞凋亡调控中心——细胞线粒体,使其内、外膜之间发生去极化及通透性改变,释放凋亡诱导因子到细胞质中[4],从而激活细胞凋亡。
3.2 抗艾滋病毒HIV-1
在全球范围流行的艾滋病(AIDS)主要是由于人免疫缺陷病毒Ⅰ型(HIV-1)感染导致的。目前临床上普遍使用的治疗艾滋病的方法是鸡尾酒疗法(HAART)[5],即逆转录酶抑制剂和蛋白酶抑制剂联合用药,在病毒(HIV-1)进入靶细胞后抑制其转录、复制[6]。此疗法虽能大大提高艾滋病患者的生活质量,但药物还存有依赖药物剂量而产生的毒性(如骨髓毒性、外周神经疾病、胰腺炎、肌肉及肝脏异常、超敏反应等)以及病毒变异导致的耐药性等诸多缺陷。
实验已经证实,白桦酸及其衍生物在预防和治疗HIV-1感染方面具有其独特的优势:C-28位修饰化合物是HIV-1融合抑制剂,抑制方式有:抑制HIV-1与靶细胞的表面受体结合和抑制HIV-1与靶细胞发生膜融合两种[7]。由于在病毒复制早期发挥作用,所以能在感染的最初阶段抑制病毒的传播。C-3位修饰化合物则为HIV-1成熟抑制剂[8],可在病毒生命周期的晚期阻断HIV-1的复制,使得装配完成的病毒颗粒出现缺损,引起病毒的下一代变异或不能照原样复制,从而丧失对宿主细胞的感染能力[9]。C-3位和C-28位修饰化合物兼具上述二者的功能,同时具有抗融合和抗成熟活性,其活性有的至少是单纯抗成熟抑制剂DSB和抗融合抑制剂IC9564的10~20倍[10]。
3.3 其他生物活性
除上述生物活性外,白桦酸及其衍生物还具有抗炎、抗菌、镇咳祛痰,清热利湿,消肿解毒,提高机体免疫力,降血脂[11]和抑制恶性疟原虫[12]等生物活性。
4 白桦酸的制备
目前,白桦脂酸制备的方法主要有以下3种:直接提取法、化学合成法和微生物转化法。
4.1 直接提取法
即是用二氯甲烷、乙酸乙酯、丙酮、氯仿、乙醇等有机溶剂浸泡白桦树皮来提取白桦酸。这种方法因白桦树皮中含白桦酸量少(据有关文献报道仅为0.025%~2%[13]),原料消耗量大,且所得到的白桦酸杂质含量较高,不易除去,因而无法满足商业需要。
4.2 微生物转化法
这种方法是近年来新兴起的(2009年,ChenQH,LiuJ,ZhangHF,etal首次报道了通过微生物发酵的方法将白桦醇转化成白桦酸[14])利用有生物转化能力的微生物自身代谢产生的某个或某一系列的酶将白桦醇转化为白桦酸。尽管目前该法的研究还较少,有待于科学家的进一步探讨,但该法具有高立体选择性与区域选择性、反应条件温和、费用低、污染小等优点,很具发展潜力。(最近的文献资料请见:“黄绿蜜环菌生物催化白桦脂醇合成白桦脂酸的研究”[15])
4.3 化学合成法
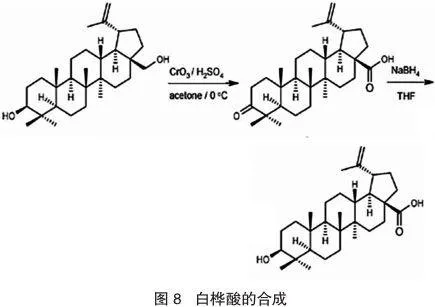
方法包括:3-OH保护多步合成、通过中间体(白桦酮酸或白桦醛)合成、由桦木醇一步合成。相比之下,以白桦酮酸为中间体的合成方法具有路线短、产率高、操作方便、方法成熟、适用于大规模生产等优点。该法是先用Jnoes试剂(琼斯试剂,由三氧化铬、硫酸和水配成)将白桦醇氧化成白桦酮酸,然后再用选择性还原剂(硼氢化钠/四氢呋喃NaBH /THF)还原白桦酮酸至白桦酸(见图8)。
2010年华东师范大学汤杰、仇文卫、杨帆等[16]对中间体白桦桐酸的合成进行了改进:先用选择性氧化剂2-碘酰基苯甲酸(2-Iodoxybenzoicacid,IBX)氧化白桦醇至白桦酮醛,进而用四丁基高锰酸铵(Bu NMnO )进一步氧化得白桦酮酸(见图9)。该法极具产业化前景。

5 结语
白桦酸及其衍生物具有抗肿瘤、抑制HIV-1病毒、抗炎及抗疟等多种生物活性,但由于白桦酸的缺乏,直接影响了它们作为临床用药的研究和开发。努力的方向:(1)加大微生物转化法制取白桦酸的研究力度,一旦取得实质性突破,由于其底物——白桦醇,植物资源丰富(干燥白桦树皮中白桦醇的含量高达22%~ 30%[17])就会大大降低生产成本,产生明显的社会效益和经济效益。(2)对白桦酸分子,在现有部位结构修饰的基础上,积极探索其他部位的结构修饰,以期制造出毒性更低、生物活性更强、使用更加安全的新的白桦酸衍生物制品。(3)借助其他学科(如基因组学、蛋白组学、药代动力学等)的研究成果对白桦酸类衍生物的生物活性机理进行协同研究,以期更详细地揭示其诱导细胞凋亡和抗融合、抗成熟作用的具体过程。
总之,白桦酸及其衍生物具有很好的应用开发潜力,对其制取方法、生物效应和作用机制进行深入的研究和临床开发,定能为预防和治疗威胁人类公众健康的各种疾病作出新的贡献。
参考文献:
[1][2]田水清,吕坤,方桂珍,韩世岩,艾青.桦木醇二酸酯衍生物的合成及溶解性能比较[J].北京林业大学学报,2009,319(6):111.
[3][4][13][17]徐军,王晋萍,钱辰旭,仇文卫,杨帆,汤杰.白桦酯酸的研究进展[J].生命科学,2011,23(5):504~506.
[5][6]何丽华.抗艾滋病病毒药物现状[J].医学信息,2010,(7):1866.
[7][8][10]苏青.白桦酸类衍生物抗HIV-1活性研究进展[J].西南军医,2007,9(3):84~85.
[9]郑沪灵.具有E杂环的甾体结构的白桦酸结构类似物的设计、合成及生物活性研究[D].上海:复旦大学,2009:7~9.
[11]周映霞,王振国,马莉,阎浩林.白桦酯酸及其衍生物的研究概况[J].中国药学杂志,2005,40(6):406.
[12]刘婧,章海锋,何国庆,李小玲,傅明亮,陈启和.白桦酯醇,白桦酯酸的研究进展及其前景[J].食品工业科技,2009,(10):361.
[14]Chen QH,Liu J,Zhang HF,etal. The Betulinic Acid Production from Betulin through Biotransformation by Fungi [J]. EnzymeMicrobTechnol,2009,45:175~180.
[15]刘婧.黄绿蜜环菌生物催化白桦脂醇合成白桦脂酸的研究[D].杭州:浙江大学硕士学位论文,2011.
[16]汤杰,仇文卫,杨帆,刘兵,徐军,龚雪萍.一种桦木酮酸的制备方法[P].中国:CN101759759A,2010,(6).
