高产纤维素酶菌株原生质体制备及再生条件
2013-12-29曾柏全冯金儒
李 淼,曾柏全,冯金儒
(中南林业科技大学 生命科学与技术学院,湖南长沙410004)
高产纤维素酶菌株原生质体制备及再生条件
李 淼,曾柏全,冯金儒
(中南林业科技大学 生命科学与技术学院,湖南长沙410004)
研究青霉菌Penicillium Q5和枯草芽孢杆菌Bacillus subtilis K3原生质体制备与再生的最佳条件。采用酶解法制备了青霉菌和枯草芽孢杆菌的高质量的原生质体。试验对亲本菌株的菌丝生长,酶浓度,酶解时间和灭活时间进行了优化。亲本菌株Q5,培养液中加入浓度0.5%甘氨酸和含量10%的蔗糖处理后,在质量浓度均为10 mg/mL的溶菌酶和蜗牛酶(1︰1)酶解作用下,35℃处理3 h,原生质体生成量达到最大值,为7.35×106cfu/mL;亲本菌株K3,用4 U/mL的青霉素处理,在1 mg/mL的溶菌酶作用下,35 ℃处理1 h,原生质体形成率与再生率的乘积达到最大值,此时K3原生质体量为1.46×107cfu/mL。青霉菌在65 ℃热灭活的时间为1 h,紫外灭活时间为3 min;枯草芽孢杆菌在65℃热灭活的时间是2.5 h,紫外灭活时间为5 min。这为后续原生质体融合选育具有抗逆性的高产纤维素酶菌株打下基础。
青霉菌Q5;枯草芽孢杆菌K3;原生质体制备;原生质体再生;原生质体灭活
纤维素(cellulose)被称为是地球上分布最广泛,含量最丰富、最廉价的可再生资源,其降解需要纤维素酶(cellulase),纤维素酶具有广泛的工业用途[1-3],可能成为需求量最大的工业用酶[4],目前关于纤维素酶方面的研究很多,但主要瓶颈性的问题在于目前用于纤维素酶的生产菌如里氏木酶 (T.reesei) 等,酶活力都比较低[5-6],对酸碱及温度的适应性不强。因此,选育出产纤维素酶量多、活力高及抗逆性较强的菌株对生产实践具有重要的意义。
枯草芽孢杆菌(Bacillus subtilis)是好氧或兼性厌氧型的革兰氏阳性杆状细菌,广泛分布在自然界,其产生的芽孢具有耐热、耐酸碱、耐旱、抗紫外线和有机溶剂等强抗逆性。在工业生产高温干燥的环境中,该特性可以保证微生物菌剂的活性,提高产品质量[7]。
原生质体融通过酶解去除亲本的细胞壁,进行融合,经过基因重组,获得具有双亲优良性状的融合子,具有广泛的应用性和随机性[8-9]。该技术自20世纪70年代发展至今,已得到广泛应用,Xu 等[10]以 4 株普纳霉素高产量的始旋链霉菌(S.pristinaespiralis) CGMCC0957突变菌为亲本进行原生质体融合,得到的优良菌株,普纳霉素产量比亲本高89.4%。Jin等[11]以10株产量较高的多杀菌素产生菌Saccharopolyspora spinosa为出发菌株,经过融合,得到高产菌株S. spinosa 4-7,其产量可达到547 mg/L,较出发菌株提高了200.55%以上。
本课题以产纤维素酶的青霉Q5和具有抗逆性的枯草芽孢杆菌K3为亲本,采用原生质体融合技术,PEG诱导双亲灭活原生质体融合,从得到的融合子中筛选保留双亲菌株优良性状的新菌株,即获得高产纤维素酶活力及抗逆性较强的新菌株。实验中就原生质体制备和融合过程中的几个影响因子进行了研究和优化,以期达到较高的形成率、再生率和融合率,为更好地获得融合子提供依据。
1 材料与方法
1.1 实验材料
1.1.1 菌种
菌种:青霉菌,枯草芽孢杆菌;均保存于中南林业科技大学发酵工程实验室。
1.1.2 培养基
牛肉膏蛋白胨琼脂培养基;PDA培养基;LB培养基;
发酵产酶培养基:蛋白胨0.4 g,酵母浸出膏0.05 g,药媒 3.18 g,淀粉 3 g,(NH4)2SO40.2 g,KH2PO40.4 g,CaCl20.03 g,MgSO40.03 g,CMCNa 3 g,水 100 mL,121 ℃高压灭菌 20 min;
菌丝培养液:蛋白胨 0.5 g,葡萄糖 1.0 g,酵母膏 0.4 g,MgSO40.05 g,KH2PO40.2 g,K2HPO40.4 g,水 100 mL,pH 5.8。
高渗再生培养基:蔗糖120 g,葡萄糖20 g,MgSO40.2 g,(NH4)2SO42.8 g, 尿 素 0.6 g, 硫酸 钾 4 g,FeSO40.01 g,MnSO40.003 g,ZnSO40.002 g,CaCl20.6 g,补水至 1 L,121 ℃高压灭菌 20 min。
筛选培养基:(NH4)2SO42.0 g,MgSO40.5 g,KH2PO41 g,NaCl 0.5 g,CMC-Na 20 g,刚果红0.4 g,琼脂 20 g,水 1 L,调节 pH 为 3 ~ 11,121 ℃高压灭菌 20 min。
1.1.3 主要试剂
原生质体稳定液(SMM):0.5 mol/L蔗糖,0.02 mol/L MgC12,0.02 mol/L CaCl2,0.02 mol/L顺丁烯二酸,pH6.0;
高渗磷酸缓冲液(P液):0.2 mol/L磷酸缓冲液 pH6.0,0.7 mol/L 甘露醇;
高 Ca2+和高 pH 值液:0.05 mol/L CaCl2,0.6 mol/L甘露醇,pH值10.5;
溶菌酶和蜗牛酶溶解于稳定液中,过滤除菌后备用;
PEG- 6000 溶液。
1.1.4 主要仪器
SW-CJ-1F 型水平超净工作台(江苏苏净集团安泰公司)、PYX-280S-A型生化培养箱(宁波江南仪器厂)、UV-1700紫外可见分光光度计(日本岛津公司)、全自动高压蒸汽灭菌器(DAΙHANLABTECH Co.,LTD)、倒置相差显微镜(北京东胜创新生物科技有限公司)、高速台式冷冻离心机(Benkman Coulter,Ιnc.)、AL204 型电子天平( 梅特勒-托利多仪器有限公司)等。
1.2 实验方法
1.2.1 青霉菌 Q5 原生质体制备
参照Aldo的方法[12]。将活化后的菌液转接入含有甘氨酸和蔗糖的菌丝培养液中,培养48 h,离心收集菌体,用无菌滤纸吸干水分,然后加入质量浓度均为10 mg/mL溶菌酶和蜗牛酶混合酶液中,35 ℃水浴中酶解,每隔0.5 h取样,观察原生质体形成情况。酶解结束用4层无菌擦镜纸过滤未酶解的菌丝,离心收集原生质体,将其悬浮于SMM溶液中。
1.2.2 枯草芽孢杆菌 K3 原生质体制备
参照李丽的方法[13]。取活化后的菌液37℃振荡培养 3 h,使细胞生长进入对数前期,加入适量青霉素,继续培养2 h后离心收集菌体,将菌体悬浮 SMM 中。取 0.5 mL 菌悬液,加入 0.5 mL 溶菌酶溶液,混匀后于37℃水浴保温处理,每隔15 min取样镜检,酶解结束离心收集原生质体,将其悬浮于SMM溶液中。
1.2.3 原生质体形成率、再生率及灭活率的计算
无菌水稀释原生质体悬液,静置10 min,使原生质体裂解死亡,再梯度稀释涂布于高渗再生培养基平板上,37℃培养48 h,计算原生质体形成率。SMM溶液梯度稀释原生质体悬液,涂布在高渗再生培养基的平板上,计数菌落,计算原生质体再生率。

式(1)中:A为酶处理前完全培养基上菌落数;B为酶处理后再经低渗处理获得的菌落数。
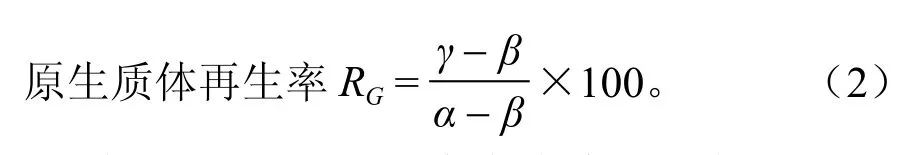
式(2)中:α为酶处理前完全培养基上菌落数;β为酶处理后再经低渗处理获得的菌落数;γ为酶处理后再经高渗处理获得的菌落数。
将两亲本原生质体悬液,于65 ℃恒温水浴箱中保温灭活,以未被高温处理的原生质体对照。将原生质体悬液置于30 W紫外灯20 cm处紫外照射灭活。以未经紫外线灭活的原生质体悬液为对照,32 ℃培养3~5 d。以处理时间为横坐标,灭活率为纵坐标绘制灭活曲线。

式(3)中:δ为未被处理菌体长出的菌落数;θ为被处理菌体长出的菌落数。
2 结果与讨论
2.1 亲本菌株的培养
2.1.1 蔗糖对 Q5 菌丝生长的影响
将活化后的Q5菌丝,转接到蔗糖质量浓度分别为0、10、15、20%的菌丝培养液中继续培养48 h后,用定量滤纸过滤,烘干至恒重,称量得菌丝干重。
在Q5菌丝的培养过程中,培养液中添加蔗糖,蔗糖,既作为碳源提供能量,可促进菌丝快速生长,还调节了细胞的渗透压[14],并可保持菌丝在培养基中的分散状态。如图1所示,当蔗糖为10%时,菌丝体的量达到最大值,但随着蔗糖浓度的逐渐增大,代谢产物中有机酸积累,抑制了菌丝体的生长,开始产生孢子,且菌丝团结球紧密,游离菌丝减少,与酶液接触受限,不利于原生质体的形成。
2.1.2 甘氨酸对亲本菌株生长的影响
图2中显示,Gly浓度在0%~1.0 %范围之内,Q5菌丝生长量递减缓慢,之后随其浓度的增加,生长量急剧减少。而K3菌在添加了甘氨酸的培养液中生长3 h后,菌体生长受到抑制。这可能是因为Gly可代替细胞壁肽聚糖中D2丙氨酸,从而影响了细胞壁短肽链之间的联结,造成细胞壁结构疏散,抑制了细胞的生长[15]。培养液中添加Gly可使细胞壁易被溶菌酶降解,易于原生质体的形成,但是Gly浓度过大,会影响菌体的生长,使形成率下降,且容易造成酶解过度而影响原生质体的再生。因此,Q5选用质量浓度为0.5%~1.0%的Gly为宜。而K3培养过程甘氨酸的添加量≤0.5%。

图1 蔗糖浓度对青霉菌Q5菌丝生长的影响Fig. 1 Effect of sucrose concentration on mycelial growth of Penicillium Q5

图2 甘氨酸浓度对亲本菌株生长的影响Fig 2 Effects of Gly concentration on growth of parent strains
2.1.3 青霉素对 K3 原生质体形成的影响
当细菌生长至对数前期,加入25 u/mL 青霉素,使其终浓度分别为0,1,2,3,4,5 u/mL,继续培养。每隔2 h测OD600值。实验结果重复两次。
由图3可知,随着时间的推移和青霉素浓度的增大,K3菌受青霉素的影响增强。由于青霉素可以干扰细胞壁上肽聚糖的合成,进而影响细菌细胞壁的完整性和空间结构,造成细胞壁结构疏松,易于被溶菌酶溶解[16]。图中显示青霉素浓度在5 U/mL时,K3的生长受到严重抑制,故在实验过程中采用亚抑制剂量4 U/mL的青霉素。

图3 青霉素浓度对枯草芽孢杆菌K3的影响 Fig 3 Effects of penicillin concentration on growth of Bacillus subtilis K3
2.2 原生质体的制备与再生
2.2.1 酶液浓度对原生质体形成和再生的影响
收集培养好的Q5菌丝用质量浓度均为10 mg/mL溶菌酶和蜗牛酶以不同比例混合酶解2 h,K3菌经处理后,以不同浓度的溶菌酶酶解1 h,之后涂于等渗再生培养基上,检测原生质体的形成和再生。
由于青霉细胞壁成分复杂,要获得较高的原生质体生成量,要合适的裂解酶。表1的数据显示,使用混合酶比单一酶酶解效果好。在显微镜观察下,经溶菌酶处理的菌丝大量断裂,但形成的原生质体较少。这可能是由于溶菌酶主要作用于细胞壁粘肽结构中的β-1,4糖苷键,而青霉细胞壁的组成成分复杂,溶菌酶对其菌丝去壁的作用不明显。实验中以溶菌酶和蜗牛酶1︰1的比例处理为宜。

表1 酶解浓度对亲本菌株原生质体的形成和再生的影响Table 1 Effects of enzyme concentration on protoplsat formation and regeneration of parent strains
K3原生质体的形成率随着溶菌酶液浓度的增加而增大。但其再生率在1 mg/mL达到最大值后,在酶液浓度为2 mg/mL时开始出现下降趋势,可能是由于溶菌酶的质量浓度增大,枯草芽孢杆菌细胞壁被破坏的较彻底,其修复和再生的能力变弱,影响其在再生培养基上的再生。故而选择1 mg/mL的溶菌酶酶解枯草芽孢杆菌为宜。
2.2.2 酶解时间对菌株原生质体形成和再生的影响
取处理好的菌液,收集菌体。青霉Q5以质量浓度均为10 mg/mL溶菌酶和蜗牛酶1∶1混合液酶解;K3菌以1 mg/mL溶菌酶溶液酶解,置于35 ℃水浴保温处理,每隔一段时间镜检计数,计算两菌株原生质体的生成量和再生率,绘制成图4。
图4中显示青霉在3 h时,原生质体产量达到最大值,7.35×106cfu/mL,再生率为37.81%,此时原生质体活力最好。在4 h时,其形成率开始下降,这可能是由于随着酶液在细胞壁上作用时间的延长,裂解酶进一步损伤原生质体[17],使其破裂,且再生率也随之下降。而随着溶菌酶处理枯草芽孢杆菌的时间增长,原生质体的数量逐渐增多,原生质体形成率在酶解2 h后达到86.54%,而其再生率在1 h达到27%后开始下降,原生质体的形成率与再生率在其制备过程中同等重要,故选用二者的乘积作为影响因素的考察指标[18]。由形成率和再生率的乘积来看,酶解时间1 h为最适时间。

图4 酶解时间对菌株原生质体形成和再生率的影响Fig.4 Effects of enzyme treatment time on protoplast formation and regeneration of parent strains
2.2.3 青霉原生质体形成过程
青霉Q5菌丝在酶液的作用下,随着酶解时间的增加,原生质体由菌丝顶端和段端位释放[19],前期形成的原生质体较小,到酶解中期,大部分菌丝被酶解为片段,可以看到大量菌丝顶端与段端位膨大,释放出更多原生质体,视野内出现大量不规则细胞,可能是由于此时释放的原生质体还带有破碎的菌丝细胞壁,在酶解后期,原生质体在适合的渗透压下维持圆形。
2.2.4 枯草芽孢杆菌 K3 原生质体形成过程
K3菌体在溶菌酶的作用下,随着酶解时间的增长,由菌体一端释放原生质体,到酶解中期时(图6B),视野中出现大量顶端带有球形的杆菌,到酶解后期,视野中出现大量圆形原生质体(图6C)。

图5 青霉菌的原生质体的制备(60× 油镜)Fig. 5 Protoplast preparation of Penicillium Q5 (photographed by 60×oil immersion lens)

图6 枯草芽孢杆菌原生质体的制备(60×油镜)Fig. 6 Protoplast preparation of Bacillus subtilis K3 (photographed by 60×oil immersion lens)
2.3 灭活条件的确定
2.3.1 热灭活时间的确定
高温处理对亲本原生质体细胞进行钝化处理,使细胞内某些遗传物质不能正常表达,进而无法长出正常细胞,当两亲本融合后,细胞内物质可能因互补而长出菌落。由图7看出,Q5原生质体在65 ℃水浴处理1 h后,灭活率已基本趋于100%,而K3原生质体65 ℃热灭活的最适时间是2.5 h。
2.3.2 紫外灭活时间的确定
以紫外线处理原生质体,影响了细胞内某些功能的丧失,而融合子可能由于细胞间的重组修复了这种损伤,进而可以在平板上长出菌落。由图8看出,Q5的最适灭活时间是3 min,K3的最适热灭活时间是5 min。
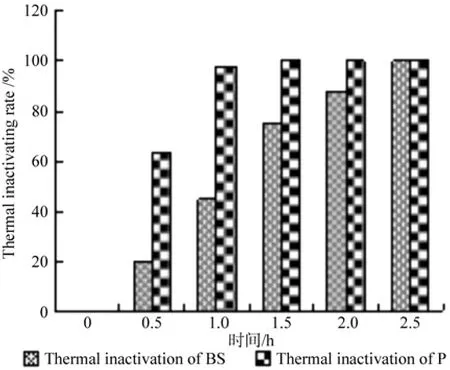
图7 温度处理对青霉菌Q5和枯草芽孢杆菌的影响K3Fig.7 Effects of temperature treatment on livability of Penicillium Q5 and Bacillus subtilis K3

图8 青霉菌Q5和枯草芽孢杆菌K3紫外灭活曲线Fig. 8 Ultraviolet inactivation curves of Penicillium Q5 and Bacillus subtilis K3
3 结 论
笔者采用酶解法获得青霉菌和枯草芽孢杆菌的高质量的原生质体,酶解前在Q5菌丝培养液中加入质量浓度0.5%甘氨酸和质量浓度10%的蔗糖,使细胞壁结构疏松,菌丝分散,有利于酶解,但甘氨酸和蔗糖浓度过高时,会因酶解过度进而影响原生质体的再生率。在K3的培养液中加入低浓度的青霉素(4 U/mL)和甘氨酸(0.5%),两者均可干扰杆菌细胞壁的合成,提高原生质体的形成率。增加酶的质量浓度,延长酶解时间均可使原生质体的形成率升高,但是影响了原生质体的再生,这可能是由于在高浓度的酶液和较长时间的酶解作用下,细胞壁的成分被很大程度上遭到破坏,在缺乏引物的情况下,细胞壁的再生会变得很困难,从而影响原生质体的再生率[20]。因此试验中以质量浓度均为10 mg/mL的溶菌酶和蜗牛酶(1∶1)混合后作用于Q5,35 ℃处理3 h,原生质体生成量达到最大值为7.35×106cfu/mL,再生率为37.81%;枯草芽孢杆菌K3在1 mg/mL的溶菌酶作用下,35 ℃处理1 h,其原生质体形成率与再生率的乘积达到最大值,此时原生质体量达到最大值为1.46×107cfu/mL,再生率为27%。青霉菌在65 ℃热灭活的时间为1 h,紫外灭活时间为3 min;枯草芽孢杆菌在65 ℃热灭活的时间是2.5 h,紫外灭活时间为5 min。用温度和紫外处理亲本原生质体,使细胞某些遗传物质无法表达或无法正常工作,而使其不能成长为正常的菌落,在融合子中可能会因为细胞间的重组和互补而得到修复。
在原生质体育种技术中,原生质体的制备是关键性的一环,在酶解去壁的过程中,各因子对原生质体的形成率和再生率都起着至关重要的作用,这些影响因子的条件会因菌株的差异而各不相同。本实验对Q5和K3原生质体的制备和再生进行了研究,提高了原生质体融合的效率,为后续选育新菌株打下了基础。
[1]Estácio Jussie Odisi, Marcela Bruschi Silvestrin, Rodrigo Yoji Uwamori Takahashi, et al. Bioprospection of cellulolytic and lipolytic South Atlantic deep-sea bacteria[J]. Electronic Journal of Biotechnology, 2012, 15∶ 1-11.
[2]刘超纲 . 纤维素酶的工业应用展望 [J]. 经济林研究 , 1996, 14 (1)∶ 30-31.
[3]陆 晨 , 陈介南 , 王义强 , 等 . 一株产纤维素酶真菌的筛选及产酶条件优化 [J]. 中南林业科技大学学报 , 2012, 32(6)∶ 118-122.
[4]Wilson D B. Cellulases and biofuels [J]. Curr Opin Biotechnol. 2009, 20 (3)∶295–299.
[5]Soloveva Ι V, Okunev O N, Kryukora E G. Neutral cellulases of mycelial fungi∶searching for producer sand their characterization[J]. Biochem. Microbiology, 1997,33 (4)∶388-392.
[6]杜先林 , 李 辉 , 王义强 , 等 . 里氏木霉 Rut-30 产纤维素酶发酵条件的优化 [J]. 中南林业科技大学学报 , 2010, 30 (9)∶ 112-119.
[7]Abdul Sattar Qureshi, Muhammad Aqeel Bhutto, Yusuf Chisti, et al. Production of pectinase by Bacillus subtilis EFRL 01 in a date syrup medium[J]. African Journal of Biotechnology, 2012, 11(62)∶12563-12570.
[8]Zheng H J, Gong J X, Chen T, et al. Strain improvement of Sporolactobacillus inulinus ATCC 15538 for acid tolerance and production of D-lactic acid by genome shuffling[J]. Appl Microbiol Biotechnol, 2010, 85∶ 1541-1549.
[9]任柏林, 谢水波, 刘迎久, 等. 单亲灭活柠檬酸杆菌与奇球菌原生质体融合 [J]. 微生物学通报 , 2010, 37(7)∶ 975-980.
[10] Xu B, Jin Z H, Wang H Z, et al. Evolution of Streptomyces pristinaespiralis for resistance and production of pristinamycin by genome shuff l ing[J]. Appl Microbial Biotechnol, 2008, 80∶ 261-267.
[11] Jin Z H, Xu B, Lin S Z, et al. Enhanced production of spinosad in Saccharopolyspora spinosa by genome shuffling[J]. Appl Biochem Biotechnol, 2009, 9∶ 125-133.
[12] Aldo Jose Pinheiro Dillon, Marli Camassola, Joao Antonio Pegas Henriques. Generation of recombinants strains to cellulases production by protoplast fusion between Penicillium echinulatum and Trichoderma harzianum[J]. Enzyme and Microbial Technology, 2008, 43(6)∶403-409.
[13] 李 丽 , 房 杰 , 黄洁洁 , 等 . 单亲灭活德氏乳杆菌和乳酸乳球菌原生质体融合条件优化[J].食品科学, 2012,33(5)∶193-198.
[14] 王丽华 , 陈建华 , 李昌珠 , 等 . 光皮树花药愈伤组织的诱导[J]. 经济林研究 , 2011, 29 (1)∶ 94-98.
[15] Prabavathy V R, Mathivanan N, Sagadevan E, et al. Ιntra-strain protoplast fusion enhances carboxymethyl cellulase activity in Trichoderma reesei[J]. Enzyme and Microbial Technology, 2006, 38∶719-723.
[16] 朱宏莉 ,宋纪蓉 ,张 嘉 , 等 . 果胶酶产生菌 ZH-g 的原生质体形成与再生研究 [J]. 食品科学 , 2006, 27(8)∶ 68-71.
[17] 武金霞 , 赵 睿 , 张贺迎 . 米曲霉种内原生质体融合选育优良菌株 [J].中国酿造 , 2012, 31(2)∶ 132-136.
[18] 李昌珠 , 王丽华 , 陈建华 , 等 . 光皮树花药愈伤组织原生质体分离的研究 [J]. 中南林业科技大学学报 , 2012,32(4)∶135-139.
[19] 田 媛 , 苑社强 , 白晓青 , 等 . 康氏木霉原生质体制备与再生研究 [J]. 中国酿造 , 2010, 7∶ 75-79.
[20] 韩 璞 , 田洪涛 , 苑社强 , 等 . 罗伊氏乳杆菌原生质体的制备与再生条件的研究 [J]. 中国食品学报 , 2010, 10(1)∶10-18.
Protoplast preparation and regeneration conditions of Penicillium Q5 and Bacillus subtilis k3
LΙ Miao, ZENG Bai-quan, FENG Jin-ru
(School of Life of Science and Technology, Central South University of Forestry and Technology, Changsha 410004, Hunan, China)
The optimum conditions for the formation, regeneration and deactivation of protoplasts of Penicillium Q5 and Bacillus subtilis K3 were studied. The high-quality protoplasts of Penicillium Q5 and Bacillus subtilis K3 have been prepared by using enzymatic hydrolysis method. Through the tests, the conditions including microbial growth, the content of cellulase and time for reaction and the optimal inactivated time were optimized. The amount of protoplast from Penicillium Q5 gained a maximum, 7.35×106cfu/mL, and the corresponding above used values were 0.5% Glycolic, 10% sugar, 10 mg/mL lysozyme and snail enzyme (1 ︰ 1), 3 hours, and 35 ℃ . While the product of protoplast preparation and regeneration from Bacillus subtilis K3 reached the top, and the amount of protoplast from K3 maximized 1.46×107cfu/mL, and the corresponding above used values were 4 U/mL penicillin, 1 mg/mL lysozyme, 1 hours, and 35 ℃ . The period of the optimal heat inactivation in 65 ℃ was 1 hour for Penicillium Q5, while 2.5 hours for Bacillus subtilis K3. And the time of ultraviolet inactivation was 3 min for Penicillium Q5, and 5 min for Bacillus subtilis K3. The f i ndings provided a suitable material for protoplast fusion between Penicillium Q5 and Bacillus subtilis K3, which products high-yield cellulase with resistance.
Penicillium Q5; Bacillus subtilis K3; protoplast preparation; protoplast regeneration; protoplast deactivation
S718.8
A
1673-923X(2013)12-0174-07
2013-08-16
湖南省科技计划项目(2012NK3113);湖南省教育厅科学研究重点项目(13A123)资助
李 淼(1989-),女,硕士研究生;E-mail:heart1001@126.com
曾柏全(1967-),男,湖南邵东人,副教授,博士;E-mail:baiquanzhn@163.com
[本文编校:邱德勇]
