活性炭对CO2的吸附及动力学研究
2013-12-29简相坤刘石彩
简相坤,刘石彩
(1. 中国林业科学研究院 林产化学工业研究所,江苏 南京 210042;2. 江苏省生物质能源与材料重点实验室,江苏 南京 210042)
活性炭对CO2的吸附及动力学研究
简相坤,刘石彩
(1. 中国林业科学研究院 林产化学工业研究所,江苏 南京 210042;2. 江苏省生物质能源与材料重点实验室,江苏 南京 210042)
研究不同温度和流量下活性炭对CO2的吸附容量,并对CO2在活性炭内的扩散行为和吸附动力学进行研究。结果表明:气体流量对活性炭吸附CO2的饱和吸附量影响不大,气体流量增大时饱和吸附容量先稍微增加后稍微降低,在600 mL/min时饱和吸附量最大,温度对活性炭吸附CO2的饱和吸附量影响较大,温度升高时CO2的饱和吸附量明显降低,273 K时饱和吸附量为96.0 mg/g,311 K时仅有58.0 mg/g;Fick定律能够很好的描述CO2在活性炭内的扩散行为,扩散系数随着温度的升高而增大,CO2在活性炭内属于晶体扩散;活性炭对CO2的吸附动力学遵循Bangham动力学方程。
活性炭;二氧化碳;扩散系数;吸附动力学
二氧化碳作为一种重要的工业原料可以用在制纯碱、尿素和汽水等[1]方面。在工业应用领域如发电厂、合成氨、制氢、天然气净化等[2]工业过程都包含CO2的脱除工序。目前,二氧化碳的回收技术有很多,如吸收分离法、吸附分离法、膜分离法以及低温分离法等[3],其中吸附法具有能耗低、吸附剂使用周期长、工艺流程简单、自动化程度高、无腐蚀、无环境污染等[4-5]特点,在工业应用中比较广泛。活性炭是一种环境友好型吸附材料,具有高度发达的孔隙结构,巨大的比表面积[6-7],吸附能力强,化学性质稳定,易再生等特点,被广泛地应用于化工、医疗和环保等[8]众多领域,是吸附分离CO2的常用吸附剂。活性炭对CO2的吸附容量大,且具有疏水性,容易解吸[9],但活性炭因原料及制造工艺条件的不同,其吸附性能也有较大差异[10]。近些年人们对活性炭吸附CO2进行了大量的研究,但是对活性炭吸附CO2的动力学研究还不多。本研究选取市场上专用的气相吸附活性炭,测定不用温度和流量下活性炭对CO2的吸附容量,并且研究了CO2在活性炭内的扩散行为,考察了4种动力学吸附模型对CO2在活性炭上吸附过程的描述效果,为其在工业应用中提供理论指导和技术支持。
1 实 验
1.1 原料和试剂
实验所用的活性炭为淮北某活性炭公司生产的气相吸附专用活性炭,物性参数如表1所示;实验中所用的高纯 He(99.999 %)和 CO2(99.995 %)购于南京麦克斯南分特种气体有限公司;碘,分析纯,购于南京化学试剂有限公司;碘化钾为分析纯,购于国药集团化学试剂有限公司;Na2S2O3,分析纯,购于上海久亿化学试剂有限公司。

表1 活性炭样品的物性参数Table 1 Main physical parameters of activated carbon
1.2 活性炭的表征
活性炭的表观密度和碘吸附值分别按照国家标准GB12496.1—1999和GB12496.8—1999测定;活性炭的孔结构参数用ASAP -2020全自动比表面积及孔隙分析仪以氮气为吸附质在77 K时测定,用 BET方程计算活性炭的比表面积,总孔容在相对压为0.995时得到,用H-K方程计算微孔孔容。
1.3 CO2 吸附量的测定
采用重量法测定活性炭对CO2的吸附量,测定前先用高纯He吹扫吸附管路以及吸附剂,然后抽真空,通CO2,隔一定的时间称重,至质量不在增加为止。吸附柱为专门订做的玻璃柱,高为10 cm,内径为 2 cm,吸附装置见图 1。
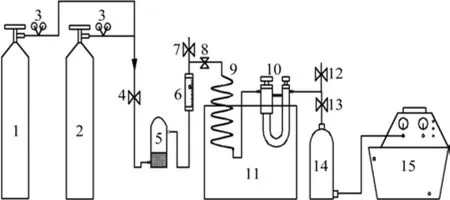
图1 活性炭对 CO2 的吸附装置Fig.1 Adsorption device of CO2 onto activated carbon
活性炭对CO2的吸附量:

式(1)中:q-CO2吸附量,mg/g;m1-吸附柱质量;m2-吸附柱与活性炭的质量;m3-吸附柱与活性炭及CO2的质量。
2 结果与讨论
2.1 CO2 流量对吸附性能的影响
温度为298 K,CO2流量分别为300、600、1 000、1 500 和 1 800 mL/min 时 测 定 活 性 炭 对CO2的饱和吸附量,结果见图2。

图2 流量对活性炭吸附 CO2 的影响Fig.2 Effects of CO2 f l ow on adsorption of CO2 onto activated carbon
从图2中可以看出,在不同的气体流量下,活性炭的吸附速率在前3 min都比较大,然后接近饱和时迅速降低,达到饱和吸附量的时间稍微不同,流量为300 mL/min,达到饱和吸附量需要7 min,当流量增加到 1 500 和 1 800 mL/min 时达到饱和吸附量仅需5 min。流量的增加使活性炭对CO2的饱和吸附量先增加后减小,当CO2流量为600 mL/min时饱和吸附量最大为70.9 mg/g,而流量为 300、1000、1 500 和 1 800 mL/min 时,饱和吸附量分别是70.4、70.3、68.5和67.8 mg/g,总体的变化幅度不是很大,可能由于活性炭对CO2的吸附属于物理吸附,主要受范德华力作用,被吸附的CO2不稳定,较容易发生脱附,当流量增加时,使少量CO2受流量的影响发生了脱附,导致饱和吸附量减少。
2.2 温度对吸附性能的影响
在CO2流量为600 mL/min,水浴温度分别为273、288、298和311 K时测定活性炭对CO2的饱和吸附量,结果见图3。
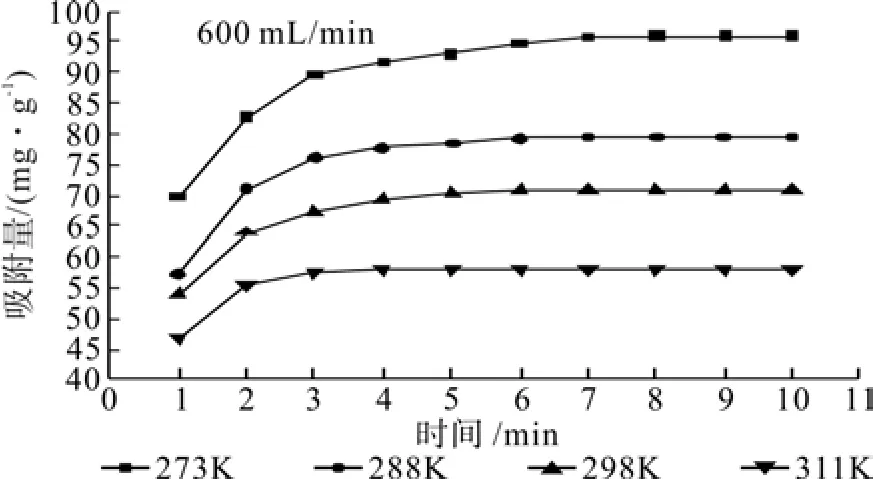
图3 温度对活性炭吸附 CO2 的影响Fig.3 Effects of Kelvin temperature on adsorption CO2 onto activated carbon
从图3中可以看出,273 K时活性炭吸附CO2在8 min时达到饱和,而在288、298和311 K时,达到饱和吸附量的时间分别为7、6和5 min。273 K时活性炭的饱和吸附量为96.0 mg/g,而288、298和311 K时活性炭对CO2的饱和吸附量分别为79.5、70.9 和 58.0 mg/g,降幅达到了 60 % 以上,可知CO2的饱和吸附量随着温度的升高而明显降低,因为活性炭对CO2的吸附属于物理吸附,吸附过程放热,温度升高不利于吸附[11]。
2.3 CO2 的扩散系数
在等温条件下,吸附速度由3个基本过程控制[10]:
(1)吸附质在吸附剂粒子表面液膜中的移动速度;
(2)粒子内的扩散速度;
(3)粒子内细孔表面的吸附速度。
其中,过程(3)的吸附速度很快,因此总吸附速度取决于过程(1)和(2)。对流体分子在吸附剂内部的吸附扩散行为,采用Fick第二定律来描述。一般吸附动力学曲线分为吸附初期的快速吸附和后续慢速吸附两个阶段,在测定的过程中前阶段由于体系不稳定,本文采用慢速的动力学方程计算CO2在活性炭孔隙内部的扩散系数。
假设吸附剂为均质颗粒,且颗粒表面的吸附质浓度为常数,整个吸附体系温度恒定,则对于慢速吸附阶段 (qt/q∞> 0.5 )有[12]:

式(2)中,q∞为饱和吸附量,mg/g;D为扩散系数,m2/s;r为颗粒平均半径,m。
对式(2)整理并取自然对数,即
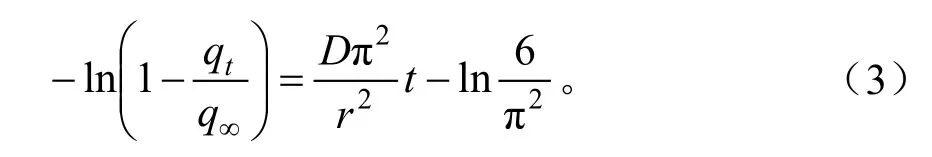
令-ln(1-qt/q∞) 和t分别为因变量和自变量,则可以在qt/q∞>0.5范围内通过线性回归得到Dπ2/r2的大小。
根据式(3)对图2中CO2吸附动力学曲线进行线性回归,其结果见表2。从表2以看出,扩散系数随着温度的升高逐渐增大。通常分子在多孔介质孔道内的扩散可以分为[13]:自由扩散(D:10-5~10-4)、Kundsen扩散(D:~10-6)、表面扩散(D<10-7)和晶体扩散(D<10-9)。由表2中的扩散系数可知CO2在活性炭内的扩散属于晶体扩散。

表2 不同温度下CO2的扩散系数Table 2 Diffusion coefficients of CO2 at different Kelvin temperature
2.4 吸附动力学研究
2.4.1 准一级吸附模型
用Lagergren方程计算吸附速率[14]:
dq/dt=k1(qe-qt) 。 (4)
对式(4)从t=0到t>0(q=0到q>0) 进行积分,可以得到:
qt=qe-qee-k1t。 (5)
式(5)中:qe和qt分别为t时刻与平衡态时的吸附量,mg/g;k1为准一级吸附速率常数,min-1。
2.4.2 准二级吸附模型
准二级动力学方程是通过电子共享或得失的化学吸附基础上建立在速率控制步骤,表达式为[15]:
dq/dt=k2(qe-qt)2; (6)
对式(6)从t=0到t>0(q=0到q>0) 进行积分,可以得到:
t/qt=1/(k2qe2)+t/qe; (7)
整理得:

式(8)中,qe和qt分别为t时刻与平衡态时的吸附量,mg/g;k2为准二级吸附速率常数,mg·g-1min-1。
2.4.3 Elovich 动力学方程
Elovich动力学方程认为吸附速率随吸附剂表面吸附量的增加而成指数下降,其简化的数学表达式为[16]:
qt=(1/βE)ln(αEβE)+(1/βE)ln(t)。 (9)
式(9)中:qt为吸附容量,mg·g-1;αE为初始吸附速率常数,mg·g-1min-1;βE为脱附速率常数,g·mg-1。
2.4.4 Bangham 吸附速率方程
班厄姆公式可写成如下形式[17]:
dq/dt=k(qe-q)/tz; (10)
积分式为:

整理后得:
qt=qe-qe/ektz。 (12)
式(12)中,qe和qt分别为t时刻与平衡态时的吸附量,mg/g;k和z为常数。
用上述4种动力学方程分别对图3中的数据进行Origin非线性拟合,结果如图 4所示,拟合所得的各模型参数如表3所示。
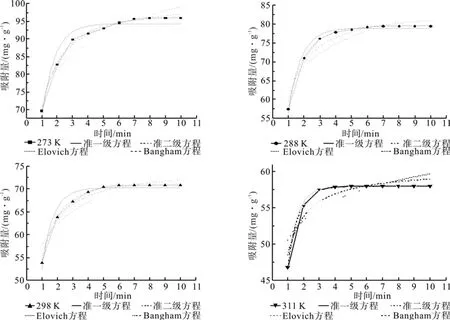
图4 不同温度时活性炭吸附CO2的4种动力学方程拟合曲线Fig.4 Kinetic equation of f i tting curves for adsorption of CO2 onto activated carbon at different temperature
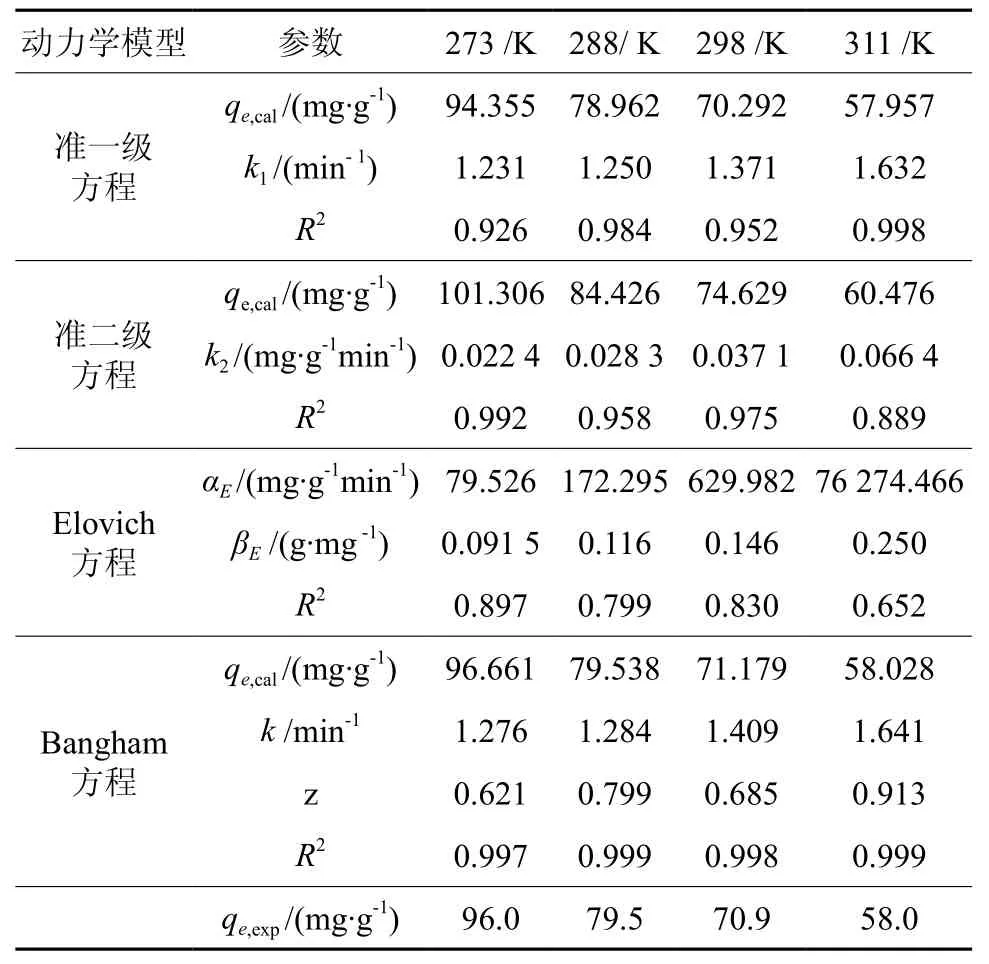
表3 不同温度下活性炭吸附CO2的动力学拟合参数Table 3 Parameters of four kinetic models for adsorption of CO2 onto activated carbon at different temperature
从图4中可以看出,Bangham方程拟合度更好,结合表3可知,拟合所得Bangham方程的相关系数R2均高于0.997,而且从Bangham方程计算得到的qe,cal与实验得到的qe,exp非常接近。以上结果表明,Bangham方程能更好地描述活性炭对CO2的吸附动力学过程,而准一级方程和准二级方程以及Elovich方程拟合的相关系数相对较低,同时方程计算得到的qe,cal与实验得到的qe,exp误差相对较大。
3 结 论
(1)气体流量对活性炭吸附CO2的饱和吸附量影响不大,气体流量增大时饱和吸附容量先稍微增加后稍微降低,在600 mL/min时饱和吸附量最大。温度对活性炭吸附CO2的饱和吸附量影响较大,温度升高时CO2的饱和吸附量明显降低,273 K 时为 96.0 mg/g,311 K 时仅有 58.0 mg/g。
(2)Fick定律能够很好的描述CO2在活性炭内的扩散行为,CO2的扩散系数随着温度的升高而增大,在活性炭内的扩散属于晶体扩散。
(3)活性炭对CO2的吸附动力学行为遵循Bangham动力学方程,其拟合的相关系数R2均大于0.99,通过Bangham方程计算得到的qe,cal与实验得到的qe,exp非常接近,通过拟合可以得到理想的吸附速率方程。
[1] 黄艳芳, 马正飞, 姚虎卿. 活性炭吸附CO2与其微孔体积的关系 [J]. 燃料化学学报 , 2008, 36(3)∶343-348.
[2]费维扬 , 艾 宁 , 陈 健 . 温室气体 CO2的捕集和分离—分离技术面临的挑战与机遇 [J]. 化工进展 , 2005, 24(1)∶1-4.
[3]Anand B R, Edward S R. A technical, economic and environmental assessment of amine-based CO2capture technology for power plant greenhouse gas control[J]. Environmental Science and Technology, 2002, 36(20)∶4467-4475.
[4]Takamura Y, Narita S, Aoki J, et al. Evaluation of dual-bed pressure swing adsorption for CO2recovery from boiler exhaust gas[J]. Separation and Purif i cation Technology, 2001, 24(3)∶519-528.
[5]徐 东 , 张 军 , 李 刚 , 等 . CO2和 H2O 在活性炭上的吸附平衡和吸附动力学研究 [J]. 无机材料学报 , 2012,27(2)∶139-145.
[6]厉 悦 , 李湘洲 , 刘 敏 . 稻壳基活性炭制备及表征 [J]. 中南林业科技大学学报 , 2007, 27(6)∶183-186.
[7]简相坤 , 刘石彩 , 边 轶 . 硼酸催化制备玉米芯活性炭工艺研究 [J]. 中南林业科技大学学报 , 2012, 32(10)∶198-202.
[8]Zhang Shujuan, Feng Huimin, Wang Jianping, et al. Structure evolution and optimization in the fabrication of PVA-based activated carbon fibers[J]. Journal of Colloid and Ιnterface Science, 2008, 321(1)∶96-102.
[9]徐 冬 , 张 军 , 李 刚 , 等 . 电厂废气中饱和水蒸气对活性炭变压吸附捕集 CO2的影响 [J]. 燃料化学学报 , 2011, 39(3)∶ 169-174.
[10] 陈 飞,刘晓勤. 活性炭变压吸附脱除二氧化碳的性能研究[J]. 天然气化工 , 2007,32(6)∶37-41.
[11] 方 平 , 岑超平 , 唐子君 , 等 . 污泥炭吸附剂对气态汞的吸附[J]. 化工环保 , 2012, 32(3)∶217-221.
[12] 张登峰 , 崔永君 , 李松庚 , 等 . 甲烷及二氧化碳在不同煤阶煤内部的吸附扩散行为 [J]. 煤炭学报 , 2011, 36(10)∶1693-1698.
[13] 叶振华. 化工吸附分离过程[M]. 北京:中国石化出版社, 1992∶80-81.
[14] Wu Feng chin, Tseng Ru ling, Hu Chi chang. Comparisons of pore properties and adsorption performance of KOH-activated and steam-activated carbons[J]. Microporous and Mesoporous Materials, 2005, 80∶95-106.
[15] Ho Y S, Mckay G. Pseudo-second order model for sorption processes[J]. Process Biochemistry, 1999, 34(5)∶451-465.
[16] Chien S H,Clayton W R.Application of Elovich equation to the kinetics of phosphate release and sorption in soils[J]. Soil Science Society of America Journal, 1980,44(2)∶265-268.
[17] Bangham D H, Sever W. An experimental investigation of the dynamical equation of the process of gas-sorption[J]. Philosophical Magazine and Journal of Science, 1925,49(6)∶935-944.
Research on adsorption of CO2onto activated carbon and course kinetics
JΙAN Xiang-kun, LΙU Shi-cai
(1. National Engineering Lab. for Biomass Chemical Utilization, Ιnstitute of Chemical Ιndustry of Forest Products, CAF, Nanjing 210042, Jiangsu, China; 2. Jiangsu Province Key Lab. of Biomass Energy Sources and Materials,Nanjing 210042, Jiangsu, China)
The adsorption capacity of CO2at different temperature and f l ow on activated carbons, diffusion behavior and adsorption kinetics of CO2on activated carbons were studied. The results indicate that the f l ow of CO2had a little effect on adsorption capacity of CO2onto activated carbons, the adsorption capacity increased with an increase of CO2f l ow, but it decreased when the f l ow exceeded 600 mL/min, while the values of both increases and decreases f l uctuated within a narrow range,the Kelvin temperature was greatly inf l uenced on adsorption capacity, the adsorption capacity decreased with an increase of Kelvin temperature, the adsorption capacity was 96.0 mg/g at 273 K, but it is only 58.0 mg/g at 311 K. The second Fick’s law could well describe the diffusion behaviors of CO2in activated carbons under the experimental conditions, the diffusion coeff i cient increased with an increase of Kelvin temperature, and it belongs to intra-crystalline diffusion. The adsorption kinetics is satisf i ed with Bangham equation.
activated carbon; carbon dioxide; diffusion coeff i cient; adsorption kinetics
S785
A
1673-923X(2013)12-0161-05
2013-03-25
农业科技成果转化资金项目(2012GB24320583);国家科技支撑计划项目(2012BAD30B03)
简相坤(1988-),男,河南信阳人,硕士研究生,主要从事多孔炭材料方面的研究;E-mail:jianxiangkun@163.com
刘石彩(1965-),男,湖南邵东人,副研究员,主要从事生物质能源及活性炭方面的研究;E-mail:lshica@sina.com
[本文编校:文凤鸣]
