超声辅助提取米糠多糖工艺参数研究1)
2013-12-28周雪松张娜刘晓飞马永强
周雪松,张娜,刘晓飞,马永强*
米糠中的多糖,是醛糖或酮糖由糖苷键链接在一起的聚合物,由a-1,6葡萄糖苷键连接的葡萄糖构成,广泛存在于稻谷颖果皮层中。其中水溶性多糖与一般均聚糖不同,是一种结构复杂的杂聚糖[1-3]。米糠多糖在抗肿瘤、免疫增强、抗细菌感染及降血糖血脂等方面也具有较高的生物活性[4]。
国内对米糠资源的深度开发利用还不够广泛深入,对米糠的综合利用还只局限于肌醇、植酸等传统产品的开发,综合利用价值急需提高。尽管近年来也作了一系列多层次的开发和利用,如米糠纤维饮料的研制、米糠油的提取、植酸和肌醇的制备、米糠营养素和营养纤维的制备等。但总体而言对其中的多糖进行深度开发利用则较少。
1 材料与方法
1.1 实验材料
1.1.1 样品
米糠产自“长粒香”品种大米,购自黑龙江伊春铁力农场
1.1.2 试剂
所有试剂均为分析纯。
1.2 实验仪器
ALC-110.4型电子分析天平,北京赛多利斯仪器系统有限公司;722型分光光度计,上海精密科学仪器有限公司;FZ102型微型植物粉碎机,天津泰斯特仪器有限公司;TDL80-2B台式离心机,上海安亭科学仪器厂;KQ-500VDE双频超声波清洗器,昆山市超声仪器有限公司。
1.3 实验内容与方法
1.3.1 超声辅助提取米糠多糖
(1)样品前处理。取适量米糠置于105℃电热恒温鼓风干燥箱中干燥1h,除去水分;粉碎,过40目筛;加入5倍于样品体积的石油醚浸泡4h,重复一次,除去脂肪;抽滤之后,于通风橱中45℃水浴除去石油醚。
(2)酶液制备。准确称取α-淀粉酶0.2367g(酶活为3380U/g),用pH 5.0的柠檬酸-磷酸氢二钠缓冲溶液(0.1mol/mL)溶解,并定容至100mL。
(3)提取工艺。称取经前处理后的米糠样品10g置于锥形瓶中,加入料液比为15∶1(V∶W)的蒸馏水,在60℃条件下,设置功率为400W、频率为45kHz进行超声辅助提取,时间为30min;提取完毕后,以3000r/min转速离心20min,合并上清液置于锥形瓶,加入10mLα-淀粉酶溶液,调节pH为6.0,于60℃保温,至碘反应为阴性为止,除去淀粉,再升温至100℃保持15min,除去α-淀粉酶酶活;加入五分之一于样液体积的12%三氯乙酸溶液,调节pH至4.5,震荡10min,除去蛋白质;调至中性,以1200r/min转速离心10min,合并上清液,加入3倍体积比的95%乙醇,静置过夜后,再以2000r/min转速离心10min,获得白色沉淀即为米糠多糖[5-6]。
1.3.2 超声辅助提取米糠多糖单因素实验
分别设置功率为300、350、400、450、500W;温度分别调为40、50、60、70、80℃;料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25(V∶W);时间分别为20、25、30、35、40min进行单因素试验[7]。
1.3.3 超声辅助提取米糠多糖条件优化正交试验
在上述单因素实验结果的基础上,对影响米糠多糖得率的四大因素:温度、超声功率、料水比、时间,按L9(34)正交表进行正交试验,以筛选得到最优化的超声辅助提取米糠多糖的工艺参数。
1.3.4 多糖含量测定 采用硫酸苯酚法对米糠中提取的多糖含量进行测定[8]。
2 结果与讨论
2.1 标准曲线的绘制
量取0.lmg/mL葡萄糖标准溶液0、0.1、0.2、0.3、0.4、0.5、0.6、0.7mL置干燥比色管中,分别加蒸馏水使成1.0mL,再分别加入5%苯酚溶液1mL,摇匀。然后加浓硫酸5.0mL,充分摇匀,室温放置25min,在490nm处测定其吸光度值,结果如图1所示。从图1分析可知,回归方程y(A)=0.8182 x(mL)+0.0035,相关系数 R2=0.9948,可以看出,标准曲线的回归性较好,能够通过该方程进行米糠多糖含量的分析。
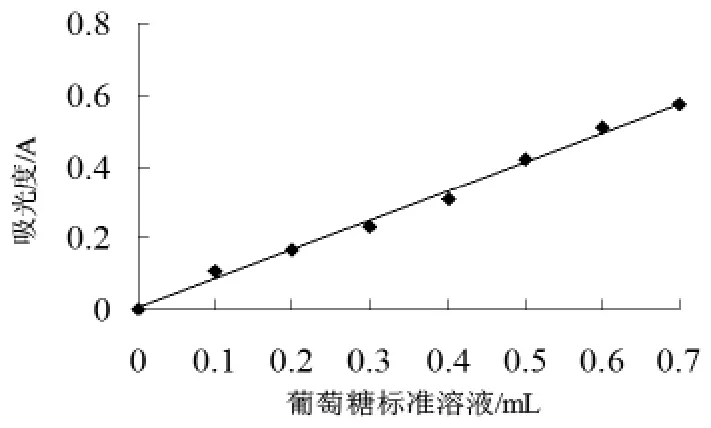
图1 米糠多糖的标准曲线
2.2 超声辅助提取米糠多糖单因素实验结果
2.2.1 超声功率对米糠多糖提取率的影响
选用不同功率(300~500W)的超声辅助提取米糠多糖,考察其在米糠多糖的提取过程中,对米糠多糖得率的影响。利用硫酸苯酚法测得该实验组提取液的吸光度值,通过计算,相应的米糠多糖得率变化趋势如图2所示。
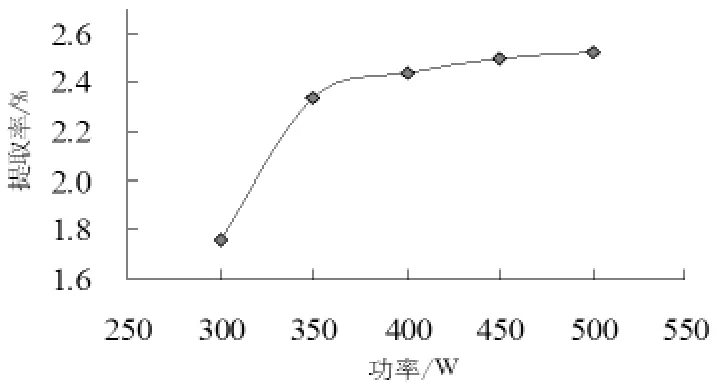
图2 超声功率对米糠多糖提取率的影响
从图2可以看出,功率在300~450W的范围内,随着功率的增大,多糖提取率也不断增大,但450~500W的范围内,多糖的提取率增长缓慢。
由于超声波可在液体中产生空化作用,而空化作用产生的冲击波和射流可破坏植物细胞和细胞膜结构,从而增加细胞内容物通过细胞膜的穿透能力,提高米糠多糖提取率。但在实验过程中发现功率达到450W之后,随功率升高,浸提液浑浊度也增加,影响后续的分离、纯化,一味的增加功率已经没有任何意义,所以考虑到实验的操作性和能源的节约,应用超声辅助提取米糠多糖时,选用450W左右的功率是比较适宜的。
2.2.2 温度对米糠多糖提取率的影响
选用不同温度(40~80℃)进行超声辅助提取米糠多糖,考察其在米糠多糖的提取过程中对米糠多糖得率的影响。结果如图3所示。
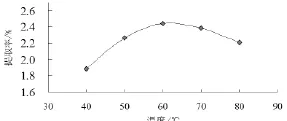
图3 温度对米糠多糖提取率的影响
从图3可以看出,从40~60℃范围内,随着温度的增加,多糖提取率也明显增加,当温度为60℃时,多糖得率达到最大值,但超过60℃多糖得率反而下降。
这主要是由于过高的提取温度会使糖苷键断裂,使多糖分解,有效成分丧失,导致提取率降低。采用超声辅助提取时,超声波本身也会释放大量的能量和热量,若提取温度设置过高,再加上超声波的这种放热作用会协助加速大分子多糖糖昔键断裂,所以多糖的得率反而会有所下降。考虑到实验效果和经济性,应用超声辅助提取米糠多糖时,选用60℃左右的中温是比较适宜的。
2.2.3 料液比对米糠多糖提取率的影响
选用不同料液比(1∶5~1∶25)进行超声辅助提取米糠多糖,考察其在米糠多糖的提取过程中,对米糠多糖得率的影响。结果如图4所示。
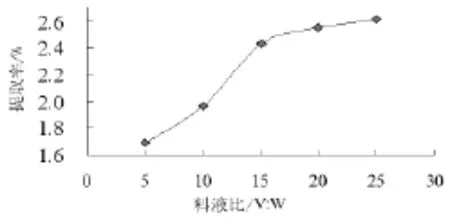
图4 料液比对米糠多糖提取率的影响
从图4可以看出,料液比在1∶5~1∶15范围内,随着料液比的增加,提取率明显升高,在1∶15~1∶25范围内,随着料液比的增加,提取率升高缓慢,总体来说米糠多糖提取率随着料液比的升高呈现上升趋势。
在1∶5~1∶15范围,料液比越大,溶剂越多,溶质扩散动力越大,多糖提取率越高,料液比达到1∶15时多糖已基本溶解到了提取液中,继续增加料液比,米糠多糖提取率虽然有所增加 ,但是同时会导致杂质的浸出率上升,而且料液比过高,导致提取液体积过大,为离心分离带来极大的不便,另外,提取液体积过大还会造成后续实验步骤中使用的酶和其他化学试剂的浪费,提高实验成本,考虑到多糖的有效成分、实验方便性和经济因素,超声辅助浸提法选择料液比l∶15为宜。
2.2.4 时间对米糠多糖提取率的影响
选用不同时间(20~40min)进行超声辅助提取米糠多糖,考察其在米糠多糖的提取过程中,对米糠多糖得率的影响。结果如图5所示。
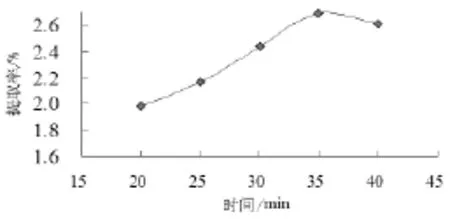
图5 时间对米糠多糖提取率的影响
从图5可以看出提取时间在35min内,提取时间越长,米糠多糖的提取率就越高,但当提取时间超过35min之后,多糖提取率缓慢下降。
在提取开始后,多糖提取率随着超声时间增加而明显提高,是由于超声波具有较强的空化作用和机械切力作用,从而使多糖提取率增加,在35min时达到最大值,之后随着时间延长开始下降。原因是超声作用时间过长,反而会使多糖糖苷键断裂,使有效成分减少,从而使多糖的提取率降低,从实用性和经济性的角度出发,超声处理时间选择在35min最合适。
2.3 正交试验测定结果
在上述单因素实验的基础上,对影响米糠多糖得率的因素:温度、超声功率、料水比、时间按L9(34)正交表进行正交试验,以筛选得到最优化的超声辅助提取米糠多糖条件组合。正交试验结果如表1所示。
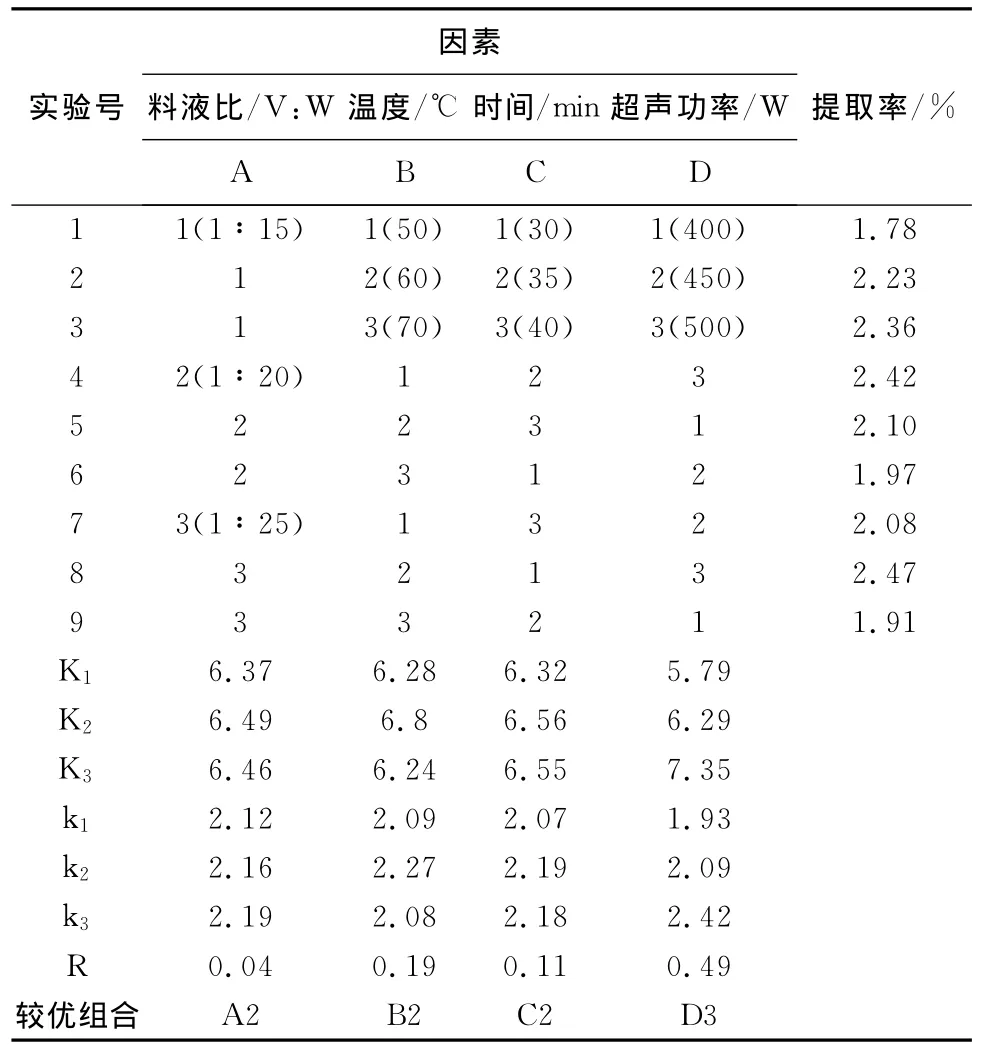
表1 米糠多糖提取正交实验结果
从正交实验结果看出,运用超声波辅助提取影响米糠多糖提取因素的主次顺序为D>B>C>A,即超声功率>温度>时间>料液比;最佳工艺为A2B2C2D3,即超声功率为450W,料液比为1∶20,温度为60℃,时间为35min,按此参数进行验证试验,提取率高达2.73%。
3 结论
本论文就超声辅助提取米糠多糖的影响因素,设计单因素实验,并以之为基础进行正交实验,对米糠多糖提取参数进行优化。优化后的超声辅助提取米糠多糖的最优工艺参数为:超声功率为450W,料液比为1∶20,温度为60℃,时间为35min,此时提取率高达2.73%。
与传统热水浸提的方法相比较,采用超声波辅助强化提取米糠多糖的方法能明显缩短提取时间,降低提取温度,避免了高温对活性成分的破坏,提高了提取效率。具有迅速、节能、高效的特点,是强化辅助提取多糖的好方法。
[1] 王永斌.米糠中功能性成分的研究现状和发展趋势[J].中国食物与营养,2006(5):67-68.
[2] Guohua Hu.Binding of four heavy metals to hemicelluloses from rice bran[J].Food Research International,2010(43):203-206.
[3] Lu R,Yoshida T.Structure and molecular weight of Asian lacquer polysaccharides[J].Carbohydrate Polymers,2003,54:419-424.
[4] Yamagishi T,Tsuboi T,Kikuchi K,et a1.Potent natural immunomodulator,rice water-soluble polysaccharide fractions with anti-complementary activity[J].Cereal Chemistry,2003,8(1):5-8
[5] 姜元荣,姚惠源,陈正行,等.碱溶性米糠多糖的提取及其免疫调节功能研究[J].中国粮油学报,2004,19(6):1-3.
[6] R Renuka Devi.C Arunmughan Photochemical characterization of defatted rice bran and optimization of Process for their extraction and enrichment[J].Bioresource Technology,2007,98(3):37-43
[7] 曾里,夏之宁.超声波和微波对中药提取的促进和影响[J].化学研究与应用,2002,14(3):245-249.
[8] Englyst H N,Quigley M E,Hudson G.J.Determination of dietary fibre as non-starch polysaccharides with gas-liquid chromatographic or spectrophotometric measurement of constituent sugars[J].The Analyst,1994,119:1497-1509.
