连翘ISSR-PCR反应体系的建立及优化
2013-12-28汤正辉祝亚军谭运德谭晓风
汤正辉,祝亚军 ,谭运德 ,谭晓风
(1. 中南林业科技大学,湖南 长沙 410004;2. 河南省林业科学研究院,河南 郑州 450008)
连翘ISSR-PCR反应体系的建立及优化
汤正辉1,2,祝亚军2,谭运德2,谭晓风1
(1. 中南林业科技大学,湖南 长沙 410004;2. 河南省林业科学研究院,河南 郑州 450008)
通过正交设计的方法优化连翘ISSR—PCR反应体系,PCR结果用MINITAB 16数据处理软件分析,建立了适用于连翘ISSR反应的最适反应体系(25 μL):Taq DNA聚合酶1.2U、Mg2+浓度1.5 mmol·L-1、模板DNA 20 ~ 80 ng、dNTPs 0.3 mmol·L-1、引物 0.3 μmol·L-1。进行了梯度退火试验,得到连翘 ISSR—PCR 反应体系最佳退火温度为55℃。
连翘;ISSR—PCR; 优化;正交设计
ISSR(Inter-simple Sequence Repeat)分子标记技术是由Zietkiewicz等[1]提出,用于检测微卫星SSR(Simple Sequence Repeat)之间的DNA序列差异。ISSR标记呈孟德尔式遗传,多数为显性标记,该技术操作简单快速、简便,实验成本较低[2]。在单子叶植物与双子叶植物基因组中SSR均匀分布,ISSR技术依据SSR这种分布特点而设计引物,从而检测2个SSR之间的DNA序列差异。ISSR分子标记技术已在多种植物的遗传多样性检测、遗传多样性亲缘关系分析、种质鉴定、基因定位、和遗传图谱构建等研究方面得到成功的应用[3-6]。
连翘Forsythia suspensa (Thunb.) Vahl,木犀科,连翘属,别名黄寿丹、黄绶丹、绶带。分布于我国东北、河北、山东、河南、山西、陕西、甘肃等省[7],生长在海拔250~2 200 m之间的阳坡或半阳坡的灌丛或林缘。连翘是重要的经济型灌木资源,具有药用、观赏等重要的经济价值,而且是造林绿化、干旱半干旱地区植被建设的重要材源。连翘是常用大宗药材,已成为银翘解毒片、双黄连口服液等中药的主要原料。河南省是全国连翘的主要产区之一,野生连翘主要分布于太行山、崤山、熊耳山、伏牛山等山区[8]。河南省内分布的连翘亲缘关系未见报道,这对良种筛选、杂交育种带来一定的困难。当前,野生连翘分子生物学研究较少,尚未见有关连翘ISSR分子标记的研究报道。ISSR反应体系因不同植物材料及不同引物的扩增条件导致反应体系存在差异,反应体系中的试剂浓度,PCR反应的变性温度等条件需通过试验进行优化。本次试验采用正交设计L16(45)方法,用野生连翘F. suspensa叶片基因组DNA为模板,分析了Taq DNA聚合酶、Mg2+的浓度、模板DNA、dNTPs及引物的用量对ISSR—PCR扩增结果的影响,建立并优化了适用于连翘ISSR分析的反应体系。
1 材料与方法
1.1 材 料
野生连翘(F. suspensa)取自河南省连翘主产区的栾川县,选当年生叶片,于阴天采集,-70℃冰箱保存。引物由上海英骏生物技术有限公司合成,使用的ISSR引物序列由加拿大哥伦比亚大学UBC公司2006年公布。此次正交试验的固定引物采用初步筛选出的引物UBC825,即(AC)8T。Taq DNA聚合酶,琼脂糖,100 bp DNA Ladder Marker等均购自宝生物公司的Takara产品。
1.2 提取基因组DNA
采用天根生化科技(北京)有限公司的植物基因组DNA提取试剂盒提取连翘基因组DNA,使用Beckman DU-640核酸蛋白分析仪测定DNA浓度和纯度,并将浓度稀释为80 ng·μL-1。
1.3 正交表的设计与PCR反应因素水平的确定
采用正交设计L16(45),在4个水平上试验PCR反应中Taq DNA聚合酶、Mg2+的浓度、模板DNA、dNTPs及引物的最佳水平。PCR反应各因素水平表及L16(45)设计方案分别见表1、表2。
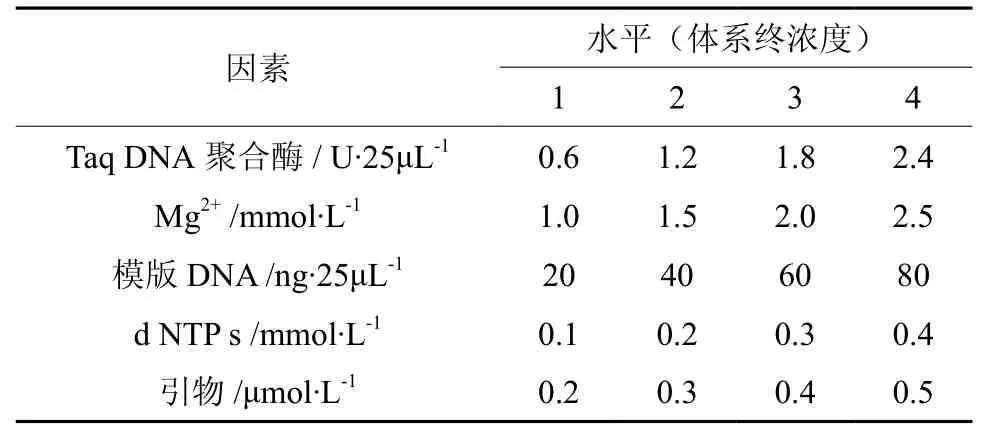
表1 PCR反应因素水平Table 1 Factors and levels of PCR reaction
表2的16个处理重复试验2次,在BIO-RAD Mycycler Thermal Cycler System扩增仪上进行扩增反应。参考木犀科其他物种的研究结果[5],确定本试验初始反应程序:94℃预变性5 min;94℃变性1 min,52℃退火45 sec,72℃延伸2 min,45个循环;72℃再延伸5 min;4℃保温。PCR产物电泳用1.2%琼脂糖凝胶(含SYBR GreenⅠ核酸染料),电压3 V·cm-1,电泳结果采用BIO-RAD Gel DocTM XR凝胶成像系统拍照。使用MINITAB 16软件进行数据分析,得到连翘ISSR—PCR反应各因素的最佳水平,最后使用BIO-RAD PTC240扩增仪进行PCR反应体系梯度退火试验,筛选出最佳退火温度。
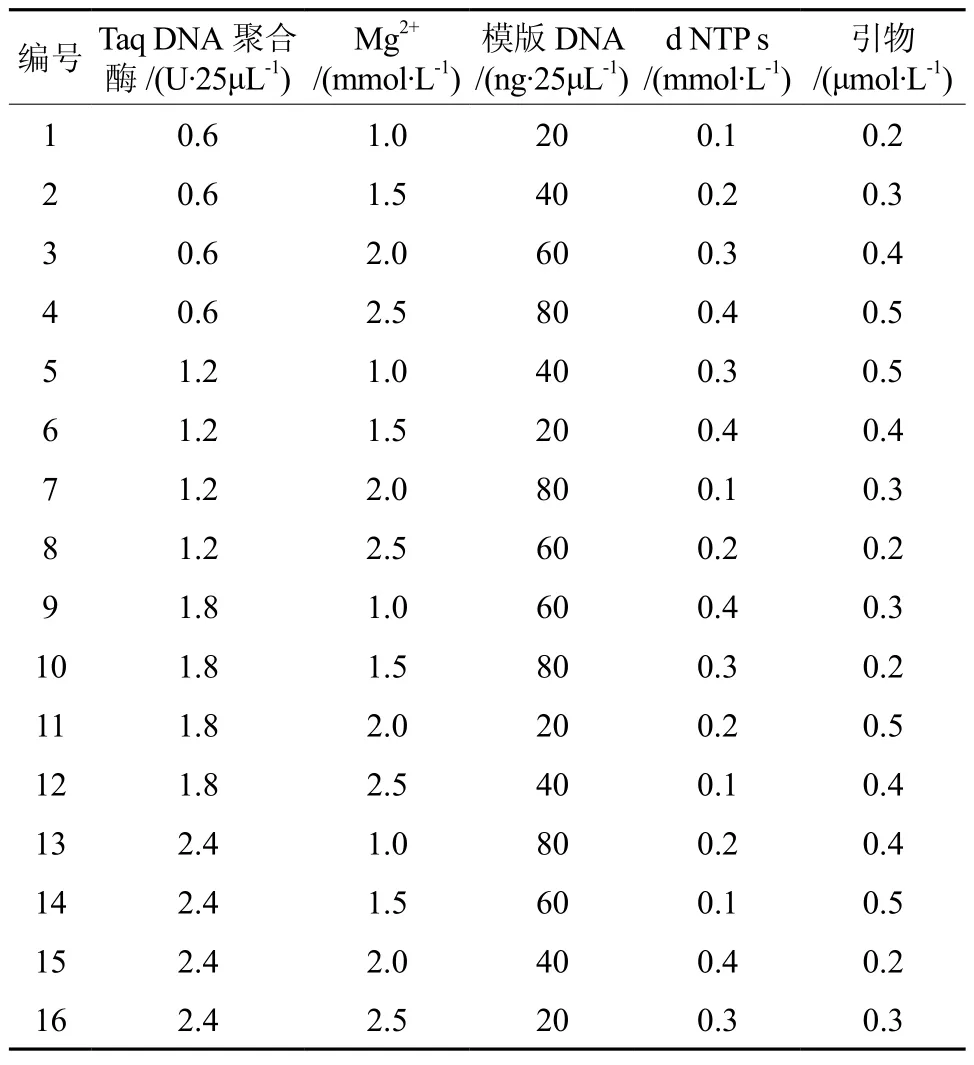
表 2 PCR反应L16(45)正交试验设计Table 2 L16(45) orthogonal design for PCR reaction
2 结果与分析
2.1 电泳结果评分
试验共16个处理(见表2),重复进行2次PCR反应,分别对2次所得产物进行电泳,结果见图1A和图1B。按本试验目的,及以后将要进行遗传多样性分析的要求,将图1的电泳结果从高到低打分。背景低、清晰度高、条带数量丰富的最佳产物记为16分,与此相反,最差的结果记为1分[9-11]。独立统计两次重复的结果,两次试验的结果具有较高的一致性。按照表2次序得到的分数分别记为:12、15、10、8、14、16、13、4、6、9、11、2、3、1、7、5;以及 13、14、11、8、15、16、12、4、7、9、10、3、2 、1、6、5。
2.2 不同的反应因素水平对ISSR-PCR反应的影响
使用MINITAB 16软件对试验数据进行方差分析,详见表3。依F值可知,对反应结果影响最大的因素是Taq DNA聚合酶的浓度,影响最小的因素为引物浓度,各因素参数变化对PCR反应的影响大小依次为:Taq DNA聚合酶、Mg2+、模板DNA、dNTPs、引物。本试验的5个因素不同水平间的差异为极显著水平,可进一步进行因素间的多重比较。
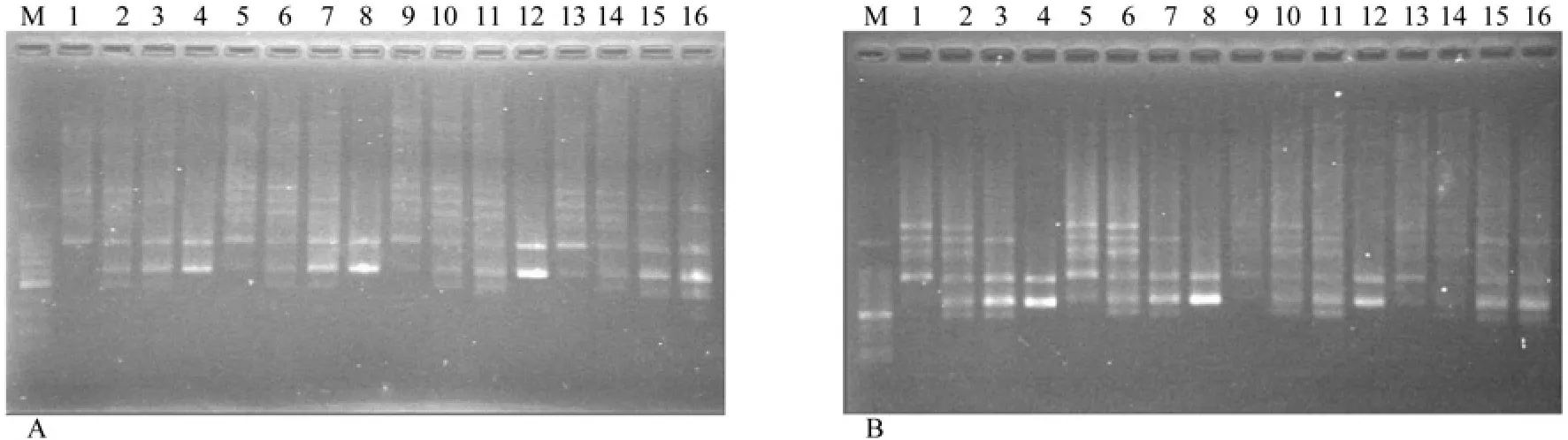
图1 ISSR—PCR正交试验电泳结果Fig. 1 Electrophoresis of ISSR—PCR orthogonal design
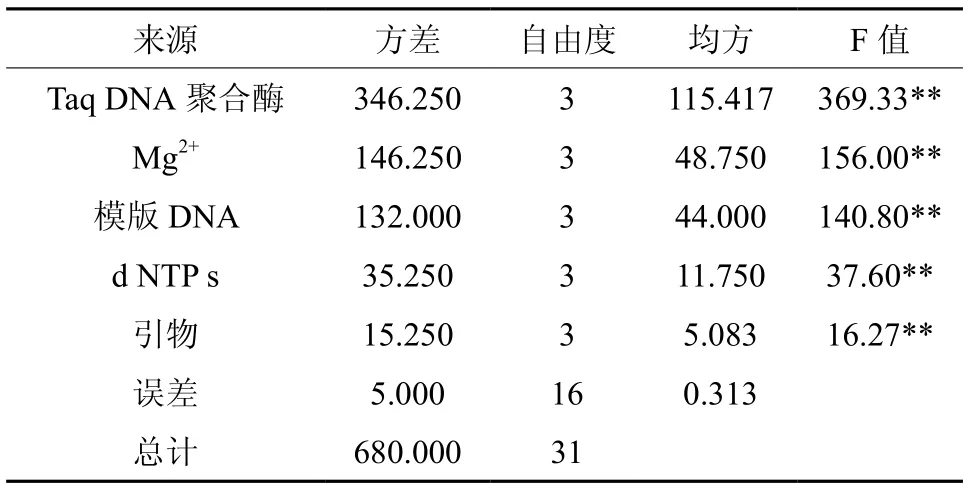
表 3 5因素的方差分析Table 3 Variance analysis of five factors
2.3 ISSR—PCR反应各因素的比较
2.3.1 Taq DNA聚合酶水平对PCR结果的影响
Taq DNA聚合酶的0.6 U与1.2 U水平间的差异不显著,0.6 U与1.8 U、2.4 U以及1.2 U与1.8 U、2.4 U水平间的差异均达到显著水平(见图2)。由关系曲线的波动可知,Taq酶浓度对本试验结果影响相对最大。Taq DNA聚合酶浓度过高可明显增强条带亮度,但条带数减少(见图1),会造成假阳性;如果浓度过低,则反应不充分。这些情况都不利于遗传多态性分析。此次试验达到了的最佳效果的Taq DNA聚合酶水平为1.2U。
2.3.2 Mg2+浓度对PCR结果的影响
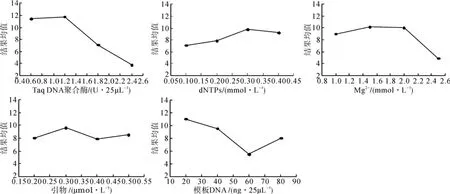
图2 结果均值与5因素的关系Fig. 2 Relationship between mean values and fi ve factors
根据方差分析,Mg2+浓度 1.0 mmol·L-1、1.5 mmol·L-1、2.0 mmol·L-1水平间表现无显著差异,而这三个水平均与2.5 mmol·L-1有显著差异。如图2所示,1.5 mmol·L-1、2.0 mmol·L-1水平上整体效果较好。考虑到试验成本,1.5 mmol·L-1为本试验所得Mg2+的最佳反应浓度。
2.3.3 模板浓度对PCR结果的影响
模板各浓度水平对反应结果的影响有差异,表 现 为 20 ng·25μL-1、40 ng·25μL-1、80 ng·25μL-1水平间无显著差异,这三者与60 ng·25μL-1水平间均差异显著(见图2)。说明本试验所选模板DNA的梯度水平对PCR反应影响较小,这一结论与其他研究[9,11]相似。模板DNA 在20~80 ng范围内均适用于本试验。
2.3.4 dNTPs浓度对PCR结果的影响
由于PCR反应中的Mg2+会与过量dNTPs分子中的磷酸集团定量结合,从而降低实际反应中的Mg2+的浓度,进而影响PCR反应,所以dNTPs不宜过量;但过少会使扩增反应进行不充分。根据多重比较及图2分析得出本试验dNTPs最佳反应浓度为 0.3 m mol·L-1。
2.3.5 引物浓度对PCR结果的影响
从图 2 可见,引物 0.2 μmol·L-1、0.4 μmol·L-1、0.5 μmol·L-1水平间无显著差异,而三者均与0.3 μmol·L-1水平差异显著。在本试验梯度范围内引物对ISSR—PCR的反应结果影响最小。PCR反应结果在引物 0.3,0.4,0.5 μmol·L-1水平时呈下降趋势,说明 0.3 μmol·L-1为本试验引物最佳水平。
2.4 PCR反应退火温度的确定
PCR反应中,DNA模板与引物的特异性结合直接受退火温度高低的影响。在BIO-RAD PTC240扩增仪上自动生成10个温度(最低设置为47.2℃,最高设置为57.4℃)水平,用以上所得最佳因素水平进行梯度退火试验,电泳检测PCR产物,结果(见图3)表明,较低的退火温度扩增特异性差,背景颜色较深;过高的退火温度则引物与模板不易结合,PCR产物丰度低,条带亮度低。试验确定最佳退火温度为55℃。
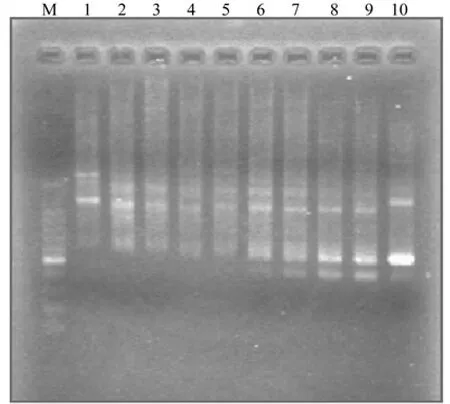
图3 退火温度对ISSR—PCR反应的影响Fig. 3 Effects of annealing temperature on ISSR—PCR reaction
2.5 适用于连翘的ISSR—PCR最优扩增体系
利用本试验建立的最适扩增反应体系对10份不同地区野生连翘种质进行ISSR—PCR扩增,图4是用引物UBC825扩增10个连翘样本的PCR结果,退火温度55℃。从图中可以看出,应用本次试验所得的ISSR—PCR扩增反应体系对所有样品均能得到易于辨认的条带。
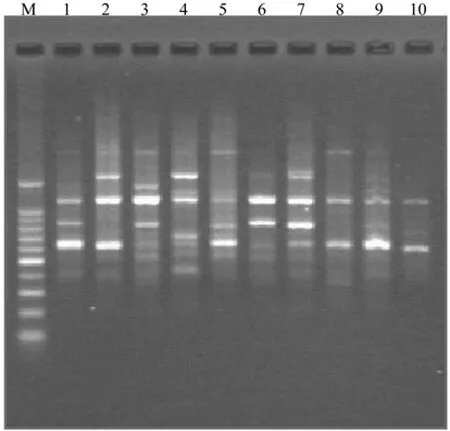
图4 10份不同连翘种质的ISSR指纹图谱Fig. 4 ISSR fi ngerprinting of 10 different F. suspensa germplasms
3 讨 论
本试验以连翘DNA为模版,建立了分辨率高、重复性好的ISSR—PCR反应体系。在25 μL反应体系中,含1.2 U Taq DNA聚合酶、1.5 mmol·L-1Mg2+、20 ~ 80 ng 模版 DNA、0.3 mmol·L-1dNTPs、0.3 μ mol·L-1引物;最佳退火温度为 55℃。扩增程序为:94℃预变性5 min;94℃变性1 min,55℃退火45 sec,72℃延伸2 min,45个循环;72℃再延伸5 min;4℃保温。
已有的ISSR—PCR体系优化的报道较多,有些是采用多次梯度试验的方法确定每个因素的最佳水平,费时费力,繁琐,且不易比较多因素之间的相互作用[12-14]。由何正文等[15]提出关于正交设计的方法优化ISSR—PCR反应条件,该方法在不少研究中得到采用[9-11,16],得到的反应体系较为可靠。本次试验借鉴了正交设计优化PCR反应体系的试验方法,并借助统计软件分析试验结果,使结果更科学。本次试验为野生连翘遗传多样性亲缘关系的分析、遗传育种和构建物理图谱等研究奠定了基础。
[1] Zietkiewicz E, Rafalski A, Labuda D. Genome fingerprinting by simple sequence repeat (SSR) –anchored polymerase chain reaction amplif i cation [J]. Genomics, 1994, 20: 176-183.
[2] Reddy M P, Sarla N, Siddiq E A. Inter simple sequence repeat(ISSR) polymorphism and its application in plant breeding [J].Euphytica, 2002, 128: 9-17.
[3] Santiago M, Juan P M, Jesús M O. Inter-simple sequence repeats PCR for characterization of closely related grapevine germplasm[J]. Euphytica, 1998, 101: 117-125.
[4] 张党权, 田 华, 谢耀坚, 等. 细叶桉遗传多样性的ISSR分析[J]. 中南林业科技大学学报, 2009, 29(5): 91-94.
[5] 胡绍庆, 邱英雄, 吴光洪, 等. 桂花品种的ISSR-PCR分析[J].南京林业大学学报: 自然科学版, 2004,28(增刊)(9):71-75.
[6] 葛永奇, 邱英雄, 丁炳扬, 等. 孑遗植物银杏群体遗传多样性的ISSR分析[J]. 生物多样性, 2003, 11(4): 276-287.
[7] 中国科学院植物研究所. 中国高等植物图鉴(第三册)[M].北京: 科学出版社, 1983.
[8] 田朝阳, 田国行. 河南野生观赏植物志[M]. 北京: 科学出版社, 2010.
[9] 谢运海, 夏得安, 姜 静, 等. 利用正交设计优化水曲柳ISSR-PCR反应体系[J]. 分子植物育种, 2005, 3(3): 445-450.
[10] 林 萍, 张含国, 谢运海. 正交设计优化落叶松ISSR-PCR反应体系[J]. 生物技术, 2005, 15(5): 34-37.
[11] 曾艳玲, 谭晓风, 曾晓峰. 采用正交设计方法优化梨ISSRPCR反应体系[J]. 湖北农业科学, 2008, 47(11): 1235-1238.
[12] 姚明哲, 王新超, 陈 亮, 等. 茶树ISSR-PCR反应体系的建立[J]. 茶叶科学, 2004, 24(3): 172-176.
[13] 邢建宏, 陈存及, 张国防, 等. 樟树ISSR-PCR反应体系优化研究[J]. 福建林业科技, 2006, 33(3): 96-100.
[14] 曾艳玲, 谢 鹏, 谢耀坚, 等. 桉树ISSR-PCR反应体系的建立及优化[J]. 中南林业科技大学学报, 2008, 28(1): 44-48.
[15] 何正文, 刘运生, 陈立华, 等. 正交设计直观分析法优化PCR条件[J]. 湖南医科大学学报, 1998, 23(4): 403-404.
[16] 李 鹏, 汪阳东, 陈益存, 等. 油桐ISSR-PCR最佳反应体系的建立[J]. 林业科学研究, 2008, 21(2): 194-199.
Establishment and optimization of Forsythia suspensa ISSR—PCR reaction system
TANG Zheng-hui1,2, ZHU Ya-jun2, TAN Yun-de2, TAN Xiao-feng1
(1. Central South University of Forestry & Technology, Changsha 410004, Hunan, China;2. Henan Academy of Forestry, Zhengzhou 450008, Henan, China)
The ISSR—PCR amplif i cation system of Forsythia suspensa was optimized by using orthogonal design method with fi ve factors (Taq DNA polymerase, Mg2+, DNA template, dNTPs and primer) and four levels respectively. The results of PCR was analyzed by software MINITAB. A suitable ISSR reaction system was established. It is 25 μL reaction system, containing 1.2 U Taq DNA polymerase, 1.5 m mol·L-1Mg2+, 20~80 ng DNA template, 0.3 m mol·L-1dNTPs and 0.3 μmol·L-1primer. Through the gradient PCR test,the optimal annealing temperature for ISSR—PCR reaction turned out to be 55℃.
Forsythia suspensa; orthogonal design; optimization; ISSR—PCR
S718.46
A
1673-923X(2013)10-0053-04
2013-03-04
国家林业公益性行业科研专项(编号:200904024);河南省博士后科研资助(编号:2011044)
汤正辉(1973-),男,河南开封人,博士,研究方向为森林培育;E-mail:zhenghuitang321@126.com
祝亚军(1978-),男,河南信阳人,硕士,研究方向为森林培育;Email:zhu_yajun@126.com
[本文编校:吴 彬]
